绿原酸缀合物HA-CGA的抗菌活性研究
2023-04-29李肖寒程雪丹张智博胡博凯段少峰
李肖寒 程雪丹 张智博 胡博凯 段少峰
摘要:目的 合成透明质酸(HA)-绿原酸(CGA)的水溶性缀合物HA-CGA并对其结构进行表征,并比较该缀合物与单体药物CGA的抗菌活性。方法 将HA溶于水中,用1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐(EDC·HCl)将其活化,然后加入溶于DMF的CGA进行酯化反应,最后将反应溶液在水中透析除杂,冻干,得到缀合物HA-CGA,并采用核磁共振氢谱法、红外光谱法对HA-CGA结构进行表征;采用平板计数法来比较CGA和HA-CGA对大肠埃希菌、金黄色葡萄球菌等2种细菌的抑制作用。结果 CGA和HA-CGA对2种细菌均有不同程度的抑制作用,其中HA-CGA抗菌活性強于CGA。结论 通过HA对CGA的结构进行修饰,增加了CGA的水溶性,进一步提高了CGA的抗菌性能。
关键词:绿原酸;透明质酸;缀合物;水溶性;抗菌活性
中图分类号:R9文献标志码:A
Abstract Objective To synthesize and characterize the water-soluble conjugate of hyaluronic acid (HA)-chlorogenic acid (CGA) (HA-CGA), and to compare the antibacterial activity of the conjugate with that of the free drug CGA. Methods HA was dissolved in water, activated by 1-ethyl-(3-dimethylaminopropyl) carbodiimide hydrochloride (EDC·HCl), and followed by the addition of a solution of CGA dissolved in DMF for esterification reaction. Finally, the reaction solution was dialyzed in water to remove impurities and then lyophilized to obtain the conjugate HA-CGA. The structure of HA-CGA was characterized by nuclear magnetic resonance spectroscopy (1H NMR) and infrared spectroscopy (FT-IR). The inhibitory effects of CGA and HA-CGA on Escherichia coli and Staphylococcus aureus were compared by the plate counting method. Results CGA and HA-CGA had different inhibitory effects on the two bacteria, and the antibacterial activity of HA-CGA was stronger than that of CGA. Conclusion By modifying the structure of CGA with HA, the water solubility of CGA was increased and its antibacterial activity was further improved.
Key words Chlorogenic acid; Hyaluronic acid; Conjugated; Water soluble; Antimicrobial activity
绿原酸(chlorogenic acid, CGA)又名咖啡宁酸,属于苯丙素类物质,主要存在于忍冬科忍冬属和菊科嵩属植物中,是人类饮食中含量最丰富的多酚类化合物之一,是某些植物产生的一组酚类次生代谢产物,是咖啡的重要成分[1-3]。CGA表现出很好的生物学特性,具有抗病毒、抗菌、消炎、清除自由基等多种药理作用[4-6]。
透明质酸(hyaluronic acid, HA)又名玻璃酸,在高等动物体内以及人体各组织内广泛分布[7],是天然存在于细胞外基质和滑膜液的一种线性大分子酸性黏多糖[8],是细胞外基质的重要组成部分[9]。HA具有高亲水性、优异的生物相容性以及生物可降解性,因此HA多用于结构修饰其他药物,进而来增加该药物的水溶性,提高其生物利用度[10-12]。
本研究重点对CGA的抗菌性能进行了研究,但发现CGA的水溶性差,在25℃水中的溶解率仅5%[13],这大大影响了它的抗菌性能。利用水溶性良好的透明质酸对绿原酸进行结构修饰,得到的绿原酸缀合物水溶性良好,其抗菌性能也得到了大幅度提高。
1 材料与方法
1.1 仪器
VERTEX70型傅里叶变换红外光谱仪(德国Bruker公司);AVANCE-400 MHz型核磁共振氢谱仪(瑞士Bruker BioSpin有限公司);LDZX-75KBS型高压灭菌锅(上海申安医疗器械厂);PHSJ-4F型PH计(中国上海仪器公司);BSD-YX2200型立式智能精密摇床(上海博迅实业有限公司医疗制备厂);SW-SJ-2D型双人单面垂直送风净化工作台(中国苏州智净净化设备有限公司);BCD-516WKM(E)型电冰箱(合肥美的电冰箱有限公司);LGJ-18B型冷冻干燥机(北京四环科学仪器厂有限公司);BSA224AS-CW型电子分析天平(赛多利斯仪器有限公司);WLF-250型纯化水设备(泰州万隆水处理工程有限公司);移液枪(各种规格,上海佳安分析仪器厂);90 mm玻璃培养皿(江苏华夏瑞泰塑业有限公司)。
1.2 试剂
绿原酸(纯度98%)购于埃法生物有限公司;透明质酸(批号1905012,分子量8000 Da)购于山东福瑞达生物有限公司;N,N-二甲基甲酰胺(DMF)和1-乙基-(3-二甲氨基丙基)碳二亚胺盐酸盐(EDC·HCL)均购于国药试剂公司;4-二甲氨基吡啶(DMAP)购于上海阿拉丁公司;氯化钠、磷酸氢二钠、磷酸二氢钠购于天津德恩有限公司;酵母浸粉、琼脂、蛋白胨购于北京奥博星生物技术有限公司。
1.3 绿原酸缀合物的合成
精密称定403 mg(1.05 mmol)的透明质酸(HA,分子量为8000 Da)溶于4 mL蒸馏水,在磁力搅拌器下使HA溶胀均匀;然后将768 mg(4 mmol)的EDC和12.9 mg(0.1 mmoL)的DMAP加入到HA水溶液中,在冰浴的条件下,经搅拌活化2 h;将354.3 mg(1 mmol)的CGA完全溶解于4 mL DMF并加入上述反应中;室温搅拌24 h,将溶液转移至透析袋(截留分子量3500 Da)进行透析。透析后,将溶液转移至玻璃培养皿中,在-20℃冰箱预冷冻2 h后置于冷冻干燥机中进行冻干,2 d后取出即得HA-CGA。
1.4 抑菌实验
1.4.1 液体培养基的制备
1 g蛋白胨、1 g氯化钠和0.5 g酵母粉溶解在100 mL蒸馏水制成细菌培养液体培养基,进行高压灭菌,备用。
1.4.2 菌液制备
取500 μL冻存的金黄色葡萄球菌、大肠埃希菌,分别接种于50 mL液体培养基中,在37℃恒温摇床上振摇12 h,再从上述液体培养基中取500 μL,加入新的50 mL的灭菌液体培养基中,再在37℃恒温摇床上振摇12 h,按此方法培养到第三代,后续抗菌实验均用第三代菌种进行。
1.4.3 药液制备
以灭菌后的PBS(pH 7.4)为溶剂,将HA、CGA、HA-CGA分别配置成15、10 和1 mg/mL的母液备用。临配置前,需将所需药物照紫外灭菌。在这里需要注意的是,在配置1 mg/mL HA-CGA母液时,根据其接枝率约为24%来算得HA-CGA中CGA的含量来进行母液浓度配置。
1.4.4 最低杀菌浓度(MBC)的测定
首先将金黄色葡萄球菌和大肠埃希菌菌液稀释成1×104 CFU/mL备用,再将配置的母液依次稀释成所需的药物浓度。以金黄色葡萄球菌为例,分为HA、CGA、HA-CGA 3组,各取7只灭菌试管并进行编号,无菌操作,每管共分别加入0.9 mL不同药物浓度的HA、CGA、HA-CGA以及PBS试剂,第7管加入灭菌后的0.9 mL PBS(pH 7.4)作为阳性对照。各管再加入0.1 mL稀释好的菌液,在37℃恒温摇床培养24 h,然后再从各管中取出0.1 mL均匀涂布在营养琼脂平板表面,再将其放置于37℃恒温摇床培养12 h,取出后,对琼脂板的菌落数进行读数。重复该实验3次,未见菌落生长的最低浓度则为最低杀菌浓度(MBC)。
2 结果与分析
2.1 核磁共振氢谱分析
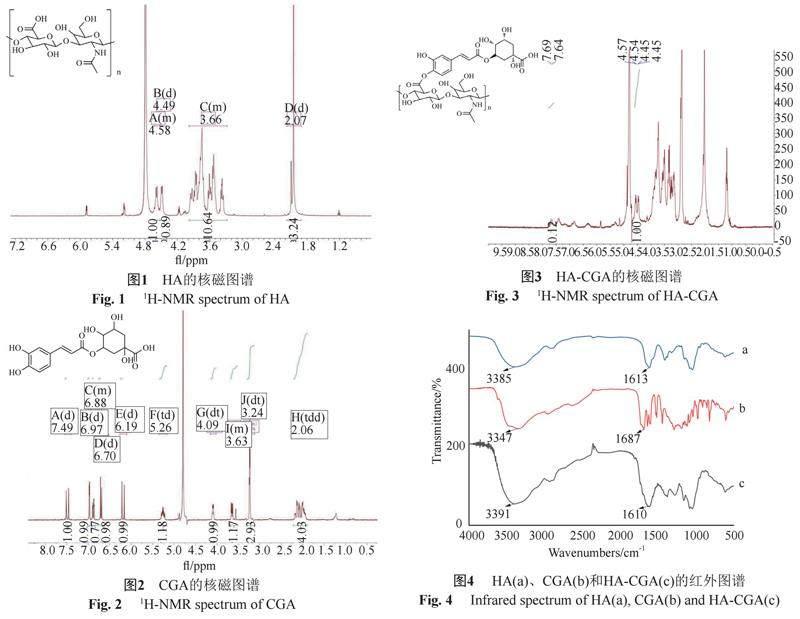
2.1.1 HA的核磁图谱表征结果
1H NMR (400 MHz, D2O) δ4.63~4.53 (m, 1H), 4.49 (d, J=6.8 Hz, 1H), 3.99~3.28 (m, 11H), 2.07 (d, J=17.2 Hz, 3H),结果如图1所示。
2.1.2 CGA的核磁图谱表征结果
1H NMR (300 MHz, MeOD) δ 7.49 (d, J=15.9 Hz, 1H), 6.97 (d, J=2.0 Hz, 1H), 6.90~6.82 (m, 1H), 6.70 (d, J=8.2 Hz, 1H), 6.19 (d, J=15.9 Hz, 1H), 5.26 (td, J=9.1, 4.5 Hz, 1H), 4.09 (dt, J=6.3, 3.2 Hz, 1H), 3.68~3.52 (m, 1H), 3.24 (dt, J=3.2, 1.6 Hz, 3H), 2.06 (tdd, J=17.8, 13.6, 6.4 Hz, 4H)。结果如图2所示。
2.1.3 HA-CGA的核磁图谱表征结果
合成的HA-CGA为淡绿色粉末,δ(4.25~4.75 ppm)处的位移为HA上的特征氢,δ(7.5~8.0 ppm)處的位移为CGA上的特征氢,通过积分计算可以得知HA和CGA的接枝率约为24%。核磁数据如图3所示。
2.1.4 HA、CGA、HA-CGA的FT-IR分析
HA、CGA 、HA-CGA的FT-IR图谱如图4所示。在HA中,在3385 cm-1处的吸收峰为-OH伸缩振动峰,1613 cm-1为羧基上的C=O伸缩振动峰;在CGA中,在3347 cm-1处的吸收峰为-OH伸缩振动峰,1687 cm-1为酯基上的C=O伸缩振动峰。在HA-CGA中,在3391 cm-1处的吸收峰为HA和CGA上的-OH伸缩振动峰,1613 cm-1为HA-CGA上的羰基峰,和CGA上1687 cm-1的C=O伸缩振动峰相比,峰形变宽,说明HA和CGA以酯键连接。这也证明了HA-CGA的生成。
2.2 抑菌实验结果
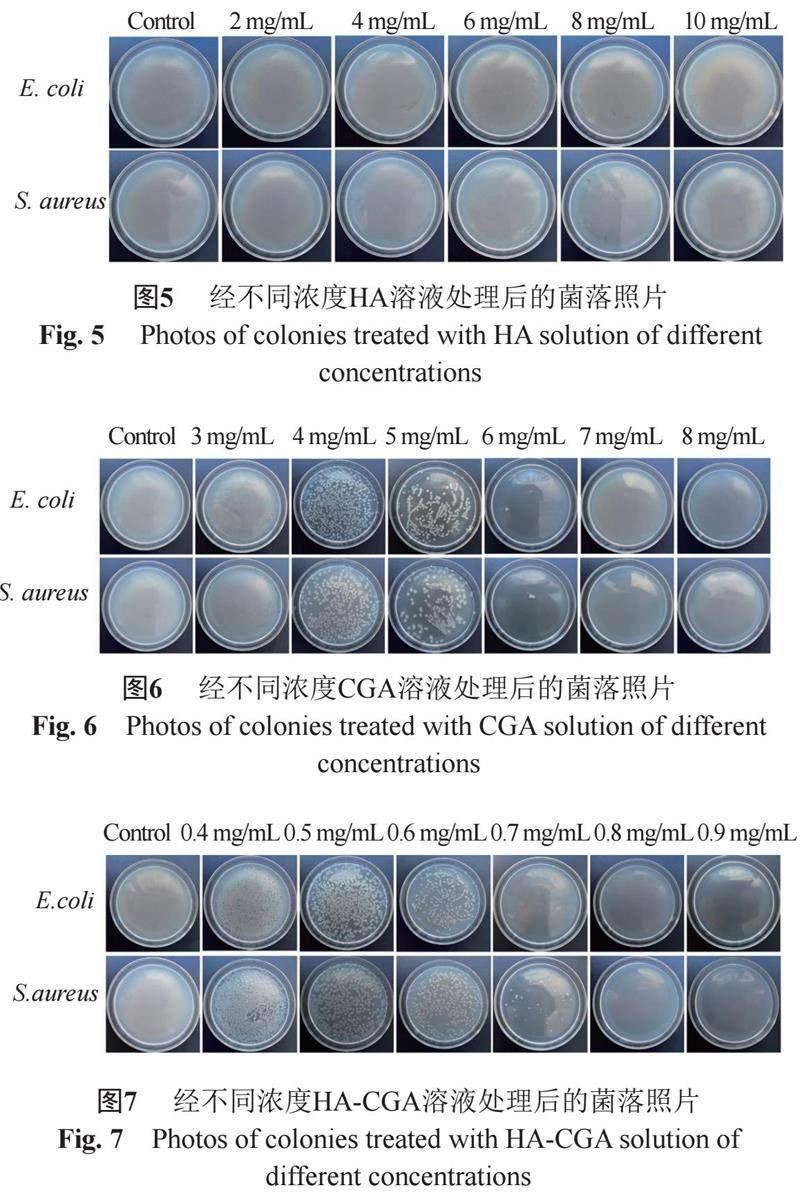
HA的抗菌效果如图5所示,高浓度的HA作用于大肠埃希菌和金黄色葡萄球菌,菌落和空白对照组相比,无明显变化,由此可以判定HA几乎没有抗菌作用。抗菌是CGA的生物特性之一,实验结果见图6,不同浓度下的CGA表现出不同的抗菌效能,浓度越高,杀菌能力越强,对大肠埃希菌和金黄色葡萄球菌的MBC均为7 mg/mL。由图7可知,HA-CGA对大肠埃希菌的MBC大约为0.7 mg/mL,对金黄色葡萄球菌的MBC大约为0.8 mg/mL,与CGA单体的杀菌效果相比,HA-CGA的杀菌效果明显更为显著。
3 讨论与展望
抗菌性是CGA的药理作用之一,但因其水溶性差,生物利用度低,严重影响了它的抗菌性能。因此,本课题中,选用水溶性天然高分子材料HA作为药物载体,通过酯化反应对CGA的结构进行改造,使其通过酯键与HA形成水溶性缀合物,以期提高CGA的水溶性差和生物利用度低,进而改善其抗菌性能。HA为天然高分子材料,易于降解,对实验的影响可以忽略。本反应条件温和,操作简单,便于一次性大剂量合成。
本实验通过采用核磁共振氢谱法、红外光谱法对合成的绿原酸缀合物HA-CGA的结构进行了表征。结果证明,CGA成功地接枝到了HA上,且CGA接枝率为24%;采用平板计数法得出CGA和HA-CGA对大肠埃希菌、金黄色葡萄球菌这2种细菌均有不同程度的抑制作用,并且HA-CGA的抗菌活性比单体药物CGA强,初步证实了通过HA结构修饰,CGA的水溶性得到了提高,且抗菌能力得到了改善。因此,水溶性HA-CGA作为一种新型抑菌材料,具有较大的应用前景。同时,本研究工作也为改造其他难溶性抗菌药物提供了新思路。
参 考 文 献
王庆华, 杜婷婷, 张智慧, 等. 绿原酸的药理作用及机制研究进展[J]. 药学学报, 2020, 55(10): 2273-2280.
王玲娜, 姚佳欢, 马超美. 绿原酸的研究进展[J]. 食品与生物技术学报, 2017, 36(11): 1121-1130.
Naveed M, Hejazi V, Abbas M, et al. Chlorogenic acid (CGA): A pharmacological review and call for further research[J]. Biomed Pharmacother, 2017, 97: 67-74.
Meng S, Cao J, Feng Q, et al. Roles of chlorogenic acid on regulating glucose and lipids metabolism: A review[J]. Evid Based Complement Altern Med, 2013, 2013: 801457.
魏宇超, 孙磊, 徐美利, 等. 绿原酸的体外抑菌效果研究[J]. 饲料研究, 2020, 43(7): 69-72.
Farah A, Monteiro M, Donangelo C M, et al. Chlorogenic acids from green coffee extract are highly bioavailable in humans[J]. J Nutr, 2008, 138(12): 2309-2315.
杨洁, 祝宏, 刘永琼, 等. 透明质酸的制备及其应用进展[J]. 化学与生物工程, 2005, 22(1): 7-9.
陈建澍, 王婧茜, 易喻, 等. 透明质酸及其衍生物研究进展[J]. 中国生物工程杂志, 2015, 35(2): 111-118.
张蕾, 吴迪, 孙巍, 等. 透明质酸的制备及应用研究进展[J]. 微生物学杂志, 2006, 26(2): 100-103.
李霞, 王玉玲, 郭学平. 透明质酸在外用传递系统中的应用研究进展[J]. 中国美容医学, 2021, 30(1): 177-180.
张堃, 简军, 张政朴. 透明质酸的结构、性能、改性和应用研究进展[J]. 高分子通报, 2015, 28(9): 217-226.
胡樂坚, 刘富垒, 李凌超, 等. 两亲性透明质酸衍生物的合成及其在抗肿瘤纳米药物递送系统中的应用[J]. 药学进展, 2017, 41(11): 804-811.
Karunanidhi A, Thomas R, Van B A, et al. In vitro antibacterial and antibiofilm activities of chlorogenic acid against clinical isolates of stenotrophomonas maltophilia including the trimethoprim/sulfamethoxazole resistant strain[J]. Biomed Res Int, 2012, 2013(2013): 392058.
基金项目:河南省重点研发与推广专项(科技攻关)项目(No. 212102311025);大学生创新项目(No. MSCXSY-2020-079)
作者简介:李肖寒,女,生于1998年,在读硕士研究生,主要研究方向为药剂学,E-mail: 2841226891@qq.com
