胶体金免疫层析法在碳青霉烯酶检测中的价值及应用
2023-04-29张鸿娟孟雪斐宋贵波单斌
张鸿娟 孟雪斐 宋贵波 单斌
摘要:目的 系統性评价胶体金免疫层析法在耐碳青霉烯类肠杆菌目细菌(CRE)碳青霉烯酶型检测中的价值及性能情况,为实验室进行CRE碳青霉烯酶快速检测提供可靠依据。方法 对收集的70株无菌部位分离的CRE菌株同时使用PCR扩增、基因测序和胶体金免疫层析法进行碳青霉烯酶型检测,以测序结果为参考标准,评价胶体金免疫层析法的实验室检测性能。结果 检出碳青霉烯酶基因69株,其中KPC型49株,OXA-48型12株,IMP型1株,NDM型3株,同时检出KPC和OXA-48型2株,同时检出OXA-48和NDM型1株,同时检出KPC和NDM型1株,未检出以上5种基因型1株。胶体金免疫层析法结果与测序结果相比灵敏度100%,特异度97.1%。不符合2株,其中1株为测序结果同时存在KPC和OXA-48两种型,胶体金检测结果为KPC型;1株为测序结果同时存在KPC和NDM两种型,胶体金检测结果为KPC型。结论 胶体金免疫层析法作为一种新的CRE碳青霉烯酶型检测方法,操作简单,结果容易判读,能够短时间内检测出CRE中的产KPC、OXA-48、VIM、IMP和NDM型碳青霉烯酶的情况,灵敏度和特异度能够满足临床需求,可作为实验室进行碳青霉烯酶型快速检测的方法,指导临床诊治CRE。
关键词:耐碳青霉烯类肠杆菌目细菌;胶体金免疫层析法;碳青霉烯酶
中图分类号:R978.1文献标志码:A
Abstract Objective To systematically evaluate the value and performance of colloidal gold immunochromatography in the carbapenem enzyme type detection of carbapenem resistant Enterobacteriaceae (CRE), so as to provide a reliable basis for the rapid detection of CRE carbapenem enzyme in the laboratory. Methods 70 CRE strains isolated from sterile sites were collected, and the carbapenem enzyme type was detected by PCR amplification, gene sequencing, and colloidal gold immunochromatography. Taking the sequencing results as the reference standard, the laboratory detection performance of colloidal gold immunochromatography was evaluated. Results Carbapenemase gene was detected in 69 strains, including 49 strains of KPC type, 12 strains of OXA-48 type, 1 strain of IMP type and 3 strains of NDM type, 2 strains of KPC and OXA-48 type, 1 strain of OXA-48 and NDM type, 1 strain of KPC and NDM type, and strains of the above five genotypes were not detected. Compared with the sequencing results, the sensitivity of colloidal gold immunochromatography was 100%, and the specificity was 97.1%, which was inconsistent between the two strains. There were two types of KPC and OXA-48 at the same time in one strain, and the colloidal gold detection result was a KPC type. The other was sequenced and there were two types of KPC and NDM at the same time, and the colloidal gold detection result was a KPC type. Conclusion Colloidal gold immunochromatography can be used as a new method for the detection of carbapenem type of CRE, with simple operation and easy interpretation of the results. It can detect the production of KPC, OXA-48, VIM, IMP, and NDM carbapenem in CRE in a short time. Its sensitivity and specificity can meet the clinical needs, and thus it can be used as a method for rapid detection of the carbapenem type in the laboratory to guide clinical diagnosis and treatments of CRE.
Key words Carbapenem-resistant Enterobacterales; Colloidal gold immunochromatography; Carbapenemase
细菌耐药已成为全球公共健康领域的重大挑战,其中尤以耐碳青霉烯类肠杆菌目细菌(Carbapenem-resistant Enterobacterales, CRE)引起的感染形势最为严峻。产生碳青霉烯酶是肠杆菌目细菌对碳青霉烯类药物耐药的最主要机制[1]。不同国家、不同地区、不同医院、不同人群以及不同细菌所产的碳青霉烯酶种类均有差异[2-4]。不同种类的抗菌药物对产生不同碳青霉烯酶菌株的抗菌活性不同[5-7]。因此,准确、快速地对CRE产生的碳青霉烯酶进行检测分型,对于临床抗感染治疗的精准用药和医院感染预防控制具有重要的价值。本文以临床无菌部位分离的CRE菌株为研究对象,以碳青霉烯酶基因测序结果为参考,探讨胶体金免疫层析法在CRE碳青霉烯酶型检测中的性能情况、操作过程中的注意事项,为实验室进行CRE碳青霉烯酶型快速检测提供方法依据。
1 材料和方法
1.1 菌株来源
收集昆明医科大学第一附属医院2020年1月—2021年8月住院及门诊送检的无菌部位标本经培养瓶培养,药敏结果为亚胺培南或美罗培南不敏感的肠杆菌目细菌,剔除同一患者相同部位的重复菌株,存放于-80℃冰箱。
1.2 仪器和试剂
生物安全柜(英国Baker公司)、CO2培养箱(美国Thermo公司)、质谱仪(德国Bruker公司)、凝胶电泳图像分析仪(美国GE公司)、基因扩增热循环仪(西安天隆科技有限公司)、Powerpac3000型电泳仪(美国伯乐公司)、超低温冰箱(美国Thermo公司)、高速离心机(德国Eppendorf公司)、涡旋仪(北京优晟联合科技有限公司)、 BlasTaq 2×PCR Master-MIX(批号:69180008)购自ABM生物科技有限公司、RNase/DNase-free 纯水(批号:766070AH)购自北京博迈德基因技术有限公司、哥伦比亚血琼脂平板(批号:20210102B)、MH琼脂平板(批号:2021031B)购自郑州安图生物工程股份有限公司、NG-Test? CARBA5碳青霉烯酶检测试剂盒(胶体金免疫层析法)(批号:W21010311)购自长沙中生众捷生物技术有限公司,美罗培南药敏纸片(批号3324297)购自英国Oxoid公司。
1.3 判读标准及质控菌株
参照2021年CLSI M100-S31进行结果判讀。阴性质控菌株:肺炎克雷伯菌ATCC BAA-1706;阳性质控菌株:肺炎克雷伯菌ATCC BAA-1705,每次实验进行阴性、阳性质控。
1.4 方法
1.4.1 菌株复苏与鉴定
将菌株保存管从-80℃冰箱取出,平衡至室温,颠倒混匀菌液,采用三区划线法接种于哥伦比亚血琼脂平板,放于CO2培养箱,过夜培养。次日观察菌落形态,单一类型菌落使用质谱仪进行种属鉴定,鉴定结果与保种信息一致,进行进一步实验。
1.4.2 表型验证试验
采用改良碳青霉烯灭活试验(modified carbapenem inactivation method, mCIM)进行表型确证试验。取1 μL接种环满环生长于琼脂平板上的过夜培养纯菌落,于2 mL TSB肉汤中,震荡混匀10~15 s。每管放入一张含10 μg美罗培南的无菌纸片,确认纸片浸没于菌悬液中。35℃±2℃大气环境孵育4 h±15 min。孵育结束时,立即用生理盐水制备1.5×108 CFU/mL的大肠埃希菌ATCC25922菌悬液。菌悬液制备和平板涂布在15 min内完成,干燥3~10 min。用10 μL接种环将美罗培南纸片从TSB肉汤中取出,将纸片贴于试管内壁,轻轻按压以挤去纸片上多余水分,然后将纸片取出贴于已涂布有大肠埃希菌ATCC 25922的MH琼脂平板上,倒置平板,35℃±2℃大气环境孵育18~24 h;量取抑菌圈直径。
1.4.3 碳青霉烯酶基因检测
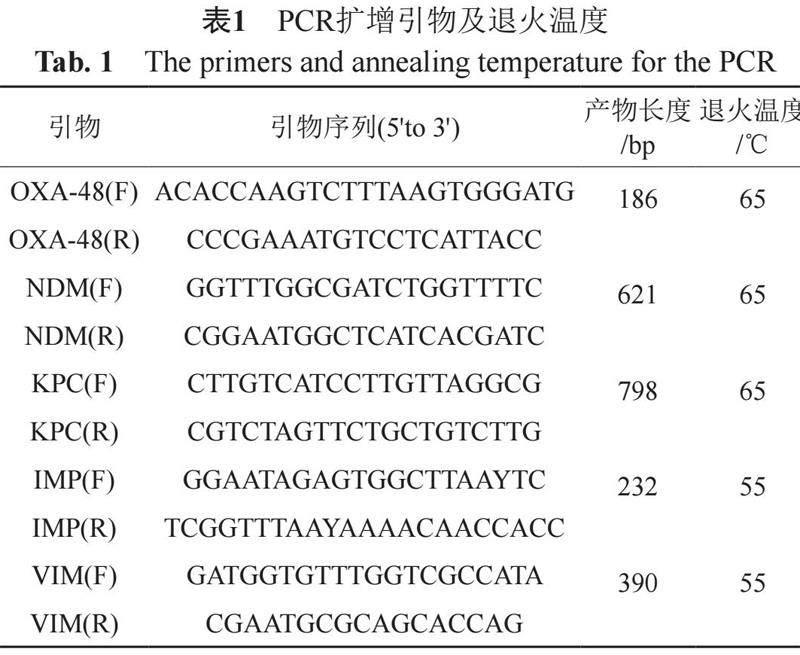
煮沸法裂解提取细菌DNA,扩增的碳青霉烯酶基因包括blaKPC、blaNDM、blaVIM、blaIMP和blaOXA-48。PCR反应体系(50 μL):RNase/DNase-free水15.0 μL,BlasTaq 2×PCR MasterMIX 25.0 μL,模板4.0 μL,引物F 3.0 μL,引物R 3.0 μL。PCR反应条件:94℃预变性 5 min;94℃变性30 s,退火30 s,72℃延伸30 s(30个循环);72℃延伸5 min。引物序列[8]及退火温度见表1。引物由北京擎科生物有限公司合成,扩增产物使用2%琼脂糖凝胶进行电泳,电泳时间30 min。电泳结果显示为阳性的扩增产物,送北京擎科生物有限公司进行测序分析。测序结果与GenBank中提供的序列进行比较(http://www.ncbi.nlm.nih.gov)。
1.4.4 胶体金免疫层析法检测碳青霉烯酶型
打开NG-Test? CARBA5碳青霉烯酶检测试剂盒(胶体金免疫层析法),在试剂盒提供的Ep管中滴入5滴提取缓冲液,使用1 μL的接种环挑起一满环细菌加入Ep管,合上Ep管。涡旋仪混合震荡30 s,室温放置10 min。取出检测卡盒,使用一次性移液管,吸取5滴制备好的混合液加入到测卡标记的“S”样本孔。室温放置15 min,读取结果。按照C区域中出现一条红线并且在K、O、V、I和N检测区域中出现一条或多条红线,判读为阳性,仅C线区域出现一条红线,判读为阴性,如C线区域未出现红线,则不判读,重新进行检测。两名未知测序结果的实验室人员分别进行判读,结果一致进行统计,结果不一致,重新进行检测。
2 结果
2.1 菌株来源情况及分类
本研究中共70株菌株,均来源于无菌部位,其中血液占57.1%(40/70),胸腔积液占17.2%(12/70),腹腔积液占14.3%(10/70),脑脊液占11.4%(8/70)。质谱仪种属鉴定结果与保种信息一致,其中肺炎克雷伯菌67株,大肠埃希菌1株,产气克雷伯菌1株,阴沟肠杆菌1株。
2.2 表型验证试验
碳青霉烯酶阳性69株,阴性1株。阴性菌株为脑脊液中分离出的肺炎克雷伯菌。
2.3 碳青霉烯酶基因检测结果
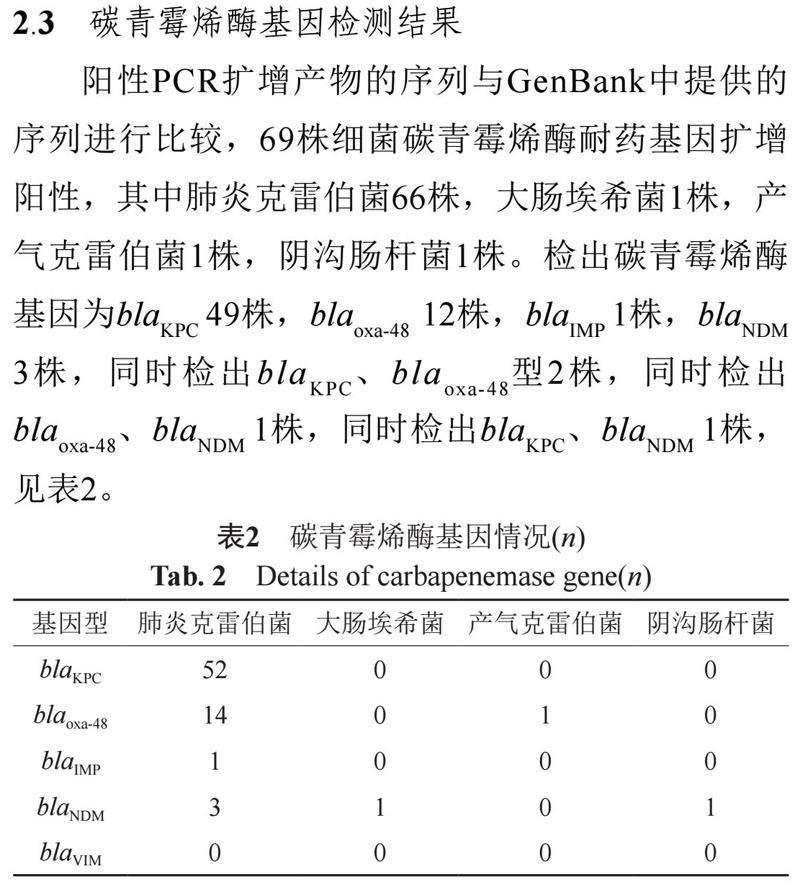
阳性PCR扩增产物的序列与GenBank中提供的序列进行比较,69株细菌碳青霉烯酶耐药基因扩增阳性,其中肺炎克雷伯菌66株,大肠埃希菌1株,产气克雷伯菌1株,阴沟肠杆菌1株。检出碳青霉烯酶基因为blaKPC 49株,blaoxa-48 12株,blaIMP 1株,blaNDM 3株,同时检出blaKPC、blaoxa-48型2株,同时检出blaoxa-48、blaNDM 1株,同时检出blaKPC、blaNDM 1株,见表2。
2.4 胶体金免疫层析法检测碳青霉烯酶型
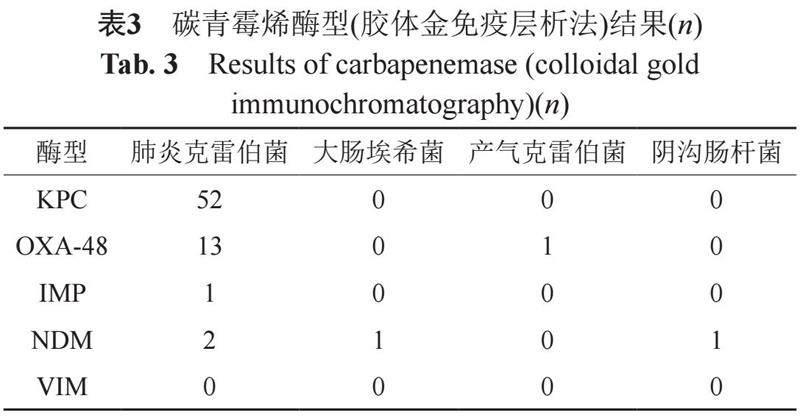
结果为KPC型51株,OXA-48型12株,IMP型1株,NDM型3株,同时检出KPC、OXA-48型1株,同时检出KPC、NDM型1株,阴性结果1株,见表3。
2.5 两种方法结果比较情况
以测序结果为参考方法,胶体金免疫层析法检测的碳青霉烯酶型结果有2例与测序结果不一致。2例标本均为血液中分离出的肺炎克雷伯菌,不符合结果为1例测序结果为KPC与OXA-48型,胶体金免疫层析法检测结果为KPC型,未检出OXA-48;1例测序结果为KPC与NDM型,胶体金免疫层析法检测结果为KPC型,未检出NDM。胶体金免疫层析法在检测碳青霉烯酶型中的灵敏度为100%(69/69),特异度为97.1%(67/69)。
3 讨论
碳青霉烯类抗菌药物的抗菌谱广、抗菌活性强,对产超广谱β-内酰胺酶肠杆菌科细菌具很强抗菌活性,被认为是治疗肠杆菌目细菌感染的最后一道防线[9]。随着临床广泛应用,CRE在全球范围内流行播散,成为公共健康领域的重大挑战。CRE导致的感染耐药性高、传播性高、病死率高、增长快。肠杆菌目细菌对碳青霉烯类抗菌药物耐药的机制包括:产碳青霉烯酶,产生超广谱β-内酰胺酶和/或AmpC酶合并外膜孔蛋白表达下调或缺失[10]。其中碳青霉烯酶的产生是肠杆菌目细菌对碳青霉烯类药物耐药的最主要机制。2020年由喻华等国内知名专家共同撰写了《肠杆菌目细菌碳青霉烯酶的实验室检测和临床报告规范专家共识》,共识认为免疫层析技术是目前以细菌菌落为基础的碳青霉烯酶检测方法中最快速的检测技术[11]。NG-Test? CARBA5碳青霉烯酶检测试剂盒(胶体金免疫层析法)于2020年11月通过国家食品药品监督管理总局上市許可。本研究中检测结果有2例与测序结果不一致,不一致的结果均为测序结果检出两种碳青霉烯酶基因,胶体金只检测出其中一种酶型,可能原因是胶体金显色需要较高浓度的标记物,当存在多种碳青霉烯酶时,浓度含量较低的酶出现前带现象,造成假阴性,需要进一步研究。胶体金免疫层析法结果判读由人工完成,不同的人对出现“红线”的理解不一致。实验中,一名工作人员认为质控线已出,可以进行结果判读,另一名工作人员认为虽然在C区域有一条线,但不是“红线”,不能进行结果判读,需要重新检测,第二次检测两名工作人员都判读为KPC。实验中出现第一次检测时C线区域出现一条线但不是红线,K、O、V、I和N检测区域中出现疑似红线。重新进行菌液制备,再次检测,C线区域出现红线再读取K、O、V、I和N检测区域的检测结果,检测结果与上一次不一致。因此,使用NG-Test? CARBA5碳青霉烯酶检测试剂盒进行碳青霉烯酶检测时,必须C线区域出现红线,才可以判读结果,同时由至少两名工作人员独立判读。
国家、地区、医院、人群以及细菌的不同,检出的碳青霉烯酶种类均有差异[12]。本研究中OXA-48型检出率较高,占21.7%(15/69),高于文献报告[2,13-14]。这一方面由于本研究样本数量较少而且选择的菌株全部来源于无菌部位,另一方面由于地区差异。研究医院为省级三级甲等医院,接收大量下级医院的危重症患者,15例产OXA-48型碳青霉烯酶的菌株中,13例来自转院患者,入院前有当地医院治疗史、抗菌药物使用史,至我院后均入住ICU。研究表明[15],入住ICU是感染CRE的独立危险因素。ICU被认为是产生、传播和扩散CRE耐药基因的场所。对于ICU患者,CRE定植是其感染的独立危险因素,与患者死亡高风险相关[16]。CRE定植导致CRE感染率高达16.5%,而且定植发展为感染的患者病死率更高[17-18]。
对CRE进行主动筛查及干预,能够有效降低CRE感染率及患者病死率。有研究显示,通过开展对入住ICU对患者进行CRE的主动筛查,病房的碳青霉烯酶产生菌的定植率从28.6%下降至5.6%,感染率从35.7%下降至2.8%[19]。因此,尽早发现CRE定植、了解CRE感染部位,有助于制定有效的感控措施,预防和控制CRE在ICU的产生和传播。研究中,OXA-48型碳青霉烯酶主要存在于肺炎克雷伯菌(14/15),与文献报告一致[20]。OXA-48型碳青霉烯酶对碳青霉烯类抗菌药物水解活性低,通常需要产生超广谱β-内酰胺酶(ESBLs)和/或孔蛋白突变来提供高水平对碳青霉烯类抗菌药物的耐药性[20]。因此,通过药敏结果及表型确认方法对OXA-48型碳青霉烯酶进行诊断可能会漏检。使用分子方法鉴定碳青霉烯酶的监测研究表明,OXA-48型内酰胺酶是全球肠杆菌中第二或第三常见的碳青霉烯酶[21]。SMART和INFORM全球监测项目的数据显示,产碳青霉烯酶肠杆菌目细菌(CPE)中OXA-48的检出率为27%[22]。在中东、北非和比利时和西班牙等欧洲国家,OXA-48型是肠杆菌中最常见的碳青霉烯酶[21]。在我国,产OXA-48型肠杆菌表现为散发流行,已波及主要的肠杆菌种类,在常见菌种间克隆流行,而且携带OXA-48编码基因的质粒与产KPC的高危克隆ST11有融合进化的趋势,检出同时携带blaKPC-2和blaoxa-48的ST11型肺炎克雷伯菌。耐碳青霉烯酶肺炎克雷伯菌的ST分型中我国最流行的是ST11型,ST11型克隆株具有在不同内源或外源性质粒序列间融合和整合的能力,有可能出现OXA-48型耐碳青霉烯酶肺炎克雷伯菌的克隆传播,因此需要对其流行趋势更加系统、深入地监测[23]。
CRE引起的侵入感染,病死率高。有研究显示,我国CRE血流感染30 d病死率为46.2%[24]。研究中无菌部位中CRE感染病死率为31.4%(22/70),低于CRE血流感染30 d病死率,这与本研究的对象中包括胸腔积液、腹腔积液相关。CRE感染不仅病死率,而且引发住院时间延长、医疗成本高、社会及家庭经济负担增加等一系列社会问题。有效而规范的治疗方案是提高CRE感染救治率的关键。不同种类的抗菌药物对产生不同碳青霉烯酶菌株的抗菌活性不同。如头孢他啶/阿维巴坦(ceftazidime-avibactam, CAZ/AVI)對产KPC和OXA-48型碳青霉烯酶菌株具有高度抗菌活性,但产B类碳青霉烯酶菌株无抗菌活性[25-26]。治疗CRE感染重症患者的主要方案是联合用药。联合用药能够发挥抗菌药物之间的协同作用、增加抗菌活性以及降低细菌耐药性的发生率,治疗效果优于单药治疗[27]。CRE菌血患者,早期接受充分的抗菌药物治疗患者30 d的生存率显著高于接受不充分治疗的患者[28]。不同类型的碳青霉烯酶具有不一样的特征。如金属β-内酰胺酶不能水解氨曲南,KPC型碳青霉烯酶的活性可被阿维巴坦、韦博巴坦或雷利巴坦抑制,被克拉维酸弱抑制[11]。实验室需根据碳青霉烯酶型进行联合药敏试验从而指导临床制定联合用药方案。胶体金免疫层析法可以在30 min进行碳青霉烯酶型检测,与Carba_NP试验、改良碳青霉烯灭活试验、碳青霉烯酶抑制剂增强试验等相比不仅速度快,而且可以检测出具体的酶型,能够早期指导临床制定精准的抗感染治疗方案,改善患者结局。
胶体金免疫层析法操作简单,对实验室条件要求低,无需特殊设备,结果容易判读,能够快速进行KPC、OXA-48、VIM、IMP和NDM型碳青霉烯酶的定性检测,灵敏度和特异度能够满足临床需求,但是该类试剂盒在国内上市时间晚,目前价格较高,可以选择的试剂种类少,大部分省份没有收费标准,而且只能检测常见的5种碳青霉烯酶,对于少见酶型或者其他耐药机制导致的CRE会漏检。近年来,分子检测技术在碳青霉烯酶基因的检测方法发展迅速。分子检测技术可直接检测临床标本中CRE菌株产生的碳青霉烯酶基因,但是需要专用的检测仪器,而且价格更加昂贵,不适用于基层医院[29-30]。总之,虽然目前胶体金免疫层析法在碳青霉烯酶检测中有一定的不足,但优势明显,各级实验室可结合临床需求作为一种检测碳青霉烯酶的方法进行应用。
参 考 文 献
Tzouvelekis L S, Markogiannakis A, Psichogiou M, et al. Carbapenemases in Klebsiella pneumoniae and other Enterobacteriaceae: An evolving crisis of global dimensions[J]. Clinical Microbiology Reviews, 2012, 25(4): 682-707.
刘卫平, 海云婷, 杨丽芳, 等. 某三级综合医院耐碳青霉烯肠杆菌科细菌流行特征及耐药性分析[J]. 中华医院感染学杂志, 2020, 30(19): 2943-2948.
Lopes E, Saavedra M J, Costa E, et al. Epidemiology of carbapenemase-producing Klebsiella pneumoniae in northern Portugal: Predominance of KPC-2 and OXA-48[J]. J Glob Antimicrob Resist, 2020, (22): 349-353.
Galani I, Karaiskos I, Karantani I, et al. Epidemiology and resistance phenotypes of carbapenemase-producing Klebsiella pneumoniae in Greece, 2014 to 2016[J]. Euro Surveill, 2018, 23(31): 1700775.
Sheu C C, Chang Y T, Lin S Y, et al. Infections caused by carbapenem-resistant Enterobacteriaceae: An update on therapeutic options[J]. Front Microbiol, 2019, 10: 80.
杨启文, 马筱玲, 胡付品, 等. 多黏菌素药物敏感性检测及临床解读专家共识[J]. 协和医学杂志, 2020, 11(5): 559-570.
中国医疗保健国际交流促进会临床微生物与感染分会, 中华医学会检验医学分会临床微生物学组, 中华医学会微生物学与免疫学分会临床微生物学组. 多黏菌素类与替加环素及头孢他啶/阿维巴坦药敏方法和报告专家共识[J]. 中华检验医学杂志, 2020, 43(10): 964-972.
余柏增, 孙宁, 王颖, 等. 检测5种碳青霉烯酶基因的多重PCR方法的建立及临床应用[J]. 中华医院感染学杂志, 2020, 30(15): 2281-2286.
Nordmann P, Poirel L. Epidemiology and diagnostics of carbapenem resistance in Gram-negative bacteria[J]. Clin Infect Dis, 2019, 69(Supplement_7): S521-S528.
Bonomo R A, Burd E M, Conly J, et al. Carbapenemase-producing organisms: A global scourge[J]. Clin Infect Dis, 2018, 66(8): 1290-1297.
喻华, 徐雪松, 李敏, 等. 肠杆菌目细菌碳青霉烯酶的实验室检测和临床报告规范专家共识[J]. 中国感染与化疗杂志, 2020, 20(6): 671-680.
Han R, Shi Q, Wu S, et al. Dissemination of carbapenemases (KPC, NDM, OXA-48, IMP, and VIM) Among carbapenem-resistant Enterobacteriaceae isolated from adult and children patients in China[J]. Front Cell Infect Microbio, 2020, 10: 314.
胡付品, 郭燕, 朱德妹, 等. 2020年CHINET中国细菌耐药监测[J]. 中国感染与化疗杂志, 2021, 21(4): 377-387.
崔小璠, 刘蕊, 刘慧敏, 等. 2017—2019年某院肠杆菌科细菌检出特征及耐药基因检测[J]. 中华医院感染学杂志, 2021(16): 2411-2415.
Martin A, Fahrbach K, Zhao Q, et al. Association between carbapenem resistance and mortality among adult, hospitalized patients with serious infections due to Enterobacteriaceae: Results of a systematic literature review and meta-analysis[J]. Open Forum Infect Dis, 2018, 5(7): ofy150.
杨启文, 吴安华, 胡必杰, 等. 临床重要耐药菌感染传播防控策略专家共识[J]. 中国感染控制杂志, 2021, 20(1): 1-14.
陈美恋, 王守军, 匡季秋, 等. 重症监护病区CRE主动筛查及其效果评价[J]. 中华医院感染学杂志, 2017, 27(18): 4123-4126.
管红艳, 刘婧娴, 陈峰, 等. 儿童重症监护病房耐碳青霉烯类肠杆菌科细菌主动筛查及临床资料分析[J]. 中国感染与化疗杂志, 2021, 21(4): 444-448.
Zhou M, Kudinha T, Du B, et al. Active surveillance of carbapenemase-producing organisms (CPO) colonization with xpert Carba-R assay plus positive patient isolation proves to be effective in CPO containment[J]. Front Cell Infect Microbiol, 2019, 9: 162.
Pitout J, Peirano G, Kock M M, et al. The global ascendency of OXA-48-Type carbapenemases[J]. Clin Microbiol Rev, 2019, 33(1): e00102-19.
de Jonge B L, Karlowsky J A, Kazmierczak K M, et al. In vitro susceptibility to ceftazidime-avibactam of carbapenem-nonsusceptible Enterobacteriaceae isolates collected during the INFORM global surveillance study (2012 to 2014)[J]. Antimicrob Agents Chemother, 2016, 60(5): 3163-3169.
Karlowsky J A, Lob S H, Kazmierczak K M, et al. In vitro activity of imipenem against carbapenemase-positive Enterobacteriaceae isolates collected by the SMART global surveillance program from 2008 to 2014[J]. J Clin Microbiol, 2017, 55(6): 1638-1649.
Wang L, Guo L, Ye K, et al. Genetic characteristics of OXA-48-producing Enterobacterales from China[J]. J Glob Antimicrob Resist, 2021, 26: 285-291.
Zhou C, Jin L, Wang Q, et al. Bloodstream infections caused by carbapenem-resistant Enterobacterales: Risk udy[J]. Infect Drug Resist, 2021, 14: 731-742.
閻颖, 张枭然, 王亚莉, 等. 头孢他啶/阿维巴坦治疗革兰阴性菌感染疗效和安全性的Meta分析[J]. 中国感染控制杂志, 2021, 20(5): 422-429.
Torres A, Zhong N, Pachl J, et al. Ceftazidime-avibactam versus meropenem in nosocomial pneumonia, including ventilator-associated pneumonia (REPROVE): A randomised, double-blind, phase 3 non-inferiority trial[J]. Lancet Infect Dis, 2018, 18(3): 285-295.
张露方, 耿荣华, 曲芬. 耐碳青霉烯肠杆菌科细菌的流行病学特点以及抗生素应用策略[J]. 中国抗生素杂志, 2019, 44(9): 1008-1014.
Bianco G, Boattini M, van Asten S, et al. RESIST-5 O.O.K.N.V. and NG-Test Carba 5 assays for the rapid detection of carbapenemase-producing Enterobacterales from positive blood cultures: a comparative study[J]. J Hosp Infect, 2020, 105(2): 162-166.
Liu Z, Bai L, Liu J, et al. Parallel validation of the NG-Test Carba 5 and the Xpert Carba-R for detection and characterization of carbapenem-resistant Enterobacterales causing bloodstream infections[J]. J Mol Diagn, 2021, 23(8): 1007-1014.
Cai Z, Tao J, Jia T, et al. Multicenter evaluation of the Xpert Carba-R assay for detection and identification of carbapenemase genes in sputum specimens[J]. J Clin Microbiol, 2020, 58(9): e00644-20.
基金项目:中国感染病原菌规范化分层监测体系建立与药物敏感性和耐药性现状调查(No. 2019FY101200和No. 2019FY101209)
作者简介:张鸿娟,女,生于1988年,主管技师,主要从事临床微生物与细菌耐药研究,E-mail: z121159143@qq.com
