多中心切割2D-HPLC-QTOF法对表柔比星脂质体制剂中未知杂质的分离与结构推断
2023-04-29计小凡欧阳辉冯育林饶毅罗晓健
计小凡 欧阳辉 冯育林 饶毅 罗晓健
摘要:目的 建立多中心切割(MHC)二维高效液相色谱-四级杆飞行时间质谱(2D-HPLC-QTOF)法分离和推断表柔比星脂质体制剂中未知杂质的方法。方法 一维液相色谱采用Symmetry-C18 (250 mm×4.6 mm,5 μm)为色谱柱,以乙腈和甲醇(6:1)为流动相A,以加入十二烷基硫酸钠的磷酸缓冲液为流动相B,流动相A与流动相B体积比为57:43进行等度洗脱;二维高效液相色谱采用Agilent Eclipse-C18 (50 mm×2.1 mm,1.8 μm)为色谱柱,以0.1%的甲酸水和乙腈为流动相,采用梯度洗脱。将一维液相色谱条件下分离的杂质峰进行多中心切割储存在定量环中,并转移至二维进行分离,以四极杆飞行时间质谱(QTOF)进行结构推断。结果 该方法可以使表柔比星与杂质峰较好地分离,并且可以得到高质量杂质峰进行结构推断。在表柔比星脂质体制剂中对6个未知杂质进行有效的推断。结论 建立的多中心切割二维高效液相色谱-四极杆飞行时间质谱法可高效准确的分离并推断表柔比星脂质体制剂中的未知杂质,特别是微量和难以分离的杂质,对表柔比星制剂的质量控制提供了新方法。
关键词:2D-HPLC-QTOF;多中心切割;表柔比星脂质体;未知杂质
中图分类号:R978.1文献标志码:A
Abstract Objective To establish a method called multiple heart-cutting 2D-HPLC-QTOF to separate and identify the unknown impurities in epirubicin liposome. Methods One-dimension (1D) chromatographic condition was Symmetry-C18 column using acetonitrile and methanol (6:1) as mobile phase A and phosphate buffer solution with sodium lauryl sulfate as mobile phase B. The volume ratio of mobile phase A to mobile phase B was 57:43. Two-dimension (2D) chromatographic condition was Agilent Eclipse-C18 column using 0.1% formic acid solution as mobile phase A and acetonitrile as mobile phase B (gradient elution). Multiple impurity peaks separated by 1D liquid chromatography were cut by multi hearting-cutting and stored in quantitative loops, and then transferred to 2D for separation. The structures were identified by quadrupole time-of-flight mass spectrometry (QTOF). Results Using this method, good separation of epirubicin from impurity peaks was achieved, and high-quality impurity peaks were obtained for structural identification. Six unknown impurities were effectively identified in the epirubicin liposome. Conclusion The established method can efficiently and accurately separate and identify unknown impurities in the epirubicin liposome, especially the trace and hard-to-separate impurities, and provides a new method for quality control of the Epirubicin preparation.
Key words 2D-HPLC-QTOF; Multiple heart-cutting; Epirubicin liposome; Unknown impurities
表柔比星(epirubicin,EPI,又稱表阿霉素)是一种蒽环类广谱抗肿瘤抗生素[1],临床常用其盐酸盐治疗乳腺癌、卵巢癌、肺癌和肝癌等[2-4]。研究表明其疗效与阿霉素相同或略高,但心脏毒性低于阿霉素[5]。近年来许多表柔比星及其盐酸盐的产品逐步上市,虽然注射剂疗效确切但长期使用仍会出现骨髓抑制和心脏毒性等副作用。脂质体作为新型药物载体在提高药物靶向性、降低毒副作用、延长治疗时间方面非常突出[6]。
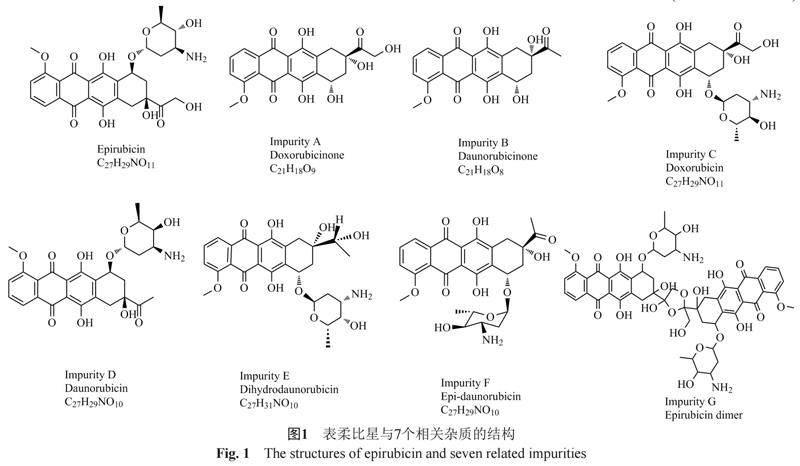
目前,各国药典收载的盐酸表柔比星和注射用盐酸表柔比星有关物质检测主要采用HPLC法[7-9],图1列出了包括阿霉素在内的相关杂质共7种。检测方法中因流动相含有磷酸和十二烷基硫酸钠缓冲盐,会对质谱检测系统产生污染和离子抑制效应,无法与质谱直接联用对表柔比星原料药及其制剂的已知或未知杂质进行结构鉴定。邵武军等[10]采用在线二维液相色谱-四极杆飞行时间质谱法对注射用盐酸表柔比星长期稳定性留样的未知峰进行定性分析,结果表示该未知杂质为盐酸表柔比星二聚体,检测方法简便有效。
本试验采用多中心切割(MHC)模式的2D-HPLC-QTOF联用技术分离和推断表柔比星脂质体制剂中的未知杂质。该方法可以实现对一维液相条件下分离的多个杂质峰进行中心切割,然后将这些中心切割储存在定量环中,并将储存的中心切割依次转移到具有不同选择性的二维进行分离,在实现共流出物得到有效分离的同时可以实现每个一维杂质峰都进行中心切割,避免杂质峰数据丢失。
1 仪器与试剂
1.1 仪器
Agilent 1290 型二维高效液相色谱仪(美国Agilent公司);Agilent 6530 型飞行时间质谱仪(美国Agilent公司);MILLI-Q超纯水仪(美国Millipore公司)。
1.2 试剂
表柔比星(批号8514AOC00320)购自广州安信医药有限公司;表柔比星脂质体(批号20170918)由江西本草天工科技有限公司提供;优级纯十二烷基硫酸钠购自美国Sigma公司;分析纯磷酸购自国药集团化学试剂有限公司;色谱级甲醇和乙腈购自美国Thermo Fisher Scientific公司;色谱级甲酸购自美国Sigma公司;超纯水由MILLI-Q纯水仪制备。
2 实验方法
2.1 一维液相色谱条件
色谱柱:Symmetry-C18 (250 mm×4.6 mm,5 μm);流速:1 mL/min;柱温:30℃;进样量:20 μL;检测波长:254 nm;流动相:A为乙腈:甲醇(6:1),B為缓冲液(称取2.88 g十二烷基硫酸钠,加磷酸1.36 mL,用水溶解并稀释至1000 mL);等度洗脱A: B= 57: 43。
2.2 二维液相色谱条件
色谱柱:Agilent Eclipse-C18 (50 mm×2.1 mm,1.8 μm);流速:0.2 mL/min;柱温:30℃;Loop环积:40 μL;检测波长:254 nm;流动相A为0.1%甲酸水,流动相B为乙腈;洗脱程序为B相在8 min内由10%上升为90%。
2.3 质谱条件
离子化模式:电喷雾正离子化(ESI+);干燥气温度:325℃;雾化气压力:35 pai;干燥气流速:8 L/min;毛细管电压:3500 V;采集速率:2 Spectrum/Sec;质量范围:50~1500 m/z。
2.4 样品溶液的制备
取表柔比星原料药适量,用甲醇溶解,摇匀,过滤,取滤液,制成浓度为20.52 μg/mL的表柔比星原料药溶液,并用一维液相色谱条件进行分析。取表柔比星脂质体溶液用甲醇稀释125倍,过滤,取滤液。空白脂质体用同样的方法稀释。取表柔比星脂质体样品溶液在一维液相色谱条件下进行分析,通过一维液相色谱图中目标杂质峰的保留时间设置多中心切割程序的切割时间,将目标杂质转移至二维液相色谱条件下分析。
3 结果与讨论
3.1 一维液相色谱分析结果
3.1.1 原料药与空白脂质体
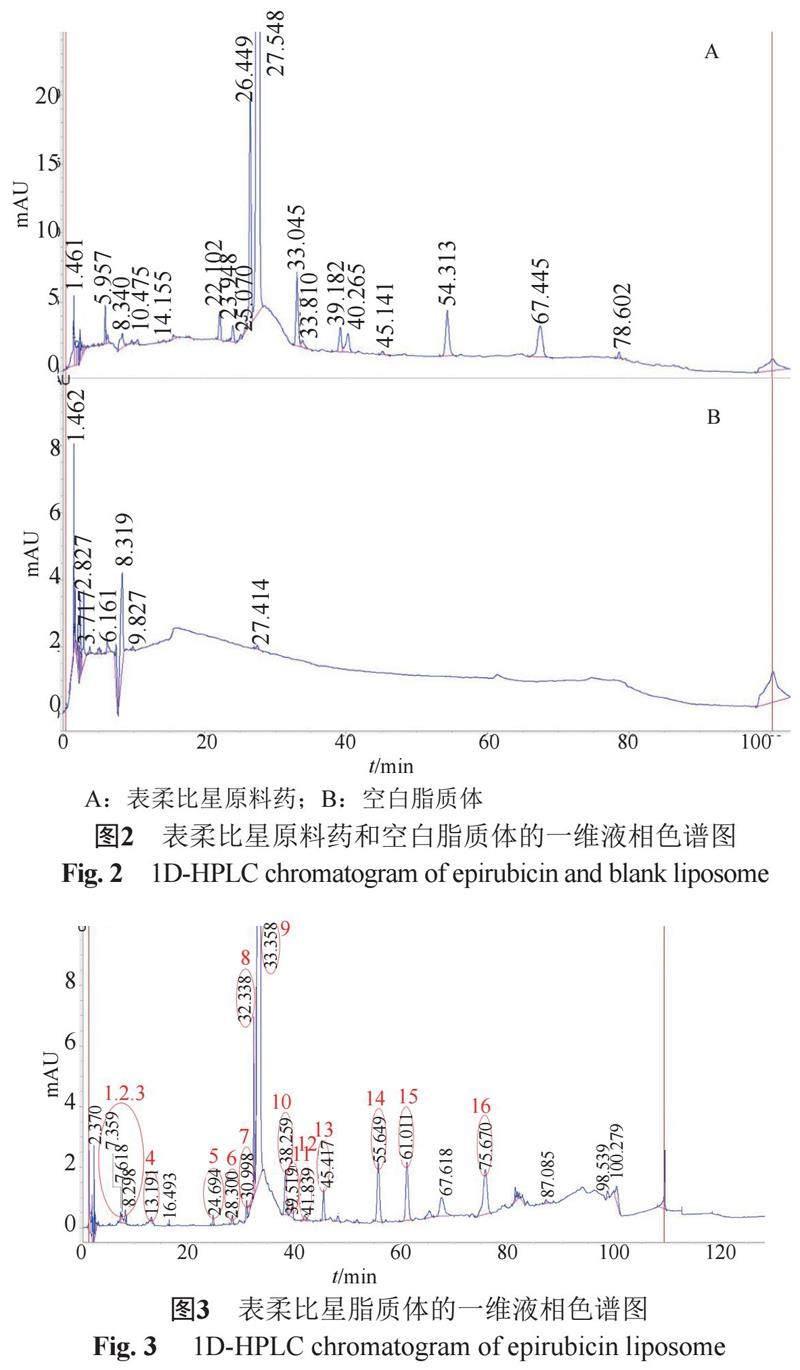
在加入缓冲盐的液相色谱条件下,表柔比星原料药的一维液相色谱图如图2A,主峰保留时间在27.548 min,并且能与其他杂质峰很好的分离,表明一维液相色谱条件的合理性。在相同的一维液相色谱条件下,分析空白脂质体的一维液相色谱行为。如图2B所示,空白脂质体在7~8 min有干扰峰出现,可能会对此时间段出峰的杂质的鉴定有所干扰。同时图中显示空白脂质体在其他保留时间的区域无明显干扰。
3.1.2 表柔比星脂质体
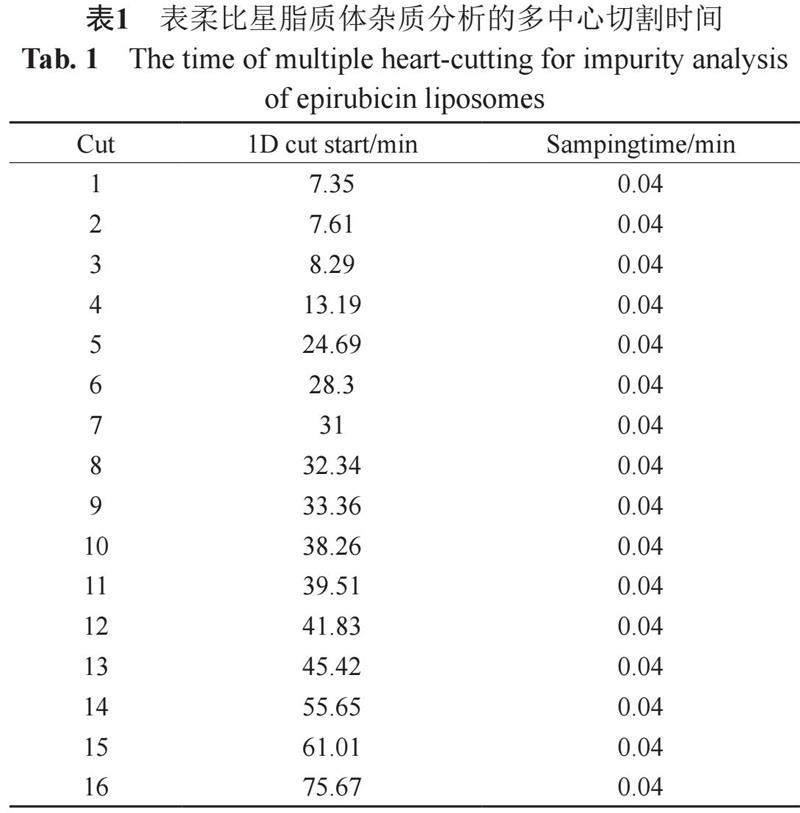
一维液相色谱分析结果可以确定目标杂质峰的保留时间,用于多中心切割模式的切割时间设置。表柔比星脂质体一维色谱图如图3,表柔比星主峰保留时间为33.3 min,编号为9。杂质峰分布及保留时间与原料药中的基本一致,推测表柔比星脂质体制剂中的主要杂质来源于其原料药,将各目标杂质峰标号为1~8和10~16。将主峰与各杂质峰引入二维体系进行分析的中心切割时间表如表1所示,共采集16个峰切入二维,每个峰采样时间为0.04 min。
3.2 二维液相色谱与质谱联用分析结果
在一维液相色谱条件下,表柔比星的主峰与杂质可以实现基本的分离,将主峰和各目标杂质峰切换到液相色谱条件可以直接与MS连接进行鉴定的二维中进一步分离,可以实现共流出物高效分离的同时进行质谱鉴定分析。
3.2.1 表柔比星主峰9的定性分析
将主峰9采集至二维液相色谱中进行分析(图4A),保留时间为4.9 min,分子离子峰m/z为544.1808,通过MFG分子式计算功能综合考虑精确质量数、同位素分布、价态、加盐峰、碎片信息,在限定元素组成和得分的条件下,得出分子式为C27H29NO11,质量偏差-1.3 ppm(0.6 mDa),得分95.67,同时对比同位素峰测量与理论丰度,可以确定编号为9的峰是表柔比星主峰(图4B)。
3.2.2 杂质7的定性分析
杂质7在一维液相色谱中的保留时间为31 min,切割到二维的保留时间为4.31 min(图5)。通过EIC确认质谱对应离子为m/z 544.1829和m/z 397.0923(推 测为源内裂解),且与空白脂质体相比为表柔比星脂质体样品特有(图6)。计算杂质7的分子式为C27H29NO11,质量偏差-2.86 ppm(-1.6 mDa),推测杂质7为图1中的杂质C阿霉素(图7)。
3.2.3 杂质8的定性分析
杂质8在一维液相的保留时间为32.34 min,切阀后在4.34 min有254 nm的紫外吸收峰(图8),EIC确认质谱对应离子为m/z 530.1663和m/z 383.0772(推测为源内裂解)(图9)。与空白脂质体样品比较,为表柔比星脂质体样品特有峰。通过精确质量计算分子式为C26H27NO11,比主成分少-CH2,质量偏差1.48 ppm (-0.6 mDa),得分97.59。通过源内裂解脱去一分子氨基糖来推测杂质8可能是在主成分的基础上丢失-CH2形成的,可能的结构如图所示(图10)。
3.2.4 杂质10的定性分析
杂质10在一维液相的保留时间为38.26 min,在切阀后5.88 min有254 nm的紫外吸收峰(图11),EIC对应离子为m/z 337.0700,与空白脂质体相比确认为表柔比星脂质体样品特有峰(图12)。精确质量计算杂质分子式为C19H12O6,质量偏差2 ppm(0.7 mDa),可能的结构如图所示(图13)。
3.2.5 杂质13的定性分析
杂质13在一维液相的保留时间为45.42 min,切阀后在二维色谱图上对应4.40 min的吸收峰(图14),EIC确认质谱对应离子为m/z 542.1650。与空白脂质体样品比较,为表柔比星脂质体样品特有峰。通过精确质量计算分子式为C27H27NO11,比主成分少2个H,质量偏差-1.39 ppm,可能的结构如图所示(图15)。
3.2.6 杂质14的鉴定
杂质14在一维液相色谱中的保留时间为55.65 min,切阀后4.78 min有紫外吸收峰(图16),质谱对应离子为m/z 1083.3228(图17),与空白脂质体相比,确认为表柔比星脂质体样品特有峰。通过精确质量计算杂质分子式为C54H54N2O22,质量偏差0.17 ppm,与杂质G相比少4H,可能的结构如图所示(图18)。
3.2.7 杂质15的鉴定
杂质15在一维液相色谱中的保留时间为61.01 min,在切阀后6.06 min有254 nm的紫外吸收峰(图19),质谱对应离子m/z 1047.3030及二价信号m/z 524.1539,EIC确认化合物为样品特有峰(图20)。精确质量计算杂质分子式为C54H50N2O20,质量偏差0.83 ppm,与杂质G相比少H8O2,可能的结构如图(图21)。
3.2.8 其他杂质的分析
样品中杂质1~3在一维液相中的保留时间分别为7.35、7.61和8.29 min。在二维液相色谱图中均可提取到C21H18O9(杂质A)的[M+H]+,但因为含量太低,质谱干扰严重,无法进一步确认。推测可能由于空白脂质体的液相色谱行为在这段时间的干扰较强,导致无法分析。
杂质4和杂质12的一维液相保留时间分别为13.19 和41.83 min,由于一维液相色谱峰太低无法进行进一步分析。杂质5、11和16,一维液相保留时间分别为24.69、39.51和75.67 min,在切割到二维液相色谱中后因背景太高无法确认。
杂质6通过精确质量计算的分子式为C27H29NO11,质量偏差-2.89 ppm,推测是杂质7的异构体,但因为含量很低难以进一步确认。
4 结论
本文采用多中心切割模式的2D-HPLC-QTOF法分离表柔比星脂质体中的杂质,使用MFG分子式计算功能对未知杂质进行结构推测。本文分离出的杂质7和杂质10为常见同分异构体杂质和碎片杂质,杂质8和杂质13与主成分相比分别丢失-CH2和2H,杂质14和15是在表柔比星二聚体的基础上丢失4H和H8O2,推断部分杂质可能来源于原料药。由于各杂质峰的二级质谱信号较低未能准确获得因此无法确定各杂质峰手性中心的绝对构型,未来可针对各杂质进行立体结构的分析。本文所采用的多中心切割模式与普通中心切割模式相比,可以对每个一维目标峰进行中心切割,并且较高频率的采样可以对高度复杂的共流出物峰进行详细分析。将二维液相色谱分离技术与QTOF质谱联用,是分离鉴定未知杂质的有力手段。通过此方法共检测出表柔比星脂质体溶液中6个杂质成分并推测出其平面结构,为表柔比星脂质体中杂质的分离鉴定提供了重要参考。
参 考 文 献
Kumar D, Tomar R S, Deolia S K, et al. Isolation and characterization of degradation impurities in epirubicin hydrochloride injection[J]. J Chromatogr B Analyt Technol Biomed Life Sci, 2008, 869(1-2): 45-53.
Conte P F, Gennari A, Landucci E, et al. Role of epirubicin in advanced breast cancer[J]. Clin Breast Cancer, 2000, 1 (Suppl 1): S46-S51.
郑彩微, 帅茨霞, 占丽飞, 等. 表阿霉素和顺铂介入治疗晚期卵巢癌[J]. 温州医学院学报, 2000, 30(2): 117-118.
Song X L, Ju R J, Xiao Y, et al. Application of multifunctional targeting epirubicin liposomes in the treatment of non-small-cell lung cancer[J]. Int J Nanomedicine, 2017, 12: 7433-7451.
Launchbury A P, Habboubi N. Epirubicin and doxorubicin: a comparison of their characteristics, therapeutic activity and toxicity[J]. Cancer Treat Rev, 1993, 19(3): 197-228.
王燕. 新型脂质体作为中药靶向载体在肿瘤治疗中的作用[J]. 中国实验方剂学杂志, 2010, 16(16): 212-215.
国家药典委员会. 中国药典2020年版二部[S]. 2020: 1191.
The United States Pharmacopoeia 43th Edition[S]. Rockville MD: The United States Pharmacopoeia Convention, 2020: 1653.
The European Pharmacopoeia 10.0[S]. Strasbourg: European Directorate for the Quality of Medicine & Health Care, 2020: 2514.
邵伍軍, 和燕玲, 金美春, 等. 2D-HPLC-QTOF法对注射用盐酸表柔比星中二聚体的鉴定[J]. 中国抗生素杂志, 2019, 44(2): 237-240.
基金项目:江西省创新人才团队(No. 20165BCB19009);南昌市高层次科技创新人才“双百计划”;江西中医药大学校级科技创新团队发展计划;国家科技重大专项(No. 2017ZX09210004004)
作者简介:计小凡,女,生于1998年,在读硕士研究生,主要从事药物分析和中药药效物质及其代谢研究,E-mail: 2804799585@qq.com
