硫酸阿米卡星多囊脂质体的制备及评价
2023-04-29张淼邓盛齐张亦斌郑林陶静
张淼 邓盛齐 张亦斌 郑林 陶静

摘要:目的 制備硫酸阿米卡星多囊脂质体(amikacin sulfate multivesicular liposomes, AMK-MVLs),对其进行质量评价,并考察了其体外抗菌活性。方法 采用复乳法制备AMK-MVLs混悬液Ⅰ,Box-Behnken效应面法优化筛选最佳处方,采用生理盐水洗涤后调整药物浓度得AMK-MVLs混悬液。采用光学显微镜、激光粒度仪、差示扫描量热(differential scanning calorimeter,DSC)考察制剂的理化性质,采用透析法考察其体外释放规律,通过微量稀释法初步考察其体外抗菌活性。结果 优化得到AMK-MVLs混悬液Ⅰ的最佳处方为:大豆磷脂与胆固醇质量比为1.91:1,三油酸甘油酯用量为1.02%,PVA用量为0.62%。AMK-MVLs呈堆叠有无数囊泡的非同心球状,AMK-MVLs混悬液包封率(87.12±1.55)%,平均粒径为11.93 μm。DSC结果表明,AMK以无定型状态存在于脂质体内。体外释放结果显示AMK-MVLs混悬液在72 h时释药约80%。体外溶血实验表明,AMK-MVLs脂质体粒子浓度低于400 μg/mL时无溶血风险。体外抗菌实验结果显示,相较于AMK溶液,AMK-MVLs混悬液对E. coli、P.aeruginosa、S. aureus 3种细菌具有更好的抗菌效果。结论 成功制备了一种硫酸阿米卡星多囊脂质体,其粒径分布均匀、包封率高,释药规律符合Higuchi动力学模型,具有增强的抗菌活性。
关键词:硫酸阿米卡星;多囊脂质体;复乳法;Box-Behnken
中图分类号:R978.1文献标志码:A
Abstract Objective To prepare amikacin sulfate multivesicular liposomes (AMK-MVLs), to evaluate their quality, and to investigate their antibacterial activity in vitro. Methods The AMK-MVLs suspension Ⅰ were prepared by the double-emulsion method. The response surface method of Box-Behnken Design was used to optimize the initial prescription. The AMK-MVLs suspension were obtained by adjusting the drug concentration after washing with saline. The morphology was characterized by optical microscopy and the particle size with its distribution was characterized by the laser granulometer. Differential scanning calorimeter (DSC) was used for phase analysis. The in vitro release behavior was determined by dialysis. Their antibacterial activity in vitro was examined using the microdilution method. Results The optimal formulation process for AMK-MVLs suspension I was as followed: The mass ratio of phospholipid to cholesterol was 1.91:1, the dosage of triolein was 1.02%, and the dosage of PVA was 0.62%. AMK-MVLs were non-concentric spheroids stacked with numerous vesicles. The encapsulation efficiency of AMK-MVLs suspension was 87.12%±1.55%. The average particle size of AMK-MVLs was 11.93 μm. DSC results indicated that the drug was dispersed in liposomes in an amorphous state. The in vitro drug release of AMK-MVLs suspension in 72 h was 80%. The hemolytic test showed that there was no risk of hemolysis when the concentration of AMK-MVLs particles was lower than 400 μg/mL. The in vitro antibacterial activities of AMK-MVLs suspension on E. coli, P. aeruginosa, and S. aureus were significantly stronger than those of the free AMK. Conclusion An amikacin sulfate multivesicular liposomes was successfully prepared with uniform particle size, good dispersibility, high encapsulation efficiency, sustained drug release behavior, and enhanced antibacterial activity.
Key words Amikacin sulfate; Multivesicular liposomes; Double-emulsion method; Box-Behnken
阿米卡星是kanamycin-A的半合成衍生物[1],具有免受氨基糖苷钝化酶破坏的特殊结构,因此对革兰阴性菌和许多对其他氨基糖苷类耐药的菌株具有广谱的抗菌活性[2-3]。其作用机制是通过与细菌胞内核糖体30S亚基的16S rRNA解码区A位点紧密结合来抑制细菌蛋白质的合成[4],也可改变细菌细胞壁的通透性,使细胞内盐类及营养物质外漏,导致细菌迅速死亡[5]。临床多以肌注和静滴为主,其注射液个体体内生物半衰期差异大、时间短[6],用量大,且存在剂量依赖性的耳肾和神经肌肉阻滞等毒副作用[7]。因此,延长AMK作用时间,减少用量,降低毒副作用是氨基糖苷类药物新型制剂研发的方向。
多囊脂质体(multivesicular liposomes,MVLs)是一种内部包裹有大量水性囊状腔室,彼此之间紧密堆积的泡沫球状聚集体[8-9]。因此,其作为水溶性药物的优良载体[10-11],包封率高且能够有效延长药物半衰期,减少用量,降低毒副作用。利用多囊脂质体包载阿米卡星是一种有效解决阿米卡星问题的方法。
本研究以AMK为模型药物,采用复乳法制备了AMK-MVLs混悬液Ⅰ,优选天然磷脂作为成膜材料,硬脂胺和聚乙烯醇作为膜稳定剂,对其进行处方工艺的优化,进一步制备AMK-MVLs混悬液和AMK-MVLs冻干品,并对其理化性质表征,体外释放研究以及体外抗菌活性进行考察。
1 材料与仪器
1.1 仪器
高效液相色谱仪(Agilent 1260);VOSHIN92-Ⅱ型超声波细胞破碎仪(无锡沃信仪器有限公司);DF-101S型集热式恒温加热磁力搅拌器(郑州长城科工贸有限公司);092ZY619型pH酸度计(Mettler Toledo仪器有限公司);TGL-22S型台式高速冷冻离心机(四川科蜀仪器有限公司);VORTEX3型涡旋混合仪(德国IKA公司);THZ-92A型气浴恒温振荡器(博讯实业有限公司);LS909型激光粒度分析仪(欧美克);NIB 600型生物显微镜(宁波永新光学股份有限公司);DSC214型差示扫描量热仪(德国耐驰公司);BPN-500H型细菌恒温培养箱(上海一恒科学仪器有限公司);Bio Tek ELx808型酶标仪(美国博腾公司);LDZM-80KCS-II型立式压力蒸汽灭菌锅(上海申安医疗器械厂);SW-CJ-1D型单人净化工作台(沪净净化有限公司);CPA225D型十万分之一电子分析天平(德国Sartorius公司);ME-204型万分之一电子分析天平(Mettler Toledo仪器有限公司)。
1.2 药品与试剂
硫酸阿米卡星(批号20180702)来源于四川抗菌素工业研究所,质量分数>98%;大豆磷脂(SPC-98A,纯度98%)、胆固醇(批号B80859)购自上海艾伟拓医药科技有限公司;三油酸甘油酯(批号F20090911)购自国药集团化学试剂有限公司;硬脂胺(批号E2026029)购自上海Aladdin公司;聚乙烯醇购自美国Sigma-Aldrich公司;金黄色葡萄球菌(S. aureus,CMCC26003)购自中国医学细菌保藏管理中心;大肠埃希菌(E. coli)、铜绿假单胞菌(P. aeruginosa)购自广东环凯微生物科技有限公司;LB、TSB培养基购自北京奥博星生物技术有限责任公司;琼脂粉、生理盐水、分析级葡萄糖、蔗糖、磷酸二氢钾、磷酸、辛烷磺酸钠、无水硫酸钠、氢氧化钠、氯仿购自成都科龙试剂有限公司;色谱级乙腈购自美国Thermo Fisher Scientific公司。
2 方法与结果
2.1 AMK-MVLs的制備
采用复乳法(W/O/W)[10-12]制备AMK-MVLs混悬液Ⅰ。称取处方量的大豆磷脂、胆固醇、三油酸甘油酯、硬脂胺,加入3 mL氯仿,37℃~40℃恒温水浴下加热溶解,作为油相;将AMK溶解于等体积7%蔗糖水溶液中,作为内水相;用注射器吸取内水相缓慢注入持续搅拌的油相中,在冰水浴下,探头超声乳化分散,形成稳定的W/O型初乳;用带细针头的注射器吸取初乳1 mL快速注入5%葡萄糖和一定浓度PVA混合溶液(外水相)2.5 mL中,涡旋混合形成W/O/W型复乳,将复乳转移至蒸发皿中,置于(37±2)℃水浴上同时液面通氮气20 min,即得外观呈淡乳白色的AMK-MVLs混悬液Ⅰ。
2.2 AMK含量测定方法的建立
2.2.1 色谱条件
色谱柱Spursil? -C18(4.6 mm×250 mm,5 μm),流速1.3 mL/min,柱温40℃,检测波长200 nm,进样量10 μL,流动相:取辛烷磺酸钠1.8 g和无水硫酸钠20.0 g,加pH3.0的0.2 mol/L磷酸盐缓冲液(0.2 mol/L磷酸二氢钾溶液,用0.2 mol/L磷酸溶液调节pH值至3.0)50 mL和水875 mL溶解加乙腈75 mL混匀。
2.2.2 溶液的制备
对照储备液:取AMK原料药适量,精密称定,加流动相溶解并定量稀释制成约10 mg/mL的AMK对照储备液;对照溶液:量取对照储备液2.5 mL至10 mL容量瓶中,加流动相稀释制成约2.5 mg/mL的AMK对照溶液,过滤备用;供试品溶液:精密量取0.5 mL AMK-MVLs混悬液至5 mL容量瓶中,加入2.5 mL 10% Triton X-100溶液,摇匀,超声15 min,加流动相稀释至刻度线,摇匀使药物溶解,过滤即得;Blank MVLs溶液:精密量取0.5 mL Blank MVLs混悬液至5 mL容量瓶中,加入2.5 mL 10% Triton X-100溶液,摇匀,超声15 min,加流动相稀释至刻度线,摇匀后过滤即得。
2.2.3 专属性考察
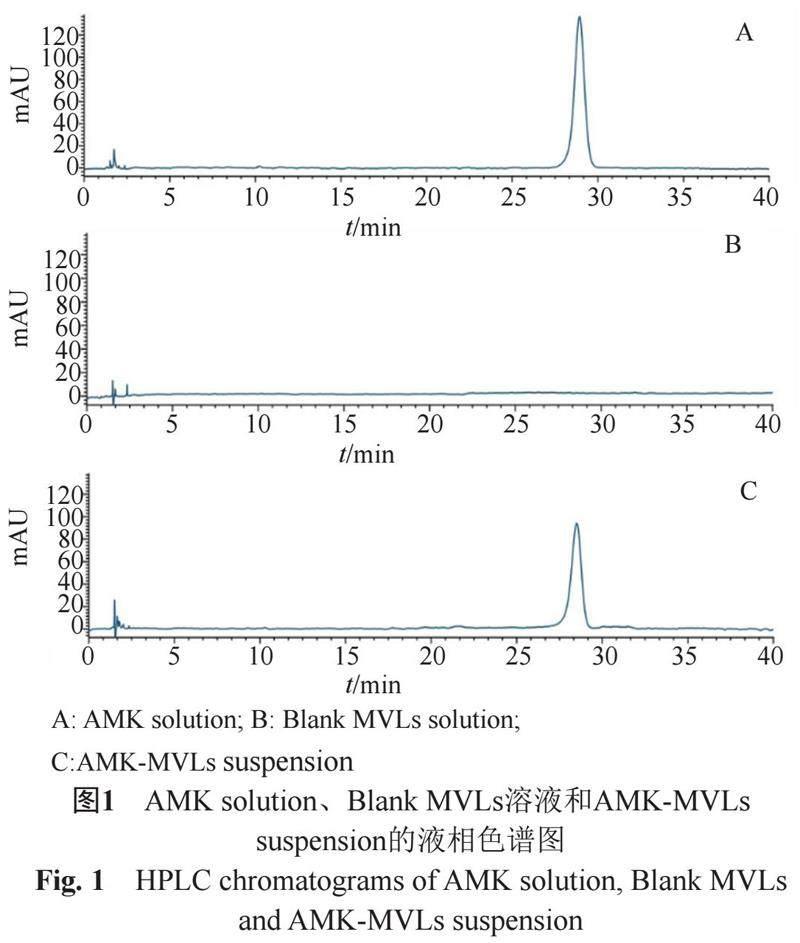
分别取“2.2.2”项下对照溶液,Blank MVLs溶液,供试品溶液,按照“2.2.1”项下色谱条件分别进样测定。结果如图1所示,Blank MVLs中破乳剂、磷脂、胆固醇等脂质材料对AMK的测定无干扰,表明该方法专属性良好。
2.2.4 线性范围和进样精密度考察
精密移取AMK对照储备液,用流动相稀释,配制0.20、1.00、1.50、2.01、2.51和3.01 mg/mL系列浓度的溶液,按照“2.2.1”项下色谱条件分别进样,以峰面积(A)和质量浓度(C)进行线性回归,得回归方程为A=1940.4C-3.6337,R?=0.9994(n=6),表明AMK在0.20~3.01 mg/mL浓度范围内线性关系良好。取“2.2.2”项下对照溶液,按照“2.2.1”项下色谱条件连续重复进样6次,AMK峰面积RSD值为1.19%,小于2%,表明进样精密度良好。
2.2.5 重复性实验
平行制备6份供试品溶液,分别进样测定,AMK峰面积RSD值为1.60%,符合测定要求。
2.2.6 方法回收率实验
精密量取0.5 mL Blank MVLs混悬液至5 mL容量瓶中,分别精密移取一定体积的对照储备液,制成低、中和高3个不同质量浓度(2.00、2.50和3.00 mg/mL)的AMK溶液(n=3),加适量10% Triton X-100,流动相定容,按“2.2.1”项下色谱条件分别进样测定。结果表明,平均回收率分别为101.01%、98.96%和100.20%,且回收率的RSD值均小于2%,表明该方法准确度良好。
2.2.7 包封率和载药量的测定
采用低速离心法测定多囊脂质体的包封率和载药量[13]。取2 mL AMK-MVLs混悬液至离心管内,在3000 r/min离心5 min,取上清液1 mL至5 mL容量瓶内,加入10% Triton X-100,摇匀,超声15 min后加流动相定容,按“2.2.1”项下色谱条件进样测定游离AMK含量,记为W游。取0.5 mL AMK-MVLs混悬液至5 mL容量瓶内,加入10% Triton X-100,摇匀,超声破乳15 min后加流动相定容,按“2.2.1”项下色谱条件进样测定AMK-MVLs的总药量,记为W总,空白载体的质量记为W脂。计算公式如下:
包封率(EE%) = (W总-W游) /W总× 100%(1)
载药量(DL%) = (W总- W游) / (W总-W游+W脂) × 100%(2)
2.3 AMK-MVLs混悬液Ⅰ处方优化
2.3.1 Box-Behnken Design优化处方
在单因素实验的基础上,优化AMK-MVLs混悬液Ⅰ处方,选取超声功率300 W、时间6 min,选择涡旋速度2300 r/min,时间50 s作为工艺条件,选择对AMK-MVLs混悬液Ⅰ影响较大的3个因素,即大豆磷脂与胆固醇比例(A)、三油酸甘油酯用量(B)和PVA用量(C),通过Box-Behnken Design设计3因素3水平的优化实验,具体因素水平见表1。根据实验安排分别制备AMK-MVLs混悬液Ⅰ,以包封率(R1)、载药量(R2)作为评价指标,筛选最优处方,实验结果见表2。
2.3.2 模型拟合及方差分析
采用Design-Expert V8.0.6软件对实验结果进行多元线性回归和二项式拟合,得拟合方程分别为R1=-94.78+45.15×A+32.30×B+314.40×C+13.22×AB-32.13×AC-18.39×BC-10.63×A2-23.08×B2-208.11×C2(R2=0.8703,P<0.05);R2=-50.64+14.79×A-8.52×B+267.37×C+12.94×AB-30.38×AC-18.65×BC-3.56×A2-4.43×B2-170.43×C2(R2=0.8267,P<0.05)。从拟合方程的R2和P值可知,二次多项式拟合较好,可用此模型对AMK-MVLs混悬液Ⅰ进行预测和分析。模型回归方程系数的显著性检验见表3,表明模型R1中PVA用量的一次项、二次项达到显著水平(P<0.05),三油酸甘油酯用量的二次项达到显著水平(P<0.05);模型R2中PVA用量的一次项、二次项达到显著水平(P<0.05)。
2.3.3 响应面优化分析
采用Design-Expert V8.0.6软件绘制3D效应面图,由图2效应面图可知,包封率随着大豆磷脂与胆固醇比例、三油酸甘油酯用量和PVA用量的增加先变大后变小;由图3可知载药量主要受PVA用量的影響,随着用量的增加先增后减。各因素的预测优选处方值分别为:大豆磷脂:胆固醇=1.91:1、三油酸甘油酯用量为1.02%、PVA用量为0.62%,预测样品包封率为53.29%,载药量为29.11%。
2.3.4 处方验证
根据最优处方制备3批AMK-MVLs混悬液Ⅰ样品,对其包封率和载药量进行测定,结果见表4。包封率和载药量的实测值与预测值接近,说明模型拟合成功,结果可靠,可较好地用于AMK-MVLs的处方优化。
2.4 AMK-MVLs混悬液及冻干品的制备
取AMK-MVLs混悬液Ⅰ,与等体积生理盐水搅拌混匀,离心(3000 r/min)5 min,收集沉淀部分,用生理盐水洗涤沉淀3次并稀释制得药物浓度为9 mg/mL的AMK-MVLs混悬液。在AMK-MVLs混悬液中加入3%甘露醇作为冻干保护剂,搅拌溶解,各取2 mL AMK-MVLs混悬液分装于西林瓶中,置于冷冻干燥机内,设置预冻时间为4 h,采用程序升温法设置-45℃、-30℃、-10℃、0℃和20℃个温度梯度,维持35 h,制得AMK-MVLs冻干品。
2.5 AMK-MVLs混悬液的质量评价
2.5.1 形态观察和粒径的测定
采用光学显微镜观察AMK-MVLs的形态(40×10倍)。采用湿法测定法,以400 mL生理盐水作为分散介质,通过搅拌使分散体系成稳定状态,样品量达到检测器遮光度范围的8%~20%,设置分析范围为0.02 ~2100 μm,测定其平均粒径及粒度分布,结果如图4。由图可见,AMK-MVLs外部圆润光滑,无黏连,呈现典型的内部堆叠有无数囊泡的非同心球状结构;平均粒径为11.93 μm,粒径分布均匀。
2.5.2 包封率的测定
取3批AMK-MVLs混悬液按“2.2.7”项下方法测定包封率,测得AMK-MVLs混悬液包封率分别为88.89%、86.09%和86.36%,按该处方制备的AMK-MVLs混悬液可获得高的包封率且重现性好。
2.5.3 差示扫描量热法分析
采用差示扫描量热仪测定AMK与MVLs物理混合物及AMK-MVLs冻干品的热行为。依次将待测样品放置于相对应的铝盘内,称重记录后,给以1 mL/min氮气,以10℃/min的加热速率从35℃升温至400℃,进行DSC扫描分析。结果见图5。由图5可知,在物理混合物与AMK-MVLs冻干品图谱中,200℃~250℃温度范围内对应的吸收峰值有不同,可能是由于AMK的晶体结构在脂质体的载药和制备过程中已转变为无定型状态存在,这表明药物在载体中被包埋。
2.5.4体外释放研究
分别精密移取AMK-MVLs混悬液、AMK溶液(与AMK-MVLs混悬液药物浓度等量)各3 mL于清洗干净的透析袋(MW=14000)内,排尽透析袋内气泡并将两端扎紧,置于盛有10 mL pH 5.5和pH 7.4的磷酸盐缓冲液的离心管中,将离心管放置于恒温气浴振荡器中,在37℃条件下以50 r/min振荡速率恒温振荡72 h。分别于0.5、1、2、4、10、20、24、48和72 h取样2 mL并补加等温同体积的新鲜释放介质,样品按照“2.2.1”项下色谱条件进样测定其中AMK的含量,并计算药物累积释放百分率,绘制释放曲线如图6所示。
结果表明,AMK-MVLs混悬液在10 h释放约35%,24 h释放约55%,72 h释放约80%,基本释放完全,具有缓释作用。在两种释放介质中表现出相似的释放行为,无突释效应。另累积释药曲线方程拟合结果显示,AMK-MVLs混悬液在pH5.5和pH7.4两种释放介质中的释药规律均符合Higuchi动力学模型。
2.6 体外红细胞溶血
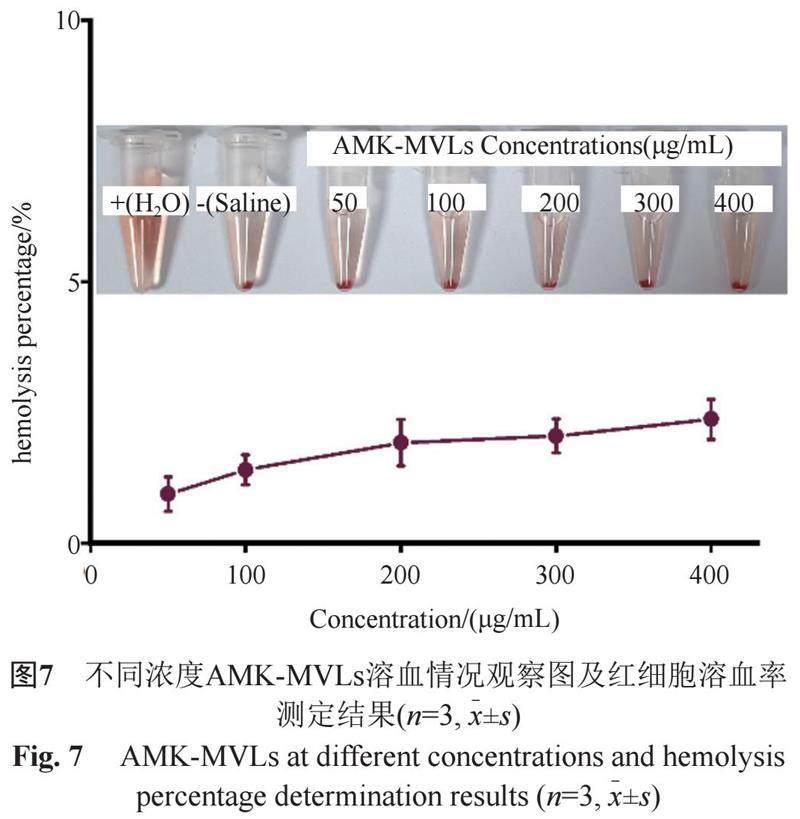
采用体外红细胞溶血实验来考察脂质体材料的安全性[14]。称取AMK-MVLs冻干粉5 mg于5 mL容量瓶中,用生理盐水溶解并定容至刻度线,即得AMK-MVLs储备液,用生理盐水将储备液依次稀释为400、300、200、100和50 μg/mL。取500 μL上述多囊脂质体稀释液分别加到500 μL 2.0% SD大鼠红细胞悬液中,置于恒温气浴震荡器(37±0.5)℃中孵育2 h后,2500 r/min条件下离心6 min,在紫外-可见分光光度计541 nm处测定各组离心后上清液的吸光度,其中阳性对照为超纯水,阴性对照为生理盐水,各组重复3次,并通过公式3计算AMK-MVLs的红细胞溶血率(%)。
红细胞溶血率(HR)%=(A药物组-A阴性对照组)/(A阳性对照组-A阴性对照组)×100% (3)
由图7可知,阳性对照组产生了全溶血现象,而阴性对照组与各药物组未出现溶血及凝集现象。红细胞溶血率数据结果表明,当AMK-MVLs脂质体粒子浓度达到400 μg/mL时,其红细胞溶血率为2.4%,小于5%,该结果与肉眼观察结果一致,表明AMK-MVLs是无溶血作用的。
2.7 AMK-MVLs的体外抗菌活性研究
配制LB、TSB液体培养基和固体培养基,对其进行灭菌处理后于4℃条件下储存,并将已标好浓度的S. aureus、E. coli和P. aeruginosa 3种菌用无菌生理盐水调整菌液浓度分别为3×106、3×108和2×108 CFU/mL。其中,LB作为S.aureus和E. coli的培养基,TSB作为P. aeruginosa的培养基。
2.7.1 细菌生长抑制率的测定
采用微量稀释法测定药物的细菌生长抑制率以研究其对细菌的生长抑制情况[15-16]。分别向96孔板中加入100 μL上述稀释后的菌液,再将AMK溶液和AMK-MVLs混悬液分别用LB肉汤培养基和TSB培养基倍比稀释后取100 μL分别加入各孔中。其中陰性对照组为培养基,空白对照组为对应浓度的Blank MVLs。将96孔板置于恒温培养箱37℃下孵育24 h,使用酶标仪测定600 nm下的吸光度值(A600),通过公式4计算细菌生长抑制率。
细菌生长抑制率%=(A600阴性对照组-A600药物组) / (A600阴性对照组)×100%(4)
由图8可知,对于3种菌来说,在一定药物浓度范围内,AMK溶液和AMK-MVLs混悬液的细菌生长抑制率随着药物浓度的增加而增大,表明两者抑菌作用均具有一定浓度依赖性,且AMK-MVLs混悬液在低浓度时,表现出更好的抑菌效果。
2.7.2 细菌生长抑制率-时间曲线
为研究AMK溶液和AMK-MVLs混悬液对3种细菌生长抑制作用随时间变化情况,本实验以加入培养基作为阴性对照组,Blank MVLs作为空白对照组,其中药物组分别设置5个浓度梯度,给药剂量和菌液浓度同“2.7.1”。分别于给药后0、1、2、4、10、16和24 h时使用酶标仪检测600 nm处的吸光度值(A600),最后以细菌生长抑制率-时间作图即得。
由图9可知,在达到一定药物浓度时,随着时间延长,AMK溶液的细菌生长抑制率逐渐趋于平稳,各浓度具有相似的时间曲线,而AMK-MVLs组在给药后24 h内生长抑制率呈逐渐上升趋势。
2.7.3 细菌铺板
为了进一步证明AMK溶液和AMK-MVLs混悬液对3种菌的抗菌活性是有效的。将培养24 h的96孔板中S. aureus、P. aeruginosa和E. coli菌液用无菌生理盐水稀释100倍后分别吸取200 μL接种至琼脂平板上,于37℃恒温培养箱中倒置培养24 h,观察不同处理情况下细菌的数量以及生长情况。
如图10可以看出,与空白对照组和阴性对照组相比,AMK溶液和AMK-MVLs混悬液在一定的浓度范围内,细菌在固体培养基上形成的菌落图像具有一定趋势。当达到一定浓度时,基本无法形成菌落。
3 讨论
多囊脂质体具有生物相容性好[17],能够在给药部位形成药物贮库,延长药物释放时间,防止突释现象发生等优势[18],是一种具有良好发展前景的新型给药系统。本文优选的成膜材料天然磷脂,与常用的合成磷脂比,生物相容性更好,相转变温度低,制备条件相对温和。采用硬脂胺代替负电荷磷脂作为膜稳定剂,可以成功制备出多囊脂质体,同时降低成本。本文使用的多囊脂质体的制备方法操作简便,可以得到粒径分布均匀的多囊脂质体粒子。
本文采用Box-Behnken效应面法对影响AMK-MVLs混悬液Ⅰ制备过程中重要的处方因素进行优化,得到AMK-MVLs混悬液Ⅰ包封率为52.15%,载药量为27.99%,纯化后包封率为87.12%。
为考察AMK-MVLs混悬液的体外抗菌活性,本文首先以24 h细菌生长抑制率为指标,对比AMK溶液和AMK-MVLs混悬液对革兰阳性菌金黄色葡萄球菌和革兰阴性菌大肠埃希菌和铜绿假单胞菌生长的抑制作用,结果发现低浓度时AMK-MVLs混悬液表现出更好的抗菌效果,但并未有显著的提高;接着考察了不同时间点,AMK溶液与AMK-MVLs混悬液的细菌生长抑制率,在给相同剂量药物时,AMK-MVLs混悬液在24 h达到与AMK溶液相同的抗菌效果。结合释放特性分析,24 h AMK-MVLs混悬液的累积释放率约达50%,并未达到完全释放,说明AMK-MVLs混悬液具有更好的抗菌活性。此外,结合溶血性实验结果分析,AMK-MVLs混悬液在发挥有效抗菌活性范围内是无溶血风险的。
参考文献
Kawaguchi H, Naito T, Nakagawa S, et al. BB-K 8, a new semisynthetic aminoglycoside antibiotic[J]. J Antibiot, 1973, 25(12): 695-708.
Tripathi K D. Essentials of medical pharmacology[M]. Uttar Pradesh India: JP Medical Ltd., 2012.
Fatima S, Panda A K, Talegaonkar S, et al. Optimization and designing of amikacin-loaded poly D, L-Lactide-co-glycolide nanoparticles for effective and sustained drug delivery[J]. J Pharm Bioallied Sci, 2019, 11(1): 83-95.
Rosenberg C R, Fang X, Allison K R. Potentiating aminoglycoside antibiotics to reduce their toxic side effects[J]. PLoS One, 2020, 15(9): e0237948.
諸玲玲, 孟现民, 张永信. 氨基糖苷类药物的发展历程[J]. 上海医药, 2011, 32(7): 322-326.
Black F O, Gianna-Poulin C, Pesznecker S C. Recovery from vestibular ototoxicity[J]. Otol Neurotol, 2001, 22(5): 662-671.
Xie J, Talaska A E, Schacht J. New developments in aminoglycoside therapy and ototoxicity[J]. Hearing Res, 2011, 281(1-2): 28-37.
Kim S, Turker M S, Chi E Y, et al. Preparation of multivesicular liposomes[J]. BBA-Biomembranes, 1983, 728(3): 339-348.
李晓锋. 多囊系统在药物递送中的研究进展[J]. 中国新药杂志, 2019, 28(14): 1704-1712.
Li N, Shi A, Wang Q, et al. Multivesicular liposomes for the sustained release of angiotensin l-converting enzyme(ACE) inhibitory peptides from peanuts: Design, characterization, and in vitro evaluation[J]. Molecules, 2019, 24(9): 1746-1761.
Abuzar S M, Park E J, Seo Y, et al. Preparation and evaluation of intraperitoneal long-acting oxaliplatin-loaded multi-vesicular liposomal depot for colorectal cancer treatment[J]. Pharmaceutics, 2020, 12(8): 736-753.
李海刚, 徐佳敏, 徐康. 野黄芩苷内水相增稠多囊脂质体的制备及其稳定性的初步考察[J]. 中国医药工业杂志, 2018, 49(8): 1129-1135.
Roehrborn A A, Hansbrough J F, Gualdoni B, et al. Lipid-based slow-release formulation of amikacin sulfate reduces foreign body-associated infections in mice[J]. Antimicrob Agents Chemother, 1995, 39(8): 1752-1755.
Li S Y, Cheng H, Xie B R, et al. Cancer cell membrane camouflaged cascade bioreactor for cancer targeted starvation and photodynamic therapy[J]. ACS Nano, 2017, 11(7): 7006-7018.
楊谦. 光响应茶皂苷元衍生物阳离子脂质体的制备及其抗菌活性研究[D]. 广州: 华南理工大学, 2018.
吴佳禾. 基于银纳米粒的酸响应型纳米药物的构建及其抗耐药细菌感染的研究[D]. 浙江大学, 2020.
Mu H, Wang Y, Chu Y, et al. Multivesicular liposomes for sustained release of bevacizumab in treating laser-induced choroidal neovascularization[J]. Toxicol Lett, 2018, 294(1): 166-176.
Manna S, Wu Y, Wang Y, et al. Probing the mechanism of bupivacaine drug release from multivesicular liposomes[J]. J Control Release, 2019, 294(28): 279-287.
作者简介:张淼,女,生于1996年,在读硕士研究生,主要研究方向为药物新剂型与新技术,E-mail: zhangmiao_223@163.com
