耐甲氧西林金葡菌的分子分型、毒力因子及生物膜研究
2023-04-29张丽心于燕常育陈瑞琪
张丽心 于燕 常育 陈瑞琪
摘要:目的 研究耐甲氧西林金黄色葡萄球菌(MRSA)的标本分布、耐药情况、SCCmec、spa分型、相关毒力因子及生物膜形成情况。方法 采用多重PCR扩增SCCmec、spa基因及毒力因子(tst、lukE、pvl、fnbA、fnbB、cna、clfA、clfB);采用Sanger双脱氧链终止法对扩增产物测序;采用微孔结晶紫染色法研究菌株生物膜形成。结果 标本来源以分泌物最多,其次是痰;标本分布以儿童病区最多,其次为创伤病区及重症监护病区;SCCmec分型显示I型最多,占56%;spa分型以t437最多,占43%;多数菌株同时携带3种及以上毒力因子,以cna、fnbB和clfA黏附分子为主;60%的MRSA菌株具有较强生物膜形成能力。结论 MRSA在儿童病房的流行需要引起注意;ICU病区呼吸机引起的相关感染仍是一大难题。本医疗机构内MRSA(2018—2019年)菌株以t437-SCCmecI型为主要流行克隆株。MRSA携带黏附毒素比率高,容易形成生物被膜,成为治疗的一大难题。
关键词:耐甲氧西林金葡菌;SCCmec;spa;毒力因子;生物膜
中图分类号:R978.1文献标志码:A
Abstract Objective To study the distribution, drug resistance, SCCmec or spa genotype, related virulence factors, and biofilm formations of methicillin-resistant Staphylococcus aureus (MRSA). Methods Multiplex PCR was used to amplify SCCmec or spa genotype. Sanger dideoxy chain termination was used to sequence the amplified products. Bacterial biofilms were studied by the microporous crystal violet staining. Results The most common source of specimens was secretions, followed by sputum. Most of the specimens were distributed in childrens wards, followed by trauma wards and intensive care wards. SCCmecI was the most common type and accounted for 56% in MRSA; t437 was the majority in spa types, and accounted for 43%. Most strains carried three or more virulence factors at the same time, mainly cna, fnbB, and clfA adhesion molecules; 60% of MRSA strains had strong biofilm formation ability. Conclusion The prevalence of MRSA in childrens wards needs attention. The related infections caused by ventilator in ICU ward are still a major problem. The t437-SCCmec I strain is the main epidemic clone of MRSA (2018—2019) in our medical institution. MRSA carries a high rate of adhesion toxins and is easy to form biofilms, which has become a problem in treatment.
Key words Methicillin-resistant Staphylococcus aureus; SCCmec; spa; Virulence factors; Biofilm formation
耐甲氧西林金黃色葡萄球菌(methicillin-resistant Staphylococcus aureus,MRSA)是医院内重要的临床致病菌之一,由于对多种抗生素高水平耐药,成为导致院内感染和社区感染的重要病原菌之一。根据全国细菌耐药监测网(China antimicrobial resistance surveillance system, CARSS)监测结果显示,2014—2019年我国医疗机构内MRSA的平均检出率仍在30%左右[1]。因此,对医疗机构内的耐药菌进行分析和有效的鉴定分型,研究耐药菌的分子流行病学特征对医疗机构防控该菌传播及耐药研究具有重要意义;探讨所研究区域的耐药情况及临床感染特征,对临床准确诊治感染,合理使用抗微生物药物,减少和控制耐药细菌的传播具有重要意义。本实验收集我院2018年6月—2019年7月住院患者治疗期间血液、痰液及伤口分泌物培养出的MRSA菌株(同一患者多次标本的菌株,均取首次),所有菌株经梅里埃公司VITEK 2-compact微生物自动化系统鉴定,并进行药敏实验后,-80℃磁珠冻存。对所留取菌株进行SCCmec、spa基因、相关毒力因子扩增及生物膜形成实验,分析本单位MRSA的流行情况及主要基因分型,以期更好地为临床抗感染治疗及医院感染防控提供理论依据。
1 材料与方法
1.1 材料
1.1.1 菌株来源
收集本院2018年6月—2019年7月的临床MRSA 菌株,依次编号后用平板划线法提纯,用磁珠保存并标记提纯后的细菌于-80℃,并登记相应患者的医疗信息。
1.1.2 主要试剂与仪器
全自动细菌鉴定药敏分析仪(法国Biomerieux VIEK-2 Compact);PCR扩增仪Bio-Rad C1000 (美国Bio-Rad);DYCP-32B型琼脂糖水平电泳仪(中号) (北京六一生物科技);Alpha凝胶成像系统 AlphaImager HP (美国ProteinSimple);Trans2K? DNA Marker (BM101-01, TRAN);基因克隆试剂2×EasyTaq? PCR SuperMix (+dye )(AS111-11, TRAN);Agarose Regular (TaKaRa,5260);StarStain Red核酸染料10000×(GenStar, E109-01);胶回收试剂盒DP209(天根生物);DNA提取试剂盒(QIAamp DNA Mini Kit)(美国Axygen)。
DNA分子量标准Trans2K? DNA Marker (BM101-01, TRAN)(北京全式金生物技术)。
1.2 方法
1.2.1 MRSA的检测
(1)细菌浊度:挑取在合适培养基上分离到的革兰染色为阳性球菌的待测菌落于0.85%NaCl溶液中,配制浓度为0.50至0.63 CFU/mL标准单位的菌悬液。
(2)上机鉴定:用革兰阳性细菌鉴定卡(GP鉴定卡)进行菌种鉴定。
(3)结果判读:根据观察到的多个生长特征参数计算MIC值。
1.2.2 SCCmec分型
参照文献方法[2],采用多重PCR法对MRSA菌株进行SCCmec基因分型。SCCmec基因分型所需的九对引物序列见文献[2]。
Multiplex PCR反应体系(50 μL:Multi酶系Mix 8.5 μL,Multi Buffer Mix 25 μL,Solution II 0.25 μL,DNA 1 μL,上游、下游引物(共8对引物)各0.5 μL,RNase Free-H2O补至终体积25 μL。
反应条件:95℃预变性 15 min,30个循环(94℃变性30 s,57℃退火1.5 min,72℃延伸1.5 min),72℃延伸10 min,4℃保持。
PCR反应结束后,将产物置于4℃冰箱,取5 ?L产物加入1%琼脂糖凝胶中,120 V电泳30 min,用凝胶成像仪观察实验结果,比对分析出现的电泳条带,根据条带位置,参照Marker, 确定其SCCmec可能型别。随机选取PCR扩增的阳性产物送公司进行测序分析,确认条带的准确性及特异性。
1.2.3 spa分型及測序
spa基因的X区由多个24 bp片段大小重复区构成,重复2~16次,通过对该区域重复序列的个数和排列的差异进行菌株分型,检测快速、分辨率高、分型能力强、结果命名易于标准化。该区域根据参考文献设计扩增引物[3]:
反应体系和循环参数同SCCmec分型,扩增的产物经1.2%的琼脂糖凝胶电泳25 min后拍照保存,外送测序公司进行双向测序。
测序结果统一提交网站http://spatyper.fortinbras,.us/分析确定型别。测序公司:杨凌天润奥科生物科技有限公司;测序方法:Sanger双脱氧链终止法。
1.2.4 毒力因子扩增
根据文献报道[4-5],采用PCR法扩增相关毒素基因。包括毒素基因tst、lukE、pvl和黏附基因fnbA、 fnbB、cna、clfA、clfB,同时通过比较不同克隆间毒力因子携带率的差异,探索各流行克隆菌株可能的毒力特征。
PCR反应体系及反应条件同SCCmec分型部分。随机选择PCR扩增阳性产物送公司进行测序分析,确认条带的准确性和特异性。
1.2.5 生物膜形成情况
根据文献[6],运用结晶紫法,对全部菌株进行染色,观察生物膜形成情况。每株菌设3个复孔,每种菌株A值取4个孔的实验平均值(A值),空白组只加入含1%葡萄糖的TSB溶液,空白组A值的2倍作为界限值(Ac)。根据每组细菌A值与Ac值大小的关系,细菌被分为以下4类[7]:①强生物被膜形成株(A>4×Ac);②较强生物被膜形成株(2×Ac<A≤4×Ac);③弱生物被膜形成株(Ac<A≤2×Ac); ④无生物被膜形成株(A≤Ac)。
2 结果
2.1 标本来源及临床分布特点
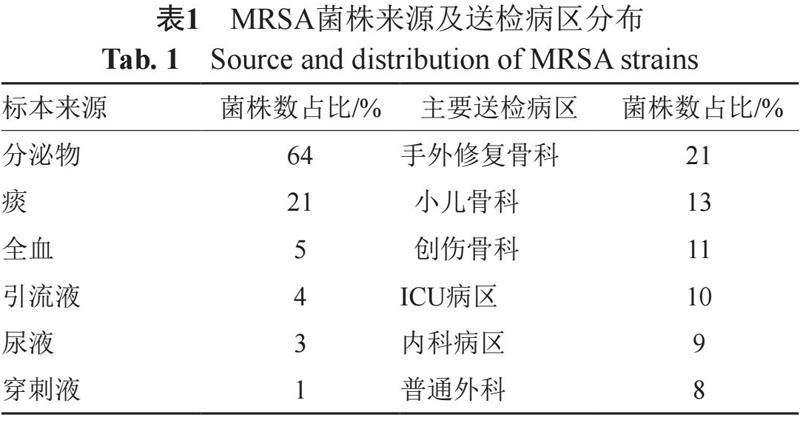
共留取本医疗机构2018年6月—2019年7月经检验科微生物室细菌培养结果回报为MRSA的菌株共70株(同一患者多次重复分离株标本只计入首次),结果见附表1。
2.2 耐药分析
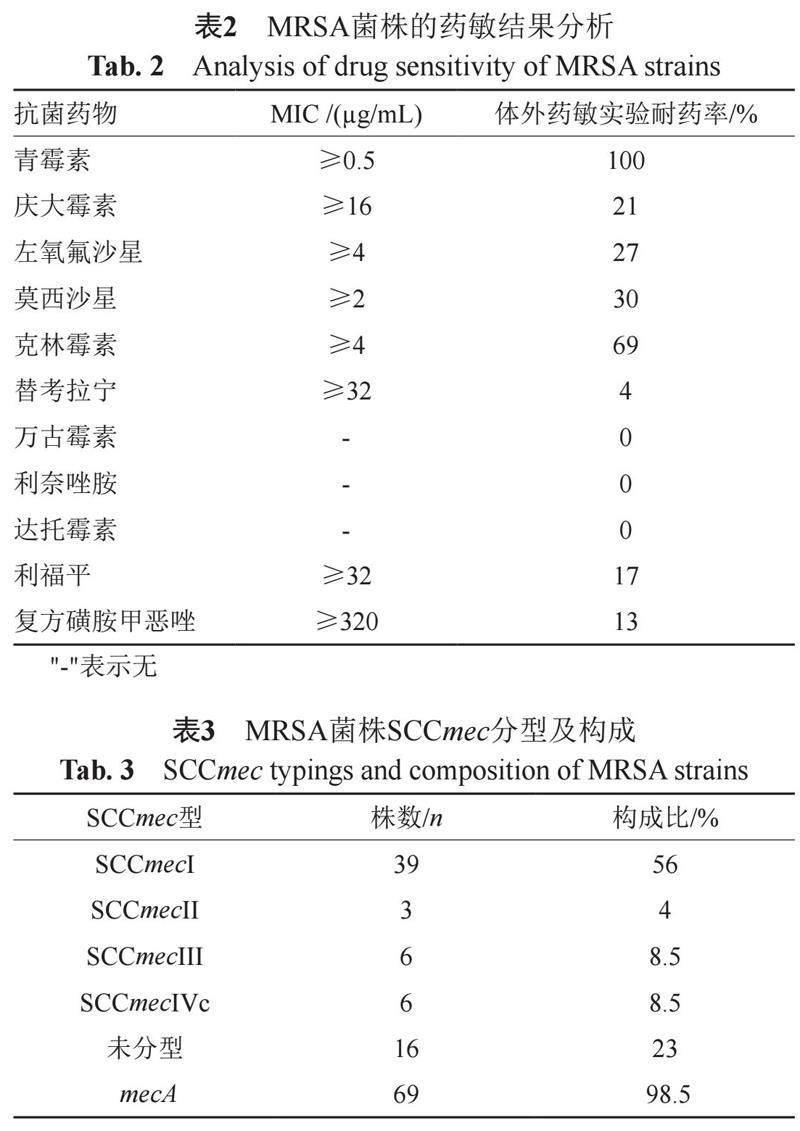
研究所留取的MRSA菌株均为头孢西丁筛选实验(+),苯唑西林耐药(≥4),其余药物体外药敏实验结果显示:青霉素100%耐药率,克林霉素69%耐药率,值得注意的是莫西沙星耐药率达到30%,万古霉素、利奈唑胺、达托霉素均未发现有耐药菌株,结果见表2。
2.3 SCCmec分型结果
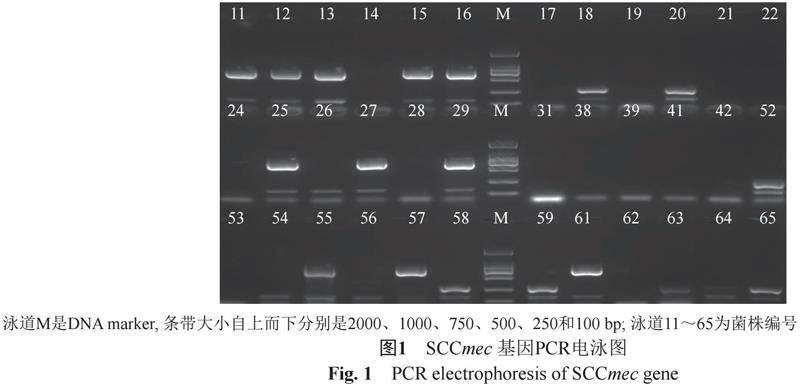
本次研究检测的70株MRSA中69株扩增出mecA基因阳性,阳性率98.5%。mecA基因条带与DNA marker比较,位置相符,无非特异性产物条带。扩增产物经测序证实为mecA基因。
结果提示(表3):SCCmecI型占56%,SCCmecIII和SCCmecIVc各占8.5%,有16株未显示分型,占23%;对分型结果行随机测序显示结果相符。提示本医疗机构内SCCmecI型为主要流行株。PCR电泳结果(图1)。
2.4 spa分型结果
对70株MRSA 菌株均进行扩增,然后将产物全部测序,结果显示(表4)以t437型最多,占43%,其次为t030型,占13%。结合2种分型方法,在本医疗机构中以t437-SCCmecI菌株为主要流行克隆株。PCR电泳结果(图2)。
2.5 毒力因子扩增结果
对70株MRSA菌株毒素基因tst、lukE、pvl和黏附基因 fnbA、fnbB、cna、clfA、clfB,同时进行PCR扩增, 随机挑取扩增产物进行测序比对。结果显示(表5),60%以上的菌株含有3个及其以上的毒力因子。携带率高的毒力因子基因分别为cna(76%)、clfA(73%)、fnbB(49%)和fnbA(27%)。结果提示黏附毒素携带率较高,而细胞毒素lukE和pvl及超抗原tst均比较低。PCR电泳结果(图3)。
2.6 生物被膜形成情况
结果发现(表6~7),70株MRSA菌株中有較强生物被膜形成的有42株,占所有菌株的60%,且发现均携带有cna、clfA和fnbB,3种毒力因子。无生物被膜形成菌株中有2株未携带毒力因子,1株携带cna。
生物被膜形成株细菌 A值与空白组相比,有显著差异(表7)。
3 讨论
2019年CLSI M100重新修订了耐甲氧西林金黄色葡萄球菌(MRSA)的定义,指由mecA和mecC基因表达或具其他耐甲氧西林机制的金黄色葡萄球菌菌株。大多数的葡萄球菌分离株,苯唑西林耐药是由mecA基因介导,编码青霉素结合蛋白2a,非mecA基因介导的苯唑西林耐药机制很罕见,包括有变异的mecA同源基因和mecC基因[8]。
在抗生素存在下,SCCmec上的mecA基因可作为诱导剂分解结合在其启动子上的阻遏蛋白mec I, 启动mecA表达,产生PBP2a,继续肽聚糖的合成,从而使细菌产生耐药[9]。本实验中70株MRSA菌株经PCR扩增出mecA目的基因条带69株,阳性率98.5%,未扩增出目的基因的菌株,可能与菌株不纯有关。
根据目前已知的mec复合体、ccr复合体的相互结合类型及J区的亚类型别,SCCmec可被分为I型~XIII型共13个类型[10-11]。人源MRSA主要携带I-VIII型SCCmec元件,其中I-V型多见,医院获得型MRSA(HA-MRSA)分离菌株以Ⅰ、Ⅱ、Ⅲ型多见;社区获得型MRSA(CA-MRSA)以IV型、V 型多见[12]。在本研究中,70株MRSA除16株未显示SCCmec分型外,其余54株菌株中56%为SCCmecI型,5株分别为SCCmecIII型和SCCmecIVc型,结果提示,在所研究阶段本医疗机构内以SCCmecI型为主要流行克隆株。
本医疗机构6年(2015—2020年)的数据统计结果显示,MRSA的平均检出率占所分离出金葡菌的38.6%,高于本省及全国平均检出率。标本来源以分泌物最多,占全部留取MRSA菌株的64%,与本医疗机构骨科床位数及骨科患者占比多有关。标本分布病区以手外修复骨科最多,占21%,与患者多为开放损伤,多次手术且住院时间长有关;值得注意的是,小儿骨科病区送检标本也居于前列,占14%,仅次于开放性损伤较多的创伤骨科病区,提示我们MRSA在儿童病房的流行不容忽视;ICU病区送检均为痰标本,提示在ICU病区呼吸机引起的相关感染仍是一个棘手的问题。
院内多重耐药菌的定植是临床感染的主要原因之一。住院患者耐药菌一般不外乎以下途径:①社区感染进入;②正常菌群在人体某部位定植。而住院期间经有创检查,侵入性治疗,及自身免疫力低下等原因,细菌移行诱发感染;有部分患者因外伤或局部伤口等因素,在相对密闭的病房环境中,可能接触环境物品中定植菌或通过与携带定植菌的医护人员接触而引起耐药菌转移诱发感染[13];还有部分患者因伤住院时间较长,由于正常皮肤定植菌在易感因素诱发下引起感染,及抗微生物药物使用不当,在抗生素筛选压力下,导致耐药菌繁殖生长等。此外还有一些其他因素如年龄,基础疾病等均可导致医院内耐药菌感染。
根据CHINET的报告,虽然MRSA的检出率在下降,但在来源于儿童的标本中,MRSA检出率却呈上升趋势[14]。2019年全国细菌耐药监测报告数据显示:全国儿童医院(含妇幼保健院) CTX/CRO-R-KPN、CR-ECO、CR-KPN 、MRSA、MRCNS及ERSP的检出率高于三级医院及二级医院。本研究中,从标本分布病区情况看,儿童病区样本量处于第三位,结合文献报道[15], 结果提示对MRSA在儿童病房的流行在医疗机构内部需加强监护,同时对儿童感染的用药建议进行专项监控,避免不合理使用导致耐药菌大幅增长。
spa分型由特异性蛋白A编码的spa基因提供合适的短重复序列区域作为单基因座序列分型的靶点,具有多态性[16]。本研究发现,在本医疗机构内MRSA菌株以t437型最多,占43%,其次为t030型,占13%。
两种分型方法的结果显示t437-SCCmecI型为本研究中主要的MRSA流行克隆株,提示医疗机构内部的感染控制仍不容轻视。医务人员自身防护、无菌操作规范化意识仍需不断提高和加强;医务人员手消毒、无菌操作、环境监测等方面的严格要求并实施,对于SAU及MRSA的防控极为重要。同时,儿童病区MRSA的流行建议进行动态监控,并追踪分析原因。
生长繁殖期的金葡菌产生多种致病因子,在指数生长初期产生细胞表面因子,其中的黏附因子在细菌感染中起重要作用,促使细菌定植,并逃避宿主免疫系统的攻击。本研究对MRSA的几种黏附因子进行研究,发现识别血纤维蛋白原的黏附素clfA,识别胶原的黏附素cna及识别纤维黏连素的黏附素fnbB携带率最高。 通过微孔法结晶紫染色对菌株生物膜形成进行研究,发现同时携带cna、clfA和fnbB3种毒力黏附因子的MRSA菌株具有较强的生物被膜形成能力,占所研究菌株的60%,这一结果也和64%的标本类型为分泌物相一致,在研究中大部分标本来源于骨科病区患者的伤口分泌物,因为骨科手术内固定物的存在,加上伤口周围血液、细胞外基质等的包裹,为细菌的黏附提供了很便利的条件,通过特异性和非特异性结合,细菌很容易聚集在一起,形成生物膜,生物膜的存在提高了细菌对抗菌药物的耐药性,增加了细菌的多重耐药机制,增加了临床治疗的困难。同时由于细菌形成生物膜的能力在各菌株间表现不同,因此有必要对不同来源菌株的生物膜形成能力进行评估和测定,以便更好的采取必要措施进行预防和治疗。建议对来自于伤口分泌物的骨科手术标本,采取简便的实验进行生物膜评估,可以采用多重PCR的方法扩增细菌黏附因子来对生物膜形成进行快速的初步预测,有利于临床合理使用抗菌药物,提高治愈率,缩短治疗时间。进一步,针对MRSA黏附因子作为靶点进行药物研究,减少定植黏附,切断生物膜形成的首要条件,对临床治疗具有一定的意义。
本研究对万古霉素及去甲万古霉素的使用也进行了回顾性分析评价,这一部分将在另一篇文献进行论述。
综上所述,在本研究中,可以得出以下结论:①MRSA在儿童病房的流行应该进行监测并评估;ICU病区呼吸机引起的相关感染仍是一大难题。②本医疗机构内MRSA(2018—2019年)流行菌株以t437-SCCmecI型为主要流行克隆株;提示医疗机构内部感染控制仍需提高警惕并加强监控。③MRSA携带黏附毒素率高,容易形成生物被膜,可以采取手段进行评估预测,针对性的新药研发可以此为靶点进行开发研究。
参 考 文 献
全国细菌耐药监测网. 全国细菌耐药监测网2014—2019年不同等级医院细菌耐药监测报告[J]. 中国感染控制杂志, 2021, 02: 95-111.
Zhang K, McClure J A, Elsayed S, et al. Novelmultiplex PCR assay for characterization and concomitant subtyping of staphylococcal cassette chromosome mec types I to V in methicillin-resistant Staphylococcus aureus[J]. J Clin Microbio, 2005, 43(10): 5025-5033.
Mathema B, Mediavilla J, Kreiswirth B N. Sequence analysis of the variable number tandem repeat in Staphylococcus aureus protein A gene: Spa typing[J]. Methods Molecu Biol Rep, 2008, 431: 285-305.
Liu Q, Han L, Li B, et al. Virulence characteristic and MLST-agr genetic backgroud of high-level mupirocin-resistant, MRSA isolates from Shanghai and Wenzhou, China[J]. PLoS ONE, 2012, 7(5): e37005.
Li M, Du X, Villaruz AE, et al. MRSA epidemic linked to a quickly spreading colonization and virulence determinant[J]. Nature Medic, 2012, 18(5): 816-819.
陈开森, 黄小林, 丁露, 等. 不同时间段临床分离MRSA生物膜形成能力的探讨[J]. 实验与检验医学, 2011, (1): 37-38.
胡曰健, 王倩, 马瑞, 等.生物膜定量分析仪对不同细菌早期生物膜形成能力的比较研究[J]. 中国微生态学杂志, 2011, 23(9): 850-852.
武杰, 赵建平. MRSA的检测、耐药、流行及抗菌药物选择的研究进展[J/OL]. 中国抗生素杂志. https: //doi.org/10.13461/j.cnki.cja.006993
杨延成, 程航, 周人杰, 等. SCCmec遗传元件及其在耐甲氧西林金黄色葡萄球菌分子分型中的应用[J]. 遗传, 2015, 37(5): 442-451
Misiura A, Pigli Y Z, Boyle-Vavra S, et al. Roles of two large serine recombinases in mobilizing the methicillinresistance cassette SCCmec[J]. Mol Microbiol, 2013, 88(6): 1218-1229.
Lakhundi S, Zhang K. Methicillin-resistant Staphylococcus aureus: Molecular characterization, evolution, andepidemiology[J]. Clin Microbiol Rev, 2018, 31(4): e00020-18.
Deurenberg R H, Stobberingh E E. The molecular evolution of hospital- and community-associated methicillin-resistant Staphylococcus aureus[J]. Curr Mol Med, 2009, 9(2): 100-115.
葉慧芬, 曾俊韶, 覃文周, 等.重症监护病房患者MRSA定植情况及影响因素研究[J]. 中国消毒学杂志, 2015, (1): 24-26.
胡付品, 郭燕, 朱德妹, 等. 2017年CHINET中国细菌耐药性监测[J]. 中国感染与化疗杂志, 2018, 18(3): 241-251.
张秀芳, 柴杰, 谭雪峰, 等. 儿童标本中分离MRSA的SCCmec基因分型及耐药性分析[J]. 中华全科医学, 2020, 18(10): 1718-1720.
Stefani S, Chung D R, Lindsay J A, et al. Meticillin-resistant Staphylococcus aureus (MRSA): Global epidemiology and harmonisation of typing methods[J]. Inter J Antimicrob Agents, 2012, 39(4): 273-282.
基金项目:陕西省社会发展基金资助项目(No. 2018SF-146)
作者简介:张丽心,女,生于1974年,博士,副主任药师,研究方向为抗感染治疗,E-mail: zlx_good@163.com
