肾功能损害对急性缺血性脑卒中机械取栓临床预后的影响
2023-04-12顾志群丁云龙钮佳丽范娇鑫
顾志群 丁云龙 钮佳丽 范娇鑫


[摘 要] 目的:评估肾功能损害对急性缺血性脑卒中(acute ischemic stroke,AIS)患者行机械取栓(mechanical thrombectomy,MT)术后临床结局的影响。方法:选择行MT治疗的AIS患者270例,根据估算肾小球滤过率(estimated glomerular filtration rate,eGFR)分为对照组(eGFR≥60 min/1.73 m2)165例和肾功能损害组(eGFR<60 mL/min/1.73 m2)105例,比较两组临床特征、症状性颅内出血(symptomatic intracerebral hemorrhage,sICH)发生率、血管再通程度和术后3个月改良RANKIN量表(mRS)评分,分析不良预后的危险因素。结果:肾功能损害组平均年龄78.6±8.6岁、冠心病占比28.6%、房颤病史占比53.3%、入院时NIHSS评分16(12~20)分,分别高于对照组的67.2±11.4岁、13.3%、30.3%和13(10~18)分,差异均有统计学意义(P<0.05)。肾功能损害组吸烟比例27.6%低于对照组的44.2%(P=0.007),发病到穿刺时间240(177~315)min短于對照组的255(197~361)min(P=0.042),sICH发生率19.1%高于对照组的9.7%(P=0.042),对照组术后3个月mRS评分2(1~4)分,优于肾功能损害组的5(2~6)分(P<0.001),差异均有统计学意义。多因素回归分析显示肾功能不全、糖尿病、较高的入院时NIHSS评分和梗死灶出血转化是不良预后的独立危险因素,OR分别为2.415(95%CI 1.252~4.661)、2.197(95%CI 1.033~4.670)、1.082(95%CI 1.035~1.132)和7.838(95%CI 2.540~24.184)。结论:肾功能损害是AIS患者MT治疗预后不良的独立危险因素。
[关键词] 肾功能;急性缺血性脑卒中;机械取栓;神经功能状况;血管再通程度
[中图分类号] R743.3 [文献标志码] B [DOI] 10.19767/j.cnki.32-1412.2023.06.013
急性缺血性脑卒中(acute ischemic stroke,AIS)是因脑供血动脉闭塞导致脑组织缺血坏死而引起的严重致死、致残性疾病[1],在我国发病率很高[2]。其中大血管闭塞型(large vessel occlusion,LVO)最为严重,机械取栓(mechanical thrombectomy,MT)可有效开通LVO闭塞血管,改善患者预后[3-4],近期研究证实大核心梗死区AIS患者也能通过MT获益[5]。并非所有AIS患者都能从MT中获益,一些合并基础疾病的患者可能由于并发症而预后不良,肾功能不全可能是导致不良预后的因素。静脉溶栓的AIS患者肾功能损害与更差的临床结局、更高的死亡率和更高的症状性颅内出血(symptomatic intracerebralhemorrhage,sICH)发生率相关[6]。有研究认为肾脏功能不全是MT治疗患者功能预后的独立预测因子[7]。本文回顾性分析我院神经内科2015年1月—2022年12月行MT治疗的AIS患者270例临床资料,评估肾功能损害对MT术后临床结局的影响。
1 资料与方法
1.1 一般资料 行MT治疗的AIS患者270例,根据入院肌酐水平估算肾小球滤过率(estimated glomerular filtration rate,eGFR),分为对照组(eGFR≥60 mL/min/1.73 m2)165例和肾功能损害组(eGFR<60 mL/ min/1.73 m2)105例。纳入标准:(1)年龄>18岁;(2)符合AIS诊断标准,经CT或MRI证实为前循环或后循环梗死,大血管闭塞。排除因病情危重、或存在血管内治疗禁忌证、家属拒绝等原因无法完成MT的患者。本研究经医院伦理委员会批准,并取得患者及授权委托人书面知情同意。
1.2 手术方式 所有患者手术指征评估、手术方式选择以及术后管理均按照中国急性缺血性脑卒中早期血管内介入诊疗指南[8]执行。符合静脉溶栓指征患者在血管内治疗前桥接静脉溶栓。患者入DSA室后经股动脉穿刺置入8F动脉鞘,5 min内完成脑血管造影。对责任血管使用8F导引导管或6F长鞘建立通路,通路建立后使用6F中间导管。首先尝试直接抽吸取栓(a direct aspiration first-pass thromobectomy,ADAPT),失败后进行抽吸联合支架取栓,对动脉粥样硬化性大血管闭塞患者首选支架取栓。取栓术后无法达到2b或3级再通患者,可采用各种补救措施,包括动脉溶栓、动脉内给予糖蛋白IIb/IIIa抑制剂、动脉血管成形及支架置入等方式。
1.3 临床结局评价 (1)术后3个月采用改良RANKIN量表(mRS)评价患者神经功能状况,评分范围0~6分,0分指完全无症状,6分指患者死亡。分数越高,预后越差,0~2分为预后良好。(2)术后血管再通程度:采用改良脑梗死溶栓分级(modified thrombolysis in cerebral infarction score,mTICI)评价血管再通程度,mTICI 2b级和3级定义为血管再通[9]。(3)术后24 h复查颅脑CT,观察有无sICH[10]。
1.4 统计学处理 应用SPSS 21.0统计学软件进行数据分析。符合正态分布的计量资料以x±s表示,组间比较采用t检验,非正态分布的计量资料以M(Q1,Q3)表示,组间比较采用秩和检验。计数资料以n(%)表示,组间比较采用χ2检验或Fisher精确检验。采用用二元Logistic回归分析影响预后的独立危险因素。P<0.05为差异有统计学意义。
2 结 果
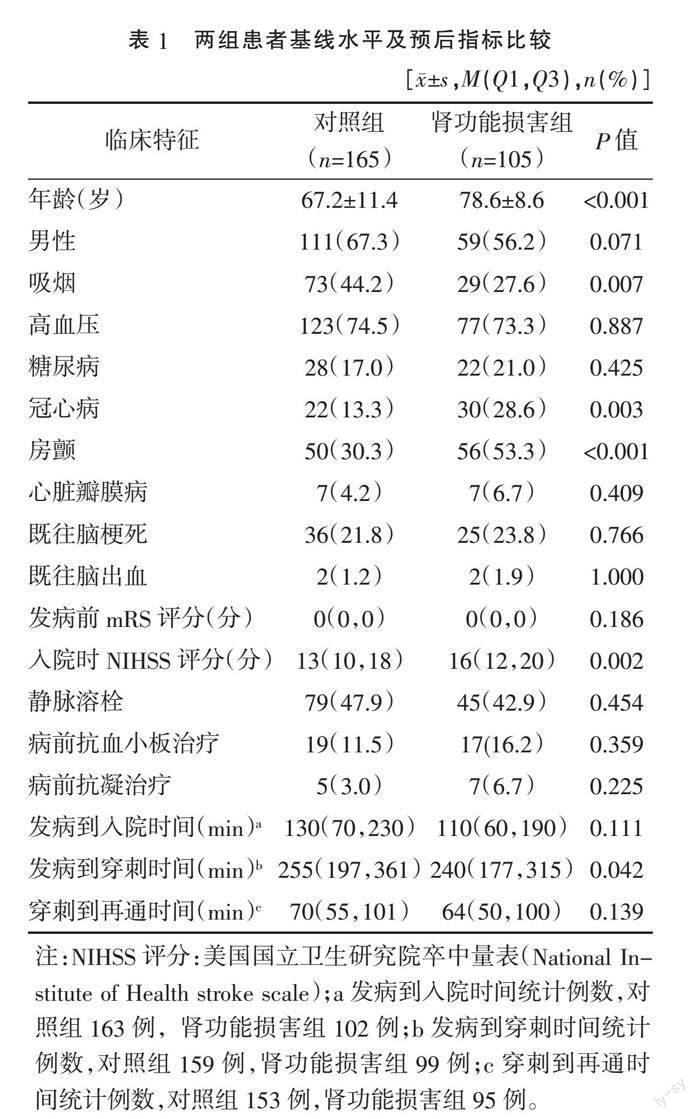
2.1 两组患者临床特征比较 肾功能损害组平均年龄78.6±8.6岁,冠心病占比28.6%,房颤病史占比53.3%,入院NIHSS评分16(12,20)分,分别高于对照组的67.2±11.4岁,13.3%,30.3%和13(10,18)分,肾功能损害组吸烟者占比27.6%低于对照组的44.2%,发病到穿刺时间240(177,315)min短于对照组的255(197,361)min,差异均有统计学意义(P<0.05)。见表1。
2.2 两组患者临床结局比较 肾功能损害组sICH发生率19.1%,高于对照组的9.7%,对照组术后3个月mRS评分2(1,4)分,优于肾功能损害组的5(2,6)分,差异均有统计学意义(P<0.05)。两组血管再通mTICI 2b~3级比较,差异无统计学意义(P>0.05)。见表2。
2.3 不良预后危险因素分析 根据术后3个月mRS评分,270例患者中121例为预后良好,149例为预后不良。单因素回归分析显示,术后3个月不良预后的危险因素为肾功能不全、高龄、吸烟、较高的入院时NIHSS评分、较短的发病到入院时间、较短的发病到穿刺时间及梗死灶出血转化。见表3。将P<0.1的因素纳入多因素回归中进一步分析,结果显示肾功能不全、糖尿病、较高的入院NIHSS评分和梗死灶出血转化是不良预后的独立危险因素,OR值分别为2.415(95%CI 1.252~4.661),2.197(95%CI 1.033~4.670),1.082(95%CI 1.035~1.132)和7.838(95%CI 2.540~24.184)。见表4。
3 讨 论
AIS患者肾功能不全患病率为23.9%~51.3%[11],肾功能损害不仅是心血管事件的独立危险因素[12-14],而且可导致AIS患者的不良预后[15-16]。本研究结果显示,肾功能损害组平均年龄78.6±8.6岁,冠心病占比28.6%,房颤病史占比53.3%,入院时NIHSS评分16(12,20)分,分别高于对照组的67.2±11.4岁,13.3%,30.3%和13(10~18)分,差异均有统计学意义(P<0.05)。提示合并肾功能损害患者往往年齡更大,更易合并冠心病和房颤,入院时NIHSS评分更高,这些因素可能共同导致不良预后。多因素回归分析显示,肾功能不全、糖尿病、较高的入院时NIHSS评分和梗死灶出血转化是不良预后的独立危险因素,OR值分别为2.415、2.197、1.082和7.838。
肾功能损害与AIS具有一些共同点,相似的解剖学和功能特征使得肾脏和大脑容易受到常见血管危险因素的影响[17-19]。一些对肾脏特异性危险因素,如慢性炎症、贫血、氧化应激等,会影响动脉壁和内皮,导致脑血管损伤。侧枝代偿是AIS良好预后的关键,软脑膜血管舒张能力是侧支代偿的潜在机制之一,而肾功能不全可损害内皮[20-21],进一步促进粥样硬化血管的狭窄和钙化[22-23],降低血管舒张能力。此外,肾功能不全患者内皮祖细胞数量减少,血管生成功能受损[24],进一步影响侧支血管生成。
虽然肾功能损害的AIS预后不良,但并不意味合并LVO的患者应拒绝MT治疗。由于LVO存在高致死率及高致残风险,大部分患者仍能从MT中获益。此外,MT患者在诊断和治疗中须使用造影剂,应注意造影剂的肾毒性,但有研究观察到合并肾功能损害的患者在MT后肾功能并未恶化,甚至部分患者出院时eGFR得到改善,这很可能是由于治疗相关的水化作用[25]。因此,对于合并肾功能损害的患者,经综合评估病情后可考虑进行MT治疗。
综上所述,肾功能损害影响AIS患者MT治疗的临床预后,是AIS患者MT治疗预后不良的独立危险因素。
[参考文献]
[1] GBD 2019 STROKE COLLABORATORS. Global,regional,and national burden of stroke and its risk factors,1990~2019:a systematic analysis for the Global Burden of Disease Study 2019[J]. Lancet Neurol,2021,20(10):795-820.
[2] WU S M,WU B,LIU M,et al. Stroke in China: advances and challenges in epidemiology,prevention,and management[J]. Lancet Neurol,2019,18(4):394-405.
[3] MITCHELLP J,YAN B,CHURILOV L,et al. Endovascular thrombectomy versus standard bridging thrombolytic with endovascular thrombectomy within 4·5 h of stroke onset: an open-label,blinded-endpoint,randomised non~inferiority trial[J]. Lancet,2022,400(10346):116-125.
[4] YANG P,SONG L,ZHANG Y,et al. Intensive blood pressure control after endovascular thrombectomy for acute ischaemic stroke (ENCHANTED2/MT):a multicentre,open-label,blinded-endpoint,randomised controlled trial[J]. Lancet,2022,400(10363):1585-1596.
[5] HUO X,MA G,TONG X,et al. Trial of endovascular therapy for acute ischemic stroke with large infarct[J]. N Engl J Med,2023,388(14):1272-1283.
[6] GENSICKE H,ZINKSTOK S M,ROOS Y B,et al. IV thrombolysis and renal function[J]. Neurology,2013,81(20):1780-1788.
[7] YAO Z,XU H,CHENG Y,et al. Relationship between estimated glomerular filtration rate and outcome of ischemic stroke patients after mechanical thrombectomy[J]. CNS Neurosci Ther,2021,27(11):1281-1288.
[8] 中華医学会神经病学分会,中华医学会神经病学分会脑血管病学组,中华医学会神经病学分会神经血管介入协作组,等. 中国急性缺血性脑卒中早期血管内介入诊疗指南2018[J]. 中华神经科杂志,2018,51(9):683-691.
[9] ZAIDAT O O,YOO A J,KHATRI P,et al. Recommendations on angiographic revascularization grading standards for acute ischemic stroke: a consensus statement[J]. Stroke,2013,44(9):2650-2663.
[10] HACKE W,KASTE M,FIESCHI C,et al. Randomised double-blind placebo-controlled trial of thrombolytic therapy with intravenous alteplase in acute ischaemic stroke (ECASS II). Second European~Australasian Acute Stroke Study Investigators[J]. Lancet,1998,352(9136):1245-1251.
[11] AGRAWAL V,RAI B,FELLOWS J,et al. In-hospital outcomes with thrombolytic therapy in patients with renal dysfunction presenting with acute ischaemic stroke[J]. Nephrol Dial Transplant,2010,25(4):1150-1157.
[12] LEE M,SAVER J L,CHANG K H,et al. Low glomerular filtration rate and risk of stroke: meta-analysis[J]. BMJ,2010,341:c4249.
[13] MATSUSHITA K,VANDER VELDE M,ASTORBC,et al. Association of estimated glomerular filtration rate and albuminuria with all-cause and cardiovascular mortality in general population cohorts: a collaborative meta~analysis[J]. Lancet,2010,375(9731):2073-2081.
[14] MASSON P,KOTWAL S,KELLYPJ,et al. Risk factors for stroke in people with end-stage kidney disease: acohort study[J]. Cerebrovasc Dis,2016,42(5/6):428-438.
[15] ROWAT A,GRAHAM C,DENNIS M. Renal dysfunction in stroke patients: a hospital~based cohort study and systematic review.International[J]. Int J Stroke,2014,9(5):633-639.
[16] SYNHAEVE N E,VAN ALEBEEK M E,ARNTZ R M,et al. Kidney Dysfunction Increases Mortality and Incident Events after Young Stroke: The FUTURE Study[J]. Cerebrovasc Dis,2016,42(3-4):224-231.
[17] MOGI M,HORIUCHI M. Clinical interaction between brain and kidney in small vessel disease[J]. Cardiol Res Pract,2011,2011:306189.
[18] TOYODA K,NINOMIYA T. Stroke and cerebrovascular diseases in patients with chronic kidney disease[J]. Lancet Neurol,2014,13(8):823-833.
[19] O′ROURKEM F,SAFARM E. Relationship between aortic stiffening and microvascular disease in brain and kidney: cause and logic of therapy[J]. Hypertension,2005,46(1):200-204.
[20] STAM F,VAN GULDENER C,BECKER A,et al. Endothelial dysfunction contributes to renal function-associated cardiovascular mortality in a population with mild renal insufficiency: the Hoorn study[J]. J Am Soc Nephrol,2006,
17(2):537-545.
[21] STAM F,VAN GULDENER C,SCHALKWIJK C G,et al. Impaired renal function is associated with markers of endothelial dysfunction and increased inflammatory activity[J]. Nephrol Dial Transplant,2003,18(5):892-898.
[22] KIM E D,TANAKA H,BALLEW S H,et al. Associations between kidney disease measures and regional pulse wave velocity in a large community-based cohort: the atherosclerosis risk in communities (ARIC) study[J]. Am J Kidney Dis,2018,72(5):682-690.
[23] REISS A B,MIYAWAKI N,MOON J,et al. CKD,arterial calcification,atherosclerosis and bone health: inter~relationships and controversies[J]. Atherosclerosis,2018,278:49-59.
[24] CHOI J H,KIM K L,HUH W,et al. Decreased number and impaired angiogenic function of endothelial progenitor cells in patients with chronic renal failure[J]. Arterioscler Thromb Vasc Biol,2004,24(7):1246-1252.
[25] POWER A,EPSTEIN D,COHEN D,et al. Renal impairment reduces the efficacy of thrombolytic therapy in acute ischemic stroke[J]. Cerebrovasc Dis,2013,35(1):45-52.
[收搞日期] 2023-04-01
(本文編辑 缪宏建)
