两亲性光敏剂五聚赖氨酸酞菁锌的抗菌机理
2018-10-11刘大锋陈静怡黄明东
刘大锋, 袁 彩, 陈静怡, 陈 卓, 黄明东,
(1.福建农林大学生命科学学院;2.中国科学院福建物质结构研究所结构化学国家重点实验室;3.福州大学化学学院,福建 福州 350002)
人们对抗生素的滥用,导致了耐药菌的出现,特别是“超级细菌”的出现,引起了全球的恐慌,寻找和研发新的抗菌药物已迫在眉睫[1,2].光动力抗菌疗法(photodynamic antibacterial chemotherapy, PACT)以具有杀菌速度快、多靶标性和不易产生耐药菌等优点,而成为一种新型的抗菌方法[3,4].PACT以光敏剂(photosensitizer, PS)、光源和氧为基本要素[2,4].在光照下,PS吸收光子能量,并将其传递给氧分子,发生光氧化反应,通过Ⅰ型和Ⅱ型两种反应机制而产生活性氧(reactive oxygen species, ROS)[5-7].活性氧与细胞生物膜、大分子物质(蛋白质、脂质和核酸等)和各种亚细胞器等细胞物质发生反应,从而引起细菌坏死或凋亡[4-9].PACT在一些牛皮癣和硬皮病等局部感染区逐步得到了应用,但PACT仍然不是现阶段主要的治疗手段,抗菌光敏剂的开发依然如火如荼.
抗菌光敏剂的开发受制于对光敏剂抗菌机理的研究,例如光敏剂如何影响菌体表面电荷,损伤菌体壁,被菌体吸附的速度和定量等.对于这些机理的探索能够为光敏剂的发展提供指导.本研究测定了一种新型光敏剂ZnPc(Lys)5的抗菌机理,及其分别与过氧化氢(H2O2)和聚六亚甲基双胍盐酸盐(polyhexamethylene biguanidine hydrochloride, PHMB)的联合抗菌效果.试验结果表明,该光敏剂能中和菌体表面负电荷而且破坏菌体壁.
1 材料与方法
1.1 材料
菌株:大肠杆菌(ATCC25922)和金黄色葡萄球菌(ATCC6538).
培养基:LB培养基.
试剂:氨苄霉素(碧云天生物技术公司),卡那霉素(碧云天生物技术公司),聚六亚甲基双胍盐酸盐(PHMB, BEPHARM),过氧化氢(H2O2,西陇科学股份有限公司),流式细胞仪(BECKMANCOULTER),8-苯胺基-1-萘磺酸(ANS, Aladdin).
仪器:酶标仪(BioTek, USA),24孔LED平面红光光源(波长660 nm±25 nm,光剂量为2.55 J·cm-2·min-1).
1.2 光敏剂的合成与表征
光敏剂ZnPc(Lys)5的合成、纯化和特性表征的方法参考本课题组的文献[3,10-12].
1.3 细菌对光敏剂吸附动力学的测定
使用流式细胞仪荧光通道(APC-A750-A, ex=638 nm, em=780 nm±60 nm),测定菌体对光敏剂的吸附动力学曲线[13].分别向大肠杆菌和金黄色葡萄球菌(108CFU·mL-1)液中加入光敏剂(1 μmol·L-1)后,离心、洗涤,重悬稀释50倍,用FSC-SSC使丢弃率小于2%.再利用SSC-H和APC-A750-A每隔30 s检测荧光信号1次.所有试验均设置3个独立的平行组.
1.4 抗菌活性的测定
采用试管二倍稀释法,用LB培养液梯度稀释光敏剂,测定其抑制细菌生长时的最低抑菌浓度(minimal inhibitory concentration, MIC)[14-16],分别稀释为125~0.122 μg·mL-1的一系列梯度浓度.取900 μL含光敏剂的LB培养液,分别加入菌液100 μL(终浓度为2.34×106CFU·mL-1),以不加菌液和无光敏剂为阴性对照组,以加菌液而无光敏剂为阳性对照.在洗涤组,洗去溶液中未被菌体吸附的光敏剂;在未洗涤组,不做洗涤处理.各组均设置3个平行试验,孵育,光照(5 min,12.75 J·cm-2),37 ℃条件下培养16~18 h观察有无菌体生长.在抗生素抑制细菌生长的组,方法如上,没有光照.以能够完全抑制细菌生长的最低抑菌光敏剂浓度为MIC.
1.5 生长曲线的测定
分别向生长至对数期的大肠杆菌和金黄色葡萄球菌溶液中(终浓度为2.34×106CFU·mL-1)加入不同浓度的光敏剂(终浓度分别为1/8、1/4、1/2和1倍的MIC浓度),以不加光敏剂的菌液为对照组.各组均设置3个平行试验,孵育,光照(5 min,12.75 J·cm-2),37 ℃和150 r·min-1条件下培养,每隔1 h测定600 nm处光密度(D)值1次,每次取100 μL菌液,连续测定12 h[10].
1.6 细菌对光敏剂吸附量的测定
菌液(108CFU·mL-1)经PBS洗涤和重悬后,与不同浓度的光敏剂(0.2、0.4、0.8、1.6和3.2 μmol·L-1)孵育后,洗去溶液中未被菌体吸附的光敏剂,于裂解液(0.1 mol·L-1NaOH/1% SDS)中裂解60 min[3,10,11].测定裂解后溶液的荧光值(ex=610 nm, em=680 nm).所有试验都设置3个独立的平行组.以光敏剂完全裂解的已知浓度与荧光值间的关系制定标准曲线,测定结果以每个细菌吸附光敏剂的分子个数表示.
1.7 电动电位测定
菌液(108CFU·mL-1)经1mmol·L-1KNO3(pH 6.2)洗涤和重悬后,与不同浓度的光敏剂(0、2、4、8和12 μmol·L-1)孵育,洗去溶液中未被吸附的光敏剂,得含有光敏剂的菌液1 mL后,即刻在室温下测定菌体表面的电动电位[17,18],每组试验共有10个平行组.
1.8 细菌细胞壁受光敏剂影响的测定
用PBS将生长至对数期细菌洗涤,并重悬至D600 nm=0.1~0.3后,与不同浓度光敏剂(0.4、0.8、1.2、1.6、2.0、2.4、2.8、3.2、3.6和4.0 μmol·L-1)混匀并孵育.对照组、光照组和暗处理组均加入终浓度为5.65 mmol·L-1的荧光探针8-苯胺基-1-萘磺酸(ANS).在光照组里,光照(5 min, 12.75 J·cm-2)后加入ANS;在暗处理组,加入ANS和光敏剂,而仅无光照;在对照组里,无光照无光敏剂.每组都有3个独立的平行试验.连续测定ANS荧光值(ex=380 nm, em=520 nm)至稳定.
1.9 单用抗菌剂时最低抑菌浓度的测定
采用试管二倍稀释法,用LB培养液梯度稀释抗菌药物.对于光敏剂分别稀释为125~0.122 μg·mL-1的系列梯度浓度;对于H2O2分别稀释为2.6 g·L-1至5.1 μg·mL-1;对于PHMB分别稀释为125~0.122 μg·mL-1的系列梯度浓度.测定方法同1.4试验部分,以能够完全抑制细菌生长的最低药物浓度为其MIC[14-16,19].
1.10 抗菌剂联合抑菌效果的评价
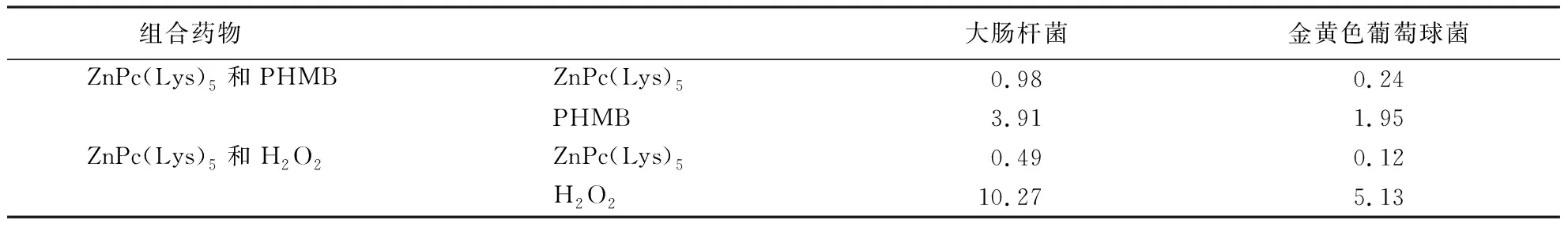
在96微孔板中,采用微量稀释法测定光敏剂和PHMB对细菌的联合抑菌效果,向微孔中分别依次加入50 μL光敏剂和50 μL PHMB,保持从上至下每一横行PHMB浓度分别为16 MIC、8 MIC、4 MIC、2 MIC、1 MIC、1/2 MIC、1/4 MIC、1/8 MIC;从左至右每一纵列光敏剂浓度分别为16 MIC、8 MIC、4 MIC、2 MIC、1 MIC、1/2 MIC、1/4 MIC、1/8 MIC,向每一微孔中加入菌液100 μL(终浓度为2.34×106CFU·mL-1).以不加菌液、PHMB和光敏剂为阴性对照;以加菌液而不加光敏剂和PHMB为阳性对照,各组试验均重复5次.混匀,孵育,光照(5 min,12.75 J·cm-2),于37 ℃条件下培养16~18 h观察结果,分别检测光敏剂和PHMB对大肠杆菌或金黄色葡萄球菌的最低联合抑菌浓度,以能够完全抑制细菌生长的最低联合用药浓度为其联合MIC.联合抑菌的部分抑菌浓度(fractional inhibitory concentration, FIC)的效果评价:FIC=MIC甲药联用/MIC甲药单用+MIC乙药联用/MIC乙药单用.判断两抗菌剂联合抑菌效果的标准为:FIC≤0.5时,具有协同作用;0.5 所有试验至少有3个平行组,所得数据使用mean±SD方法处理,且使用Origin 8.5和Microsoft Excel 2013软件处理.利用软件DPS v7.0和SPSS 19.0做差异显著性分析,P<0.05表示显著相关性,P<0.01表示极显著相关性. 光敏剂ZnPc(Lys)5分子因有1条五聚赖氨酸链(图1a),而在中性溶液中带有5个正电荷,利用反相柱C18高效液相色谱纯化,由100% MeOH/TFA所筛选,得到高纯度的光敏剂(图1b)[12].在DMSO溶液中,该光敏剂的UV/Vis吸收波普在678 nm处有1条Q带,而在610 nm处有一条弱带(图1c)[3].光敏剂单线态氧的量子产率值为0.63±0.02[12]. a:分子结构;b:在C18 HPLC反向柱中纯化(纯度>95%);c:1 μmol·L-1 ZnPc(Lys)5在DMSO溶液中的UV/Vis吸收波普.图1 ZnPc(Lys)5的表征Fig.1 Characteristics of ZnPc(Lys)5 P<0.01具有极显著相关性.图2 细菌对光敏剂ZnPc(Lys)5的吸附动力学曲线Fig.2 Binding kinetics of ZnPc(Lys)5 on bacteria 由细菌对ZnPc(Lys)5的吸附动力学曲线(图2)发现:大肠杆菌在第3 min时即可达到对光敏剂的饱和吸附,而金黄色葡萄球菌却在第5.5 min达到对光敏剂的饱和吸附(图2).因此,与金黄色葡萄球菌相比,大肠杆菌对该光敏剂的吸附速率更快.在以下试验中,ZnPc(Lys)5与大肠杆菌和金黄色葡萄球菌的孵育时间分别是3.0和5.5 min,以达到对该光敏剂的饱和吸附效果. 通过对光敏剂抑制菌体生长时MIC值的测定,来检测光敏剂抗菌活力的大小.向菌液中加入不同浓度的光敏剂,孵育,在洗涤组,洗去未被菌体吸附中的光敏剂;在非洗涤组,保留未被吸附的光敏剂.经光照后,温育培养.在洗涤组中,光敏剂抑制大肠杆菌和金黄色葡萄球菌生长的MIC值分别为25.31和6.33 μmol·L-1,在非洗涤组,MIC值分别为1.58和0.79 μmol·L-1.而对于抗生素抑制细菌生长组,氨苄霉素抑制金黄色葡萄球菌和大肠杆菌生长时的MIC值分别为7.57和484.65 μmol·L-1,卡那霉素对金黄色葡萄球菌和金大肠杆菌生长抑制的MIC值分别为201.13和201.13 μmol·L-1.结果表明,与抗生素相比,光敏剂对细菌生长时的抑制能力更强.此外,与未洗涤组相比,洗涤组光敏剂抑制细菌生长时的MIC值明显增大,其原因可能是:(1)溶液中的光敏剂而后又被吸附到菌体表面;(2)活性氧在菌体表面破坏而产生一些孔洞,被菌体吸附或未被菌体吸附的光敏剂通过这些空洞进入细菌内部,造成对细菌更大的损伤作用. 测定没有光敏剂和含有不同浓度光敏剂菌液的D600 nm值,比较细菌的生长曲线.向菌液中加入不同浓度的光敏剂,孵育,光照,每隔1 h取100 μL菌液测定.结果显示:抑制细菌的生长曲线具有光敏剂的浓度依赖性(图3).对于大肠杆菌和金黄色葡萄球菌,在相同的时间时,随着光敏剂浓度的增加(从0至1倍的MIC),测得的D600 nm值减小.并且与光敏剂浓度1/8 MIC和1/4 MIC、1/4 MIC和1/2 MIC的D600 nm之间的差值相比较,没有光敏剂和光敏剂浓度1/8 MIC、浓度1/2 MIC和MIC时的差值更大,表明光敏剂五聚赖氨酸酞菁锌具有理想的抗菌效果. a:金黄色葡萄球菌;b:大肠杆菌.P<0.01具有极显著相关性.图3 不同浓度光敏剂处理时细菌的生长曲线Fig.3 S.aureus (a) and E.coli (b) growth curve at different concentrations of PS P<0.05具有显著相关性.图4 细菌对ZnPc(Lys)5的吸附Fig.4 Adsorption of ZnPc (Lys) 5 by bacteria P<0.05具有显著相关性.图5 ZnPc(Lys)5在洗涤之后对菌体表面电动电位的影响Fig.5 ZnPc (Lys)5 influence on the electric potential of the bacteria after washing 向菌液中加入不同浓度光敏剂,温育,洗涤,裂解于0.1 mol·L-1NaOH/1% SDS中60 min后,测定每个细菌吸附光敏剂分子数.试验结果显示:随着光敏剂浓度从0.20 μmol·L-1增加到3.16 μmol·L-1,每个细菌所吸附的光敏剂数量也逐步增加(图4).每个金黄色葡萄球菌所吸附的光敏剂分子数从(0.64±0.05)×105个升至(8.66±0.44)×105个;而对于大肠杆菌,光敏剂的分子数则从(0.41±0.05)×105个升至(5.36±0.21)×105个.试验结果表明:在光敏剂浓度相同时,对于每个细菌而言,金黄色葡萄球菌吸附的光敏剂分子数量比大肠杆菌的多.可能因为,与大肠杆菌表面的脂多糖相比,金黄色葡萄球菌表面的磷壁酸具有更多的负电荷数量,从而能够吸附更多带有正电荷的光敏剂分子.试验结果与光敏剂抗菌活性的测定结果相符合,也与陈卓等的试验结果(每个金黄色葡萄球菌吸附大约105个光敏剂分子)相一致[3]. 在中性溶液中,菌体表面带有负电荷,而1个ZnPc(Lys)5分子则带有5个正电荷,因此可以通过静电作用而被吸附到菌体表面.菌液(108CFU·mL-1)与不同浓度光敏剂混匀,孵育,洗涤,测定菌液的电动电位.结果显示:没有加入光敏剂时,大肠杆菌和金黄色葡萄球菌表面的电荷量分别为(-32.93±1.02)和(-28.3±0.51) mV;随着光敏剂浓度的增加,大肠杆菌和金黄色葡萄球菌表面的电荷数也逐步增大(图5).因而,结果表明,光敏剂能有效地中和菌体表面的负电荷数,此结果与细菌对光敏剂吸附量的试验结果相吻合. 借助荧光探针8-苯胺基-1-萘磺酸(ANS)测定菌体壁的受损程度.ANS的荧光在水溶液中被猝灭,而在疏水环境中则表现出较强的荧光强度(ex=380 nm, em=520 nm).当菌体的细胞壁受损后,荧光探针ANS会进入细胞膜磷脂双分子层的疏水环境中,而表现出荧光增大的现象.向菌液中加入不同浓度的光敏剂后,再加入ANS荧光探针,孵育.在光照组,需要光照后,再加入ANS,以避免其被活性氧所破坏而导致荧光降低.通过荧光值的测定,试验结果表明:随着PS浓度从0.40至4.00 μmol·L-1的升高,在光照组的荧光值也逐步增大.对于金黄色葡萄球菌,荧光值从1 173 a.u.±23 a.u.逐步升高到2 279 a.u.±31 a.u.;而对于大肠杆菌,荧光值则由1554 a.u.±35 a.u.升高到2587 a.u.±67 a.u.(图6).研究结果显示随着光敏剂浓度的增加,细菌细胞壁的受损程度也增加. P<0.01具有极显著相关性.图6 在光照时,ZnPc(Lys)5对金黄色葡萄球菌(a)和大肠杆菌(b)细胞壁的影响Fig.6 Effect of ZnPc (Lys)5 on the cell wall of S.aureus (a) and E.coli (b) during illumination 在抗菌剂单用时,H2O2和PHMB抑制大肠杆菌生长的MIC值分别为41.07 和7.81 μg·mL-1;抑制金黄色葡萄球菌生长的MIC值分别为20.54和7.80 μg·mL-1.与阳性菌株(金黄色葡萄球菌)相比,阴性菌株(大肠杆菌)具有由肽聚糖组成的外膜,而此外膜可减少抗菌药物对细菌的伤害.因此,大肠杆菌比金黄色葡萄球菌对抗菌剂表现出更强的耐药性. 因为ZnPc(Lys)5带有正电荷,且是借助ROS达到杀菌目的,所以评价光敏剂分别与H2O2和PHMB的联合抗菌效果,以确定活性氧或正电荷在PS抗菌中的分别作用.测得光敏剂分别与H2O2或PHMB的联合抗菌作用结果(表1),发现光敏剂和PHMB对大肠杆菌的最低联合抑菌浓度分别是0.98和3.91 μg·mL-1,对金黄色葡萄球菌的最低抑菌浓度分别是0.24和1.95 μg·mL-1(表1).从而可知,对于大肠杆菌,1≤FIC=1<2,光敏剂和PHMB表现出相加抗菌作用;对于金黄色葡萄球菌,FIC=0.5≤0.5,光敏剂和PHMB表现出协同抗菌作用.结果表明正电荷的引入没有促进光敏剂对大肠杆菌的抑制作用,却促进了对金黄色葡萄球菌的抑制作用. 表1 药物最低联合抑菌浓度Table 1 Minimum combined bacteriostasis of the drugs μg·mL-1 同理可知,对于大肠杆菌和金黄色葡萄球菌,光敏剂和H2O2均表现出协同抗菌作用,因而H2O2能够增强光敏剂对大肠杆菌和金黄色葡萄球菌的抑制生长作用. 本研究表明,随着光敏剂浓度的增加,菌体对光敏剂的吸附量增大,菌体表面的电动电位也增大,从而对菌体壁的破坏程度也逐步增加.通过对联合抗菌效果的评价,H2O2与光敏剂具有协同抗菌作用;PHMB和光敏剂金黄色葡萄球菌具有协同抗菌效果,而对大肠杆菌具有相加抗菌效果. 在ZnPc(Lys)5的杀菌过程中,通过静电作用被吸附到菌体表面.光敏剂经光照后产生ROS,在细菌表面破坏细胞壁和细胞膜,可能会破坏菌体表面而形成一些孔洞;此外,光敏剂也可能穿过这些孔洞,进入细菌内部,从而增强了对细菌的灭活作用. 根据文献报道PHMB因富含正电荷而具有高度表面活性作用,易通过静电吸附作用而粘附于带有负电荷的细菌表面,损伤细菌细胞膜,改变细菌渗透性,最终使细菌破裂而死亡.在PHMB和ZnPc(Lys)5的联合抑菌中,对大肠杆菌具有相加抗菌作用,而对金黄色葡萄球菌具有协同抗菌作用.因生物膜具有流动性,所以大肠杆菌的外膜的可能会使ZnPc(Lys)5分子快速地进入或者通过外膜,与PHMB不能相互影响抗菌效果,使ZnPc(Lys)5和PHMB相互独立地发挥抑菌作用[21,22],从而表现出对大肠杆菌的相加抗菌效果.金黄色葡萄球菌的细胞壁较厚(15~80 nm)[23],使得ZnPc(Lys)5和PHMB可能都聚集在菌体表面[24],发挥协同的抗菌作用[20-22].1.11 数据处理
2 结果与分析
2.1 ZnPc(Lys)5合成与表征结果

2.2 细菌对光敏剂吸附动力学结果
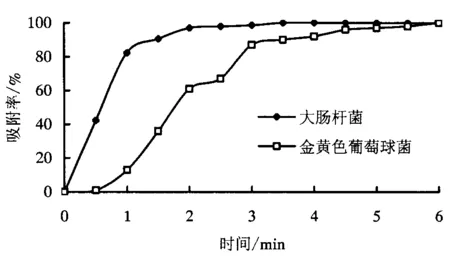
2.3 抗菌活性结果
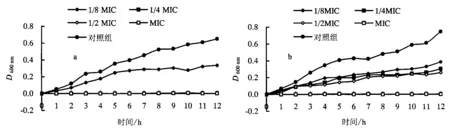
2.4 生长曲线测定的结果
2.5 不同细菌对光敏剂的吸附量

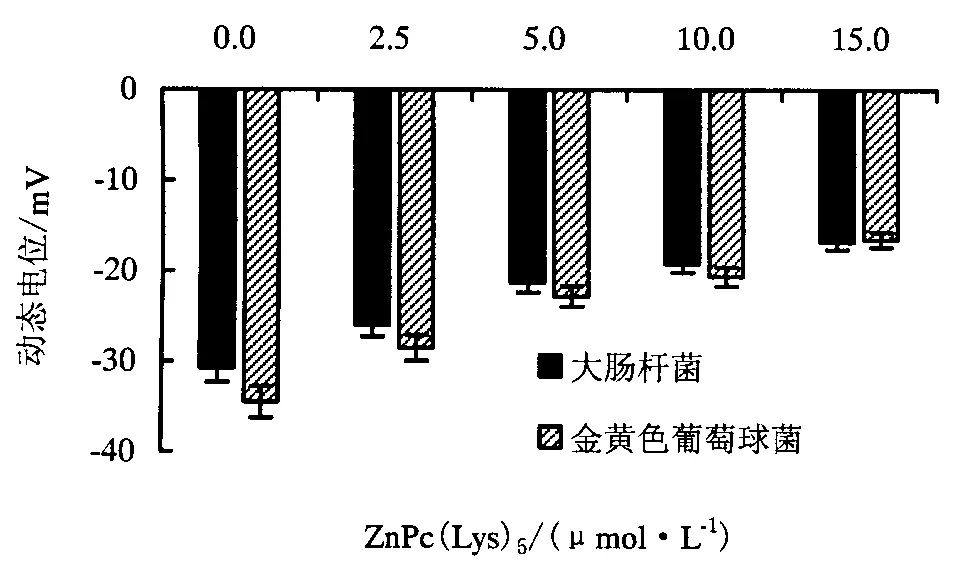
2.6 光敏剂增加细菌表面正电荷
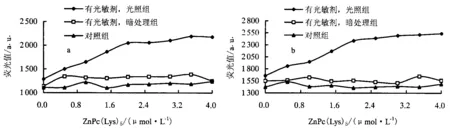
2.7 光敏剂对菌体细胞壁的影响
2.8 抗菌剂单用测定结果
2.9 抗菌剂联合抑菌测定结果
3 讨论
