美人蕉黄条病毒扬州、长沙分离物全基因组的测定与序列分析
2023-03-13董玲霞孙厚俊
朱 晨,唐 伟,阴 筱,董玲霞,孙厚俊
(1.江苏徐淮地区徐州农业科学研究所/农业农村部甘薯生物学与遗传育种重点实验室,江苏 徐州 221131;2.山东省农业科学院湿地农业与生态研究所,济南 250100)
【研究意义】美人蕉(CannaindicaL.)属于美人蕉科(Cannaceae)美人蕉属(Canna),是起源于中美洲和南美洲等热带地区的单子叶多年生草本植物[1]。美人蕉适应性强,栽培管理便利,在世界各地均有栽种,主要用作观赏植物。在南美和东南亚,美人蕉根茎还被用于食品加工[1-2]。目前,美人蕉在我国常用做园林绿化植物,在各地广泛种植[3]。近年研究发现,美人蕉含有黄酮类、异戊二烯聚合物、生物碱、蛋白质、糖苷、皂苷、单宁等物质,具有较高药用价值[4]。美人蕉病毒病是美人蕉的一种重要病害,可导致美人蕉出现条纹状花叶、坏死等症状,严重影响美人蕉的商品属性和观赏价值。因此,诊断侵染美人蕉的病毒种类,分析病毒序列特征,明确病毒进化关系,对我国美人蕉病毒病害防控研究具有重要意义。【前人研究进展】目前,全世界已报道侵染美人蕉的病毒共有6种,分别是美人蕉黄斑驳病毒(Canna yellow mottle virus, CaYMV)[5]、菜豆黄花叶病毒(Bean yellow mosaic virus, BYMV)[6]、黄瓜花叶病毒(Cucumber mosaic virus, CMV)[7]、甘蔗花叶病毒(Sugarcane mosaic virus, SCMV)[8]、番茄不孕病毒(Tomato aspermy virus, TAV)[9]和美人蕉黄条病毒(Canna yellow streak virus, CaYSV)[10]。其中CaYSV是马铃薯Y病毒属(Potyvirus)成员,可以通过蚜虫进行非持久性传播,也可以通过机械摩擦进行传播[1]。在实验室接种环境下,CaYSV也可以侵染本氏烟(Nicotianabenthamiana)、昆诺阿藜(Chenopodiumquinoa)和四季豆(Phaseolusvulgaris)[1]。由于美人蕉主要通过根茎扦插等营养手段进行无性繁殖,随着商品流通性不断加快,使得CaYSV的发病和扩散能力具有更大威胁。目前,CaYSV已在英国、美国、以色列、俄罗斯等不同国家的美人蕉品种中被发现[10]。【本研究切入点】前期对CaYSV的研究大多数集中在国外,国内仅对CaYSV的检测技术有报道[11],但对CaYSV基因组序列特征、遗传进化及重组分析研究未见报道。【拟解决的关键问题】利用RT-PCR和RACE技术对扬州和长沙2个地区美人蕉上CaYSV全基因组序列进行扩增,并通过MegAlign、Mega11和RDP5软件解析我国CaYSV病毒序列特征、遗传进化及重组事件,为该病毒的防控提供指导和理论依据。
1 材料与方法
1.1 试验材料
美人蕉叶片样品采自江苏省扬州市、湖南省长沙市,其症状表现为条纹状花叶,采集后置于-80 ℃保存备用。
1.2 RNA提取及病原分子鉴定
取美人蕉病叶100 mg,用液氮研磨,参照MiniBEST Universal RNA Extraction Kit(南京诺唯赞生物科技股份有限公司)说明书提取RNA,溶解后于-80 ℃保存。以美人蕉总RNA为模板,利用M4T为引物进行反转录,再参照陈炯等[12]报道的方法进行PCR扩增。扩增产物回收、克隆后,送生工生物工程(上海)股份有限公司测序,测序结果使用NCBI网站BLAST进行比对。
1.3 CaYSV全基因组引物设计及RT-PCR扩增
根据从GenBank下载的12个CaYSV全基因组序列设计引物(表1),并以CaYSV-3R为引物进行反转录,得到新cDNA后进行扩增。25 μL扩增体系:10×Buffer(Mg2+plus)2.50 μL、2.50 mmol dNTP 1.00 μL、正反向引物各1.00 μL、cDNA 1.00 μL、DNA 聚合酶 0.25 μL、ddH2O 18.25 μL。反应程序:94 ℃预变性3 min;94 ℃变性30 s,退火30 s,72 ℃延伸1 min,30个循环;72 ℃延伸10 min,4 ℃保存。5′-race扩增,分别设计5′-race引物CaYSV-in和CaYSV-out,具体实验操作参照Scotto-Lavino等的方法[13]。

表1 CaYSV扩增引物
1.4 序列分析
RT-PCR产物经1%琼脂糖凝胶电泳检测,用DNA凝胶回收试剂盒(北京百泰克生物技术有限公司)回收目的片段,克隆、测序后经DNASTAR软件拼接。通过MegAlign软件Clustal W方法比对不同分离物全基因组核苷酸序列和多聚蛋白氨基酸序列的一致率。以BYMV和SCMV为外组,根据全基因组核苷酸序列和CP蛋白氨基酸序列分别通过Mega 11软件利用极大似然法(Maximum likelihood, ML)构建系统进化树,Bootstrap检验1000次[14]。
1.5 重组分析
利用RDP 5软件包中RDP、GENECONV、Boot Scan、MaxChi、Chimaera、3Seq和SiScan 7个软件对CaYSV全基因组序列进行重组检测[15]。
2 结果与分析
2.1 美人蕉疑似病样的症状
在江苏省扬州市、湖南省长沙市采集感病美人蕉叶片,病株均表现出叶脉黄化、脉间条纹状褪绿症状(图1)。
2.2 CaYSV分子鉴定及全基因组克隆与结构分析
提取江苏扬州和湖南长沙美人蕉病样的总RNA,利用M4T引物分别进行反转录,采用陈炯等[12]的方法进行扩增,获得1.8 kb目的条带,测序结果经NCBI BLAST比对发现扬州和长沙美人蕉病样分离物的序列与CaYSV分离物KS一致率最高,分别达99.3%和99.5%。
采用分段克隆和RACE方法对扬州分离物和长沙分离物全基因组序列进行克隆,分别获得大小为3814、4119和1697 bp目的条带和约330 bp RACE条带。利用DNASTAR对所得片段进行拼接,获得CaYSV扬州分离物和长沙分离物全基因序列,二者全基因组序列长度均为9501 nt,其中5’UTR均为153 nt,3’UTR均为225 nt(GenBank登录号分别为OQ 627371和OQ 627372)。CaYSV全基因组包含1个9123 nt的开放阅读框(Open reading fragment, ORF),编码3040个氨基酸的多聚蛋白,通过水解酶酶切形成10个成熟蛋白,分别为P1、HC-Pro、P3、6K1、CI、6K2、VPg、NIa-Pro、NIb和CP,其中NIb具有RdRp功能;9个酶切位点推定为Y/A、G/G、Q/K、Q/G、E/T、Q/A、E/G、E/D、Q/A,在P3中存在由G1A6移码产生的PIPO蛋白(图2)。
通过MegAlign软件Clustal W比对不同分离物之间核苷酸和氨基酸一致率,结果发现CaYSV扬州分离物和长沙分离物与其他分离物全基因组核苷酸一致率分别在93.9%~99.4%和94.0%~99.5%,其中扬州分离物与长沙分离物一致率最高,而长沙分离物与俄罗斯分离物KS一致率最高(图3-a)。CaYSV扬州分离物和长沙分离物与其他分离物多聚蛋白氨基酸一致率分别在95.1%~99.2%和95.7%~99.7%,扬州分离物和长沙分离物均与俄罗斯分离物KS一致率最高(图3-b)。
2.3 CaYSV系统进化分析
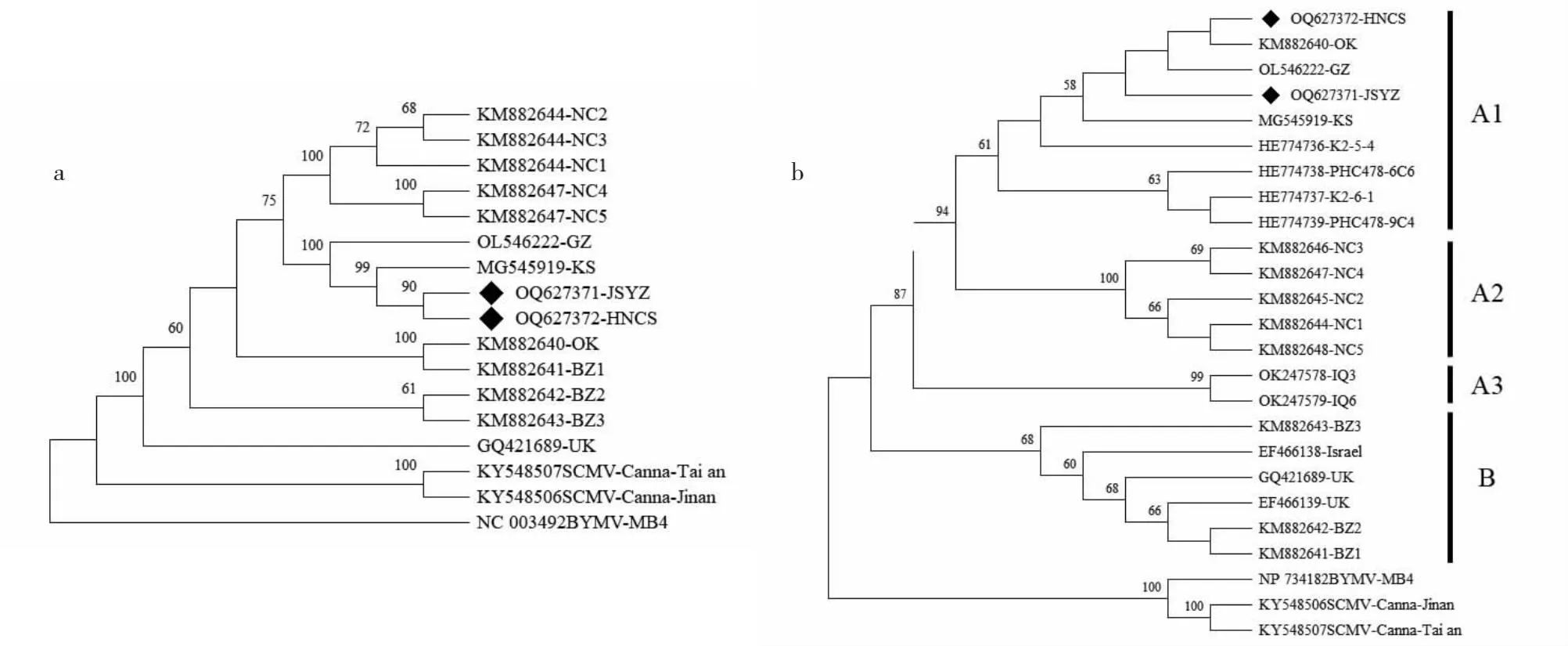
利用MEGA 11中ML法,根据CaYSV全基因组核苷酸序列构建系统发育树。扬州分离物(OQ627371-JSYZ)和长沙分离物(OQ627372-HNCS)关系最接近,与俄罗斯分离物KS(MG545919-KS)和贵州分离物GZ(OL546222-GZ)聚类到同一分支(图4-a)。根据CaYSV的CP蛋白氨基酸序列进行系统进化分析,发现CaYSV可以分为A和B 2个大组,其中A组又可以划分为3个亚组,扬州分离物和长沙分离物均聚类到A1亚组(图4-b),说明扬州分离物和长沙分离物与CaYSV分离物OK、KS、K2、PHC478遗传关系较近。
2.4 CaYSVCP蛋白氨基酸序列分析
Ali和Mamoori等[20]研究发现CaYSV不同分组中丝氨酸和苏氨酸存在不同的特征类型。对CaYSV CP蛋白N-端氨基酸进行序列比对,发现扬州分离物和长沙分离物第22、23、34、36、50位为丝氨酸,第2、26、29、35、58、60、65位为苏氨酸(图5)。其中基序S34TS36与A1亚组分离物OK、GZ、KS、DSMZ、K2-5-4一致,但与A1亚组K2-6-1、PHC478-6C6、PHC478-9C4的基序N34TS36不一致,说明扬州分离物和长沙分离物CaYSV CP蛋白N-端丝氨酸和苏氨酸变化与A1亚组基本一致,但A1亚组中也存在不同氨基酸的分化。
菱形表示本研究中获得的分离物。The rhombus represents the isolate obtained in the study.

位点已标记。The positions are pointed out.
2.5 CaYSV扬州分离物和长沙分离物重组分析
通过RDP5软件中的7个程序(RDP、GENECONV、Bootscan、MaxChi、Chimaera、SiScan和3Seq)对CaYSV扬州分离物和长沙分离物进行重组分析,发现RDP5软件的7个程序均支撑CaYSV扬州分离物和长沙分离物重组事件的发生,其中Chimaera算法的P值最大,为4.063×10-17(表2),主要亲本序列均为分离物UK(GQ421689),说明CaYSV扬州分离物和长沙分离物中均存在1个重组事件,重组位点分别为NIb(7891)和NIb(8015)。
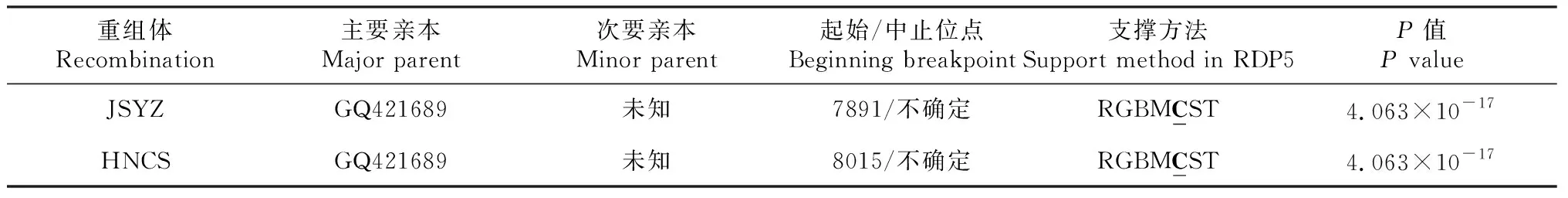
表2 CaYSV扬州分离物和长沙分离物重组事件分析
3 讨 论
通过RT-PCR和RACE方法获得病毒全基因组序列已在植物RNA病毒上广泛应用,利用该方法Tang等[16]获得SCMV SO株系的全基因组序列,Imamura等[17]获得火百合花叶病毒(Vallota mosaic virus, ValMV)的全基因组序列,王廿等[18]获得草莓镶脉病毒(Strawberry vein banding virus,SVBV)贵州分离物的全基因组序列,谢丽雪等[19]获得东亚西番莲病毒(East asian passiflora virus, EAPV)的全基因组序列。本研究采集江苏扬州和湖南长沙的美人蕉叶片样品,获得CaYSV病毒的扬州分离物和长沙分离物的基因组全长序列。序列比对结果表明,扬州分离物与长沙分离物一致率最高为99.4%,而长沙分离物与俄罗斯KS分离物一致率最高为99.5%。根据CP蛋白氨基酸序列将CaYSV分为A和B 2个组,其中A组可分为3个亚组,A1亚组主要包含美洲和东亚及东南亚地区分离物,A2亚组为美国NC1~NC5分离物,A3亚组为中东伊拉克分离物,B组为美国和欧洲分离物,上述结果与Chauhan等、Ali等报道一致[1,20],说明不同分组可能具有地域性,中国分离物与邻近国家分离物的亲缘关系较近。
CP蛋白作为病毒的组成蛋白,受到更多的自然选择压力,导致CP蛋白氨基酸序列发生改变。如辣椒轻斑驳病毒(Pepper mild mottle virus, PMMoV)CP蛋白氨基酸变化克服辣椒L4基因型的抗性[21],SCMV玉米分离物和甘蔗分离物CP蛋白氨基酸的变化具有寄主依赖性[22]。CaYSV的CP蛋白共有287个氨基酸组成,其N端丝氨酸和苏氨酸的变化有助于该病毒组和亚组的划分[1]。扬州分离物和长沙分离物CaYSV CP蛋白N-端丝氨酸和苏氨酸变化与A1组基本一致。
重组是推动RNA病毒变异进化的主要动力之一,在多种马铃薯Y病毒属病毒中均有发现[23],在对烟草脉带花叶病毒(Tobacco vein banding mosaic virus, TVBMV)[24]、甘薯羽状斑驳病毒(Sweet potato feathery mottle virus, SPFMV)[25]、油桃茎痘相关病毒(Nectarine stem-pitting-associated virus, NSPaV)[26]等病毒重组研究印证这点。前期发现CaYSV美国分离物BZ2、BZ3和OK存在重组事件[27],本研究发现,CaYMV中国江苏扬州和长沙分离物也均存在重组事件,重组位点分别为NIb(7891)和NIb(8015),而该重组位点在英国分离物UK中也有报道[27]。
4 结 论
CaYSV存在于我国江苏扬州和湖南长沙的美人蕉上。根据CaYSV的CP蛋白氨基酸构建系统进化树,扬州分离物和长沙分离物聚类到A1亚组,与泰国分离物K2、PHC478及俄罗斯分离物KS等亲缘关系较近。这为开展CaYSV的遗传进化、致病机制及其防控措施研究奠定基础。
