单向活瓣成功治疗肺叶切除术后支气管残端瘘1例并文献复习
2023-03-11陈峰董亮张显齐高明霞
陈峰 董亮 张显齐 高明霞
支气管残端瘘是肺叶或全肺切除术后的少见并发症,是指支气管残端与胸膜腔相通形成的病理性窦道,发生率0.5%-20%[1],死亡率高达19.1%[2],支气管残端瘘的处理是胸外科的难点,部分患者不适合或不愿手术治疗。对于这部分患者,支气管镜介入封堵治疗是一种治疗选择。在中国知网、万方数据库查阅文献,国内鲜有支气管内单向活瓣(EBV)治疗术后支气管残端瘘报道,近期作者采用EBV成功治疗肺叶切除术后支气管残端瘘1例,报道如下并对支气管残端瘘的支气管镜封堵治疗方法进行国内外文献复习。
临床资料
患者,男性,49岁。因“咳嗽、咳痰10天”于2021年5月9日入住胸外科,既往有“高血压”病史4年,“糖尿病”1年;外院胸部CT示右肺下叶结节1.8cm×1.6cm,可见胸膜牵拉征和毛刺。于2021年5月12日行右肺下叶切除术,用强生~45mm切割缝合器切断下叶支气管。术后病理检查示贴壁状腺癌50%,腺泡状腺癌50%,于2021年5月26日出院。因咳嗽、憋喘10余天于2021年6月18日第二次入住胸外科,患者于术后20余天出现低头时咳出黄水(为胸水),胸部CT示右侧液气胸;经胸腔闭式引流17天拔除胸腔引流管后出现发热,经抗感染治疗后体温降至正常。因考虑“支气管残端胸膜瘘”于2021年7月10日转入呼吸科,2021年7月13日行电子支气管镜检查时可见右下叶支气管残端胸膜瘘口(图1),右下叶支气管残端长约1cm,瘘口约4~5mm,可见黄色胸水溢出。经患者签署知情同意书后,于2021年7月20日在局麻电子支气管镜下右下叶支气管残端置入EBV(Zyphyr4.0)(图2),EBV置入后患者未再出现低头时咳出黄水,复查胸部CT示胸腔内气体减少,于2021年7月25日出院。患者于2021年9月6日(置入EBV后48天)咳出活瓣,2021年9月7日复查电子支气管镜示右下叶支气管残端管腔充填肉芽组织(图3),复查胸部CT示右侧气胸完全吸收,右侧胸腔胸膜肥厚,少量胸腔积液。
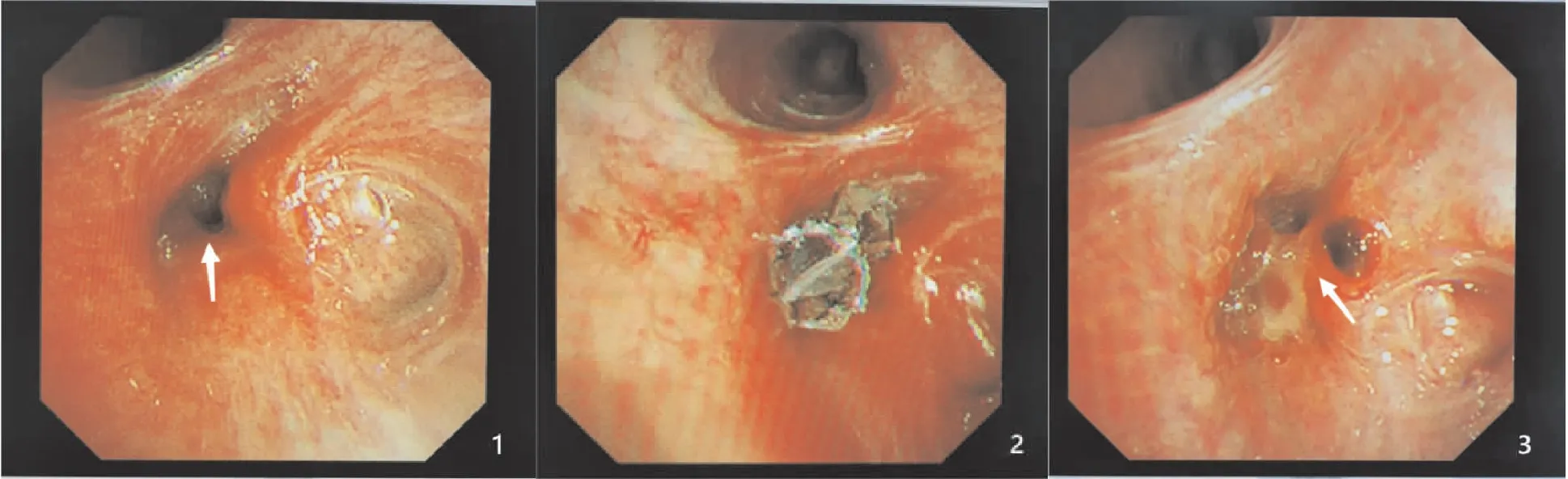
图1 2021年7月13日电子支气管镜检查可见右下叶支气管残端瘘口(箭头),右下叶支气管残端长约1cm,瘘口约4~5mm。图2 2021年7月20日局麻电子支气管镜下右下叶支气管残端置入EBV(Zyphyr4.0)。图3 2021年9月6日(置入EBV后48天)咳出活瓣,2021年9月7日复查电子支气管镜示右下叶支气管残端管腔充填肉芽组织(箭头)。
讨 论
支气管残端瘘出现于肺叶、肺段切除或单侧全肺切除术后,肺切除术的常见病因肺癌、肺结核及其后遗症。支气管残端与胸腔或纵隔相通,分别称为支气管胸膜瘘、支气管纵隔瘘。术后支气管残端瘘的发生率0.5%~20%,单侧肺切除高于肺叶或肺段切除术,分别为14.3%和1.4%,右肺切除术高于左肺,术前化疗或支气管残端的长度、缝合技术(手工或切割缝合器)、心包脂肪或网膜加固支气管残端可以影响支气管残端瘘的发生[1,3]。
术后支气管残端瘘可分为早发和晚发(通常定义为>30天),表现为脓胸、张力性气胸、新发或持续性胸腔引流漏气等[4]。其发生机制是支气管残端坏死或缝线裂开的结果,诱发因素包括术前放疗、未控制的胸膜肺感染、免疫抑制宿主、长时间的机械通气、支气管边缘残留癌组织、术后再次气管插管、支气管残端较长、支气管残端闭合错误等[5]。
临床表现:症状多变,呼吸困难、咳出中至大量血清样有泡沫液体、发热、脓性痰等;胸片显示气液平面的下降和经充分导管引流后的持续性或进展性气胸。CT扫描偶可显示支气管裂开区。支气管镜能证实支气管残端瘘及瘘口大小。
治疗方法:治疗方法的选择需要考虑到支气管残端有无感染和肿瘤。多种方法试用于封闭瘘口,成功率不同。治疗的选择根据瘘的大小和邻近组织、患者全身情况和基础疾病。开胸手术(背阔肌瓣转位术或移动网膜覆盖缺损)、组织血管化、填充肺切除后的空腔是首选的传统治疗方法,近年来出现了支气管内或经胸腔等微创瘘口封闭治疗技术。
传统认为手术是支气管残端瘘的最重要的治疗方法,再次手术有相当高的死亡率[6],然而现代文献表明有或无采用支气管镜的非手术治疗是不错的选择。考虑到感染和相关的死亡率,术后支气管残端瘘不适合立即手术,支气管镜治疗模式可以作为根治性手术的桥接方法[7]。支气管残端瘘的治疗必须个体化,全身情况好的患者应该手术治疗;不适宜手术或瘘口小的患者,可短期保守治疗(抗菌药物和胸腔闭式引流)观察;持续性支气管残端瘘和术后并发症风险大的患者,支气管镜处理可以作为根治性手术桥接方法。目前的研究表明,在经过挑选的支气管残端瘘患者中,支气管镜技术可有满意的治疗效果,避免了再次手术。
过去认为,瘘口小于8mm适合支气管镜治疗。通过定制封堵材料(如封堵支架)或其它用途的器材新用(如房间隔缺损封堵器、肺气肿减容单向活瓣),封堵方法增多,瘘口大小不再限制内镜治疗,尤其是随着经验的积累,成功率不断提高。
支气管镜治疗可以在全麻或局麻下采用可弯曲或硬质镜进行。纤维支气管镜探查支气管树不受限制,较大和陈旧的瘘口可采用硬质镜。目前采用的封堵方法包括:
1 机械摩擦、化学烧灼术、热消融:通过对瘘口周围黏膜组织进行机械摩擦(可弯曲钢丝刷)、化学烧灼(四环素或多西环素、硝酸银)、热消融(高频热疗、激光)等去上皮化治疗,引起局部炎症和瘘口的愈合,可在局麻下使用[8]。
通过可弯曲纤维支气管镜Nd:YAG激光束照射瘘口周围黏膜,采用0.5秒脉冲、能量输出8~20W,照射距离5~10mm,重复照射10~15次,总照射能量74~400J,同一病人可反复治疗2~5次。没有出现激光治疗引起的并发症,照射后数分钟瘘口至少暂时闭合,这是由于激光引起的瘘口周围水肿,激光治疗后数分钟可见纤维素样渗出物覆盖瘘口和经激光照射的支气管壁。似乎由于水肿和瘘口周围支气管黏膜的炎症反应,适合于<2mm支气管胸膜瘘。支气管残端无感染和肿瘤的患者激光治疗成功率80%(4/5),支气管残端存在感染和肿瘤的患者均失败[9]。
2 黏膜下注射硬化剂:可用于2~3mm的瘘口,局麻下通过可弯曲支气管镜,使用21G针,在瘘口水平黏膜下注射0.5~2mL聚多卡醇(羟基聚乙氧基十二烷溶于蒸馏水),病情需要可再次注射[10]。聚多卡醇可引起内皮细胞溶解,特异性作用于静脉内皮,通过干涉细胞膜脂质,破坏内皮,导致硬化[11]。
3 生物胶:包括纤维蛋白胶、氰基丙烯酸酯胶等,生物蛋白胶最终被吸收,以免异物反应。1mm大小的瘘口成功率最高,>8mm不适合支气管镜纤维蛋白胶或合成胶治疗[12]。
瘘口小于3mm采用纤维蛋白封闭胶注入瘘道或注入黏膜下,瘘口大于3mm采用纤维蛋白胶和小腿松质骨,因为大于3mm单纯纤维蛋白凝块可移位进入胸膜腔或被吸入对侧肺,小腿松质骨软且有弹性,被塑造成瘘的形状,插入瘘道后喷洒纤维蛋白。8mm以上的不适合内镜治疗[8]。
氰基丙烯酸酯胶是最常用的合成胶,开始起到塞子的作用,以后介导炎症反应,导致纤维和黏膜增殖,从而永久封堵缺口。通常通过纤维支气管镜注入,这种胶必须通过导管注射,以免损害支气管镜操作孔道,有可能渗透到胸腔或对侧支气管[13]。
>3mm的瘘口可以使用胶原贴片(明胶海绵)外敷纤维蛋白胶,用氧气吹干瘘口,止血海绵插入裂开的残端,氰基丙烯酸丁酯胶注入止血海绵塞加强。止血海绵呈“沙漏”型,紧密附着于支气管壁,不易移位或被咳出[14-15]。
4 弹簧圈:Sivrikoz等报道1例因肺癌行左肺切除术患者,术后5年左主支气管残端出现3mm瘘口,采用含纤维铂金弹簧圈联合纤维蛋白胶成功堵塞瘘口[16]。还有其它个案报道中采用弹簧圈成功堵塞瘘口[17-19]。
5 房(室)间隔缺损封堵器或血管塞:Fruchter等报道31例患者,在咪达唑仑(1~5mg)和阿芬太尼(0.5~1mg)中度镇静下在支气管镜室进行,支气管胸膜瘘颈部较长(>1mm)者使用房间隔封堵器,依靠支气管残端的直径和瘘口的长度来选择房间隔封堵器;短颈和针型支气管胸膜瘘采用血管塞(动脉导管封堵器)封堵;共有19例患者采用房间隔封堵器,12例患者采用动脉导管封堵器;即时成功率96%,31例患者中30例支气管胸膜瘘相关的症状消失,没有发生操作相关的死亡[20]。还有其它文献采用房间隔缺损封堵器或血管塞治疗的个案报告[21-24]。
Bai等报道采用室间隔缺封堵器治疗10例术后支气管胸膜瘘患者,全麻下通过可弯曲支气管镜置入,封堵成功率70%,2例封堵失败患者BMI低于18.5kg/m2,低体重可能是封堵失败大的危险因素;随访中位时间115天(范围:46~975天)未发生并发症[25]。
6 金属覆膜支架:可在支气管镜或透视指引下经气道行支架置入术,大部分情况下需要定制支架,也有文献报道经胸腔引流管放置支架。Sanjay等报道一例单侧肺切除术后1个月出现右主支气管残端瘘,支气管镜下放置Ultraflex金属覆膜支架(长80mm,直径18mm),近端位于气管中段,远端位于左主支气管中段,支架放置后漏气停止,术后2周出现痰液潴留,堵塞支架管腔65%,需要支气管镜清除[26]。
Han等报道在透视引导下采用子弹形状成角封堵支架治疗肺叶或肺切除术后支气管胸膜瘘患者6例,5例成功;支架由聚乙烯半覆膜管状部分(气管支架)和子弹状盲端覆膜支气管分支(支气管支架)组成[27]。Chae等报道一例因非结核分枝杆菌病行左侧全肺切除术后出现左主支气管残端瘘,在透视引导下行定制酒杯状硅酮覆膜支架置入,成功封堵瘘口[28]。Kim等报道在2例患者透视引导下通过胸腔引流管插入导引钢丝后放置金属支架(瘘口侧为涤纶覆膜支架,隆突侧为裸支架),成功封堵瘘口[29]。
7 单向活瓣:主要包括Olympus公司Spration 伞状活瓣(the one-way intrabronchial Spration valves,IBV)和Pulmonx公司Zephyr鸭嘴形活瓣(the one-way endobronchial Zephyr valves,EBV)。关于单向活瓣治疗肺切除术后自气管残端胸膜瘘,国内检索到文献一篇,采用EBV治疗术后支气管残端瘘2例.分别为右肺中叶和右全肺切除术后支气管残端瘘各1例,辅以生物胶封堵,2例均出现活瓣移位,咳出或落入胸膜腔,10~14天后再次置入,4个月后支气管镜复查见活瓣周围肉芽组织形成封闭瘘口,最后均取得成功[30]。我们报道的这1例患者术后48天咳出活瓣,复查支气管镜同样发现肉芽组织形成,封闭瘘口。国外文献Podgaetz等报道采用IBV治疗支气管胸膜瘘19例患者,其中2例患者为术后患者,分别为楔形切除和肺叶切除术后,胸腔引流5天后仍持续漏气者,给予放置IBV,2例均痊愈(漏气停止,拔除胸腔引流管)[31]。另有文献报道,采用EBV和IBV治疗难治性漏气21例,其中8例为术后支气管残端瘘,平均3.2天拔除胸腔引流管出院[32]。Hance等报道IBV治疗14例持续性漏气患者,其中3例分别为楔形切除、肺叶切除、单侧肺切除术后,3例的治疗效果没有具体讲明,总体成功率57%[33]。Travaline等报道EBV治疗41例持续性漏气患者,其中术后7例,具体手术方式不详,成功率47.5%[34]。
上述的支气管镜介入封堵方法亦可以用于创伤、肺脓肿和放疗等不常见的原因引起的支气管胸膜瘘。
术后持续性的支气管胸膜瘘不适合手术的患者,理想的闭合方法仍不清楚。支气管镜下瘘口封堵方法是不适合手术患者的一种选择,新的封堵方法和材料不断探索,多种方法联合、反复多次应用可以提高治愈率。术后注意观察操作相关的并发症如胸腔感染、痰液潴留等并给予处理。支气管镜介入治疗是否适合所有患者或成为一线治疗,仍无定论。
