机械损伤对人气道上皮细胞生长的影响
2023-03-11赖燕婷曾惠清张孝斌
赖燕婷 曾惠清 张孝斌
良性气道狭窄指因各类良性病变引起的气道狭窄,临床表现为咳嗽、反复呼吸道感染、不同程度的呼吸困难甚至窒息。成人良性气道狭窄常见病因为结核、气管插管和气管切开术后气道狭窄[1-2]。随着重症医学和呼吸支持技术的发展,接受气管插管、气管切开的病人数量上升,其导致气道狭窄的发生率升高[3]。据报道气管插管2周左右、拔管后1个月左右即可发生气管狭窄[4]。相较于恶性气道狭窄,良性气道狭窄患者生存期长、远期并发症多,反复住院,生活质量差,越来越受到人们的关注,已成为研究热点。本研究旨在通过机械划痕模拟气管插管对气道损伤作用,通过测量造模后细胞生长情况,在细胞水平层面探讨机械损伤对气道上皮细胞的作用,探讨气管插管所致气管狭窄可能的发生发展机制。
资料与方法
一、实验材料
人支气管上皮细胞(16HBE)、16HBE专用完全培养液外购于赛百慷公司。DMEM培养基购于hyclone公司;DAB显色试剂盒、(Mouse/Rabbit)IHC Kit购于福州迈新;CCK8试剂盒购于Biosharp;TGF-β抗体购于bioss公司;β-catenin抗体购于abcam公司;HIF-1α抗体购于proteintch公司;苏木精染色剂购于SIGMA公司。本研究伦理审批号:xmzsyyky论审第(2021-065)号。
二、细胞培养
三、细胞造模
本课题组参照文献报道的方法[5-6],建立上皮细胞机械损伤模型。具体步骤如下:16HBE细胞100%融合后进行换液,然后用20μL的枪头在单层细胞上以间隔纵横划8条宽约0.5mm缺口,无血清培养基培养3 h后弃去,加新鲜的无血清培养基继续培养24h,将培养后上清液加入16HBE专用完全培养液建立条件培养液。
四、HBE细胞处理
将16HBE分为2组,每组各设置3个亚组进行重复试验,其中A1组用16HBE专用完全培养液培养,A2组用条件培养基培养,培养5天,倒置荧光显微镜观察各组细胞的形态。
五、细胞增殖活性及细胞分子检测
1 CCK8法检测细胞增殖情况
细胞按照3000个/孔,铺板96孔板,待细胞贴壁后分组进行处理。处理48 h后,丢弃旧的培养基,加入CCK8试剂进行细胞活力检测,2h内读取OD450值。具体步骤参照各种试剂说明书进行。
2 免疫细胞化学
利用免疫细胞化学检测处理后16HBE中TGF-β、β-catenin、HIF-1表达水平。具体步骤如下:1)阻断、灭活内源性过氧化物酶;2)正常羊血清工作液封闭非特异位点;3)相应细胞因子一抗、二抗孵育;4)DAB反应染色、苏木素复染、脱水透明,中性树胶封片;5)拍照存档。具体步骤参照各种试剂说明书进行;各抗体工作浓度按说明书进行稀释。
3 HE染色
苏木精-伊红染色方法对细胞处理后16HBE进行染色;具体步骤均参照各种试剂说明书进行。
材料中“党的十八届会议审议通过《建议》”体现中共的相应知识点,比如:执政党、领导核心、执政方式;“国家发改委启动建言献策活动”体现公民参与民主决策;“政府编制‘十三五’纲要”体现政府科学民主决策等等。通过分析,既把握材料的中心思想和层次性,又建立了与知识点的联系。
六、统计学分析
采用 SPSS 22.0软件进行统计学分析,两组间比较用t检验,P<0.05为差异有统计学意义。
结 果
一、细胞基础培养
人支气管上皮细胞16HBE基础培养生长情况(图1)所示,细胞生长状态良好。

图1 细胞基础培养生长情况(×100)
二、16HBE细胞造模
16HBE造模前后生长情况,细胞生长状态良好(图2)所示。
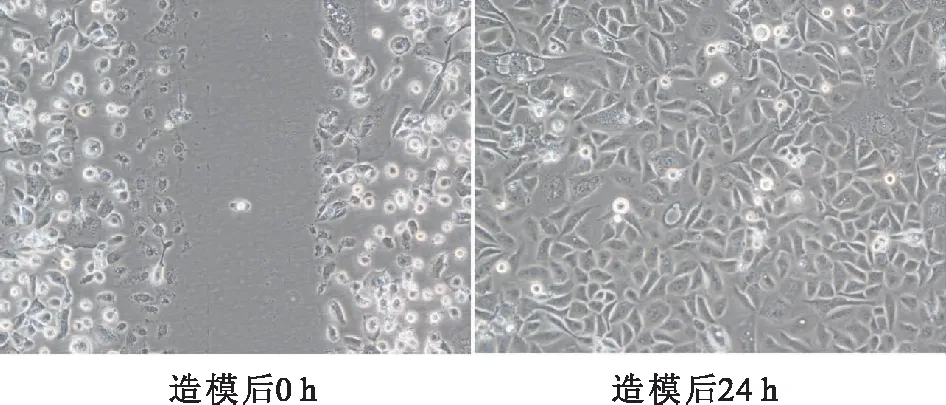
图2 细胞造模前后生长情况(×100)
三、16HBE细胞处理后生长情况
将16HBE分组培养5天后,倒置荧光显微镜观察各组细胞的形态,两组细胞均表现为扁平、核大而圆、形态不规则,细胞间彼此连接紧密,细胞连接处清晰可见,(图3)所示。
四、细胞计数
将16HBE分组培养后进行细胞计数,各组数量比较(图4)所示,造模后,细胞数量显著降低(P<0.05)。
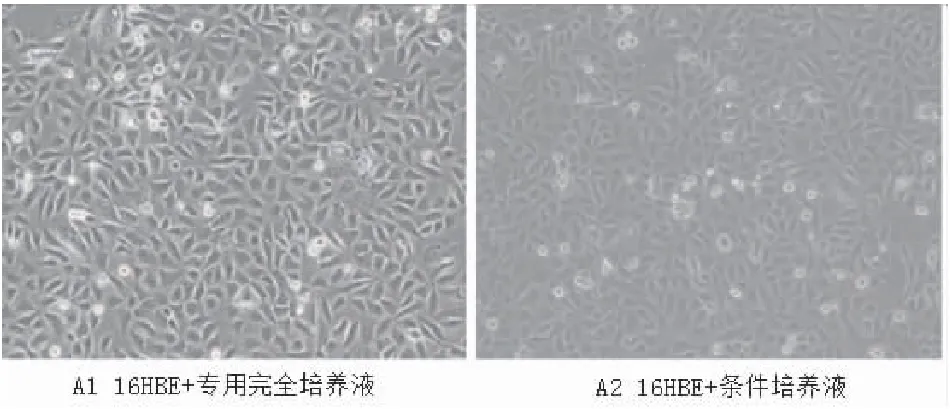
图3 人支气管上皮细胞(16HBE)分组培养后细胞生长情况(×100)
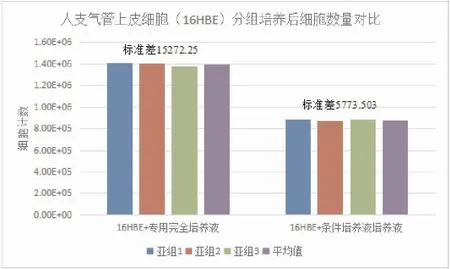
图4 人支气管上皮细胞(16HBE)分组培养后细胞数量对比
五、CCK8检测
将16HBE分组培养后用CCK8检测法分析两组细胞增殖情况,结果(图5)所示,造模后,细胞活性显著降低(P<0.05)。
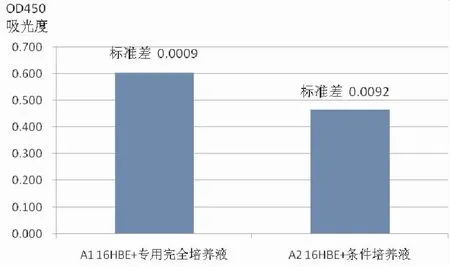
图5 人支气管上皮细胞(16HBE)分组培养后CCK8法检测细胞增殖活性(OD450吸光度对比情况)
六、免疫细胞化学
将16HBE分组培养后免疫细胞化学分析TGF-β、β-catenin、HIF-1表达情况,使用Image J软件分析组化图像,结果(图6)所示,原图(图7)所示。结果显示,造模后TGF-β、β-catenin、HIF-1α表达升高(P<0.05)。
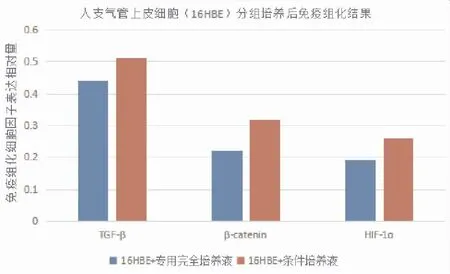
图6 人支气管上皮细胞(16HBE)分组培养后免疫细胞化学测定细胞因子结果

图7 16HBE细胞分组培养后免疫细胞化学DAB染色(×400)
七、HE染色
将16HBE分组培养后,HE染色显微镜下观察细胞变化情况,造模后细胞形态未变,胞核染色未变,胞质淡染,结果(如图8)所示。
讨 论
气管插管和气管切开是导致气道良性狭窄的主要病因,此类患者生存期长,生活质量差,医疗资源及经济资源消耗大,越来越受到人们关注,其参与介导气道狭窄的分子机制复杂,且关于这方面的基础研究不足。
图8 HE(苏木精-伊红染色)染色(×400)
良性气道狭窄的发生是气道粘膜损伤和异常修复的过程[7],最终导致气道重塑。当气道粘膜破坏时,炎症细胞浸润、增生、分化,新生血管形成,其中成纤维细胞分泌大量胶原纤维,造成胶原沉积,肉芽组织老化脱水,成纤维细胞变成具有收缩表现的肌成纤维细胞,发生组织挛缩及瘢痕狭窄,在气道狭窄中起重要作用。
气道重塑过程中,TGF-β过度表达,促进成纤维细胞的募集及向肌成纤维细胞分化,细胞外基质过表达、沉淀和细胞外基质降解减少,参与气道狭窄的形成。Simpson等[8]对声门下气道狭窄模型犬注射抗TGF-β,发现其可明显减轻气道狭窄,从动物层面验证了TGF-β在气道狭窄中的作用。随访119例气管支气管结核患者,气管镜评估气管狭窄发生情况,分析血液TGF-β浓度,发现气道狭窄组TGF -β水平较非狭窄组明显升高[9]。国内学者一项关于大鼠气管移植后移植体狭窄的研究发现,对比对照组,气管移植体内TGF-β1表达量明显增加,且其变化趋势与上皮细胞间质转化动态变化趋势一致,其研究证明TGF-β/Smad信号通路参与气管移植后移植体狭窄[10]。
TGF-β和Wnt都是调节上皮间质转化(EMT)的重要通路,Wnt/β-catenin通路中当Wnt信号激活后可激活胞内蛋白DVL,抑制GSK3β等蛋白形成的β-catenin降解复合物的降解活性,稳定细胞质中游离状态的β-catenin蛋白。β-catenin进入细胞核后结合LEF/TCF转录因子家族,启动下游靶基因(如c-myc、Cyclin D1等)的转录,诱导EMT转换,介导气道重塑发生。在哮喘小鼠中, 通过抑制Wnt/β-catenin通路, 小鼠上皮下纤维化及胶原累积明显减少, 气道重塑程度明显降低[11]。
HIF-1是一种低氧诱导结合蛋白,在低氧环境下,HIF-1α亚基的降解被抑制,1α和β亚基形成有活性的HIF-1,转移到细胞核内调节多种基因的转录,包括VEGF的表达增强,参与炎症反应。Cai[12]等人分析了24例气管插管后气道狭窄患者气道增生组织中HIF-1α表达情况,发现HIF-1α在气道肉芽组织中持续存在,参与气管插管后气道狭窄的发病过程,认为其可能是启动和促进这一过程的潜在关键调节因子。
本研究通过机械划痕模拟插管机械损伤,对气道上皮细胞进行损伤造模,利用造模后培养基对气道上皮细胞进行培养,对比细胞数及凋亡率,探讨机械损伤对气道上皮细胞增生的影响,结果显示造模后气道上皮细胞的生长速度减慢,且活性降低,差异具有统计学意义,说明机械损伤可抑制气道上皮细胞的正常生长。免疫细胞化学进一步分析两组细胞因子变化,发现造模后细胞TGF-β、β-catenin升高,差异具有统计学意义,提示机械损伤破坏上皮细胞后可产生无菌性炎症,促发损伤修复机制,同感染性炎症介导气道重塑相似,导致炎症性细胞因子TGF-β、β-catenin过表达,说明TGF-β及Wnt/β-catenin通路可能是机械损伤后气道修复的作用机制。气管插管对气道粘膜造成机械损伤的同时,由于气管插管套囊长时间压迫,粘膜局部缺血缺氧,导致缺氧因子HIF-1过表达,本研究在细胞层面证实了机械损伤下HIF-1的升高,证实缺氧参与了机械损伤介导的炎症反应。综上,本研究认为机械损伤可抑制气道上皮细胞的正常生长;缺氧及TGF-β、Wnt/β-catenin通路可能参与了气道机械损伤后的修复过程。在此,我们提出假设,机械损伤可通过TGF-β、Wnt/β-catenin通路及HIF-1参与其气道修复过程,抑制气道上皮细胞的正常增殖,诱导气道上皮细胞间质转化,促进上皮重塑,导致气道发生狭窄,这需要进一步行细胞及动物实验进行验证。
