基于AMPK/SIRT1-FoxO1信号通路探讨葛根芩连汤对db/db糖尿病小鼠肝脏氧化应激的影响
2023-03-11张媛媛朱向东苏菲关晓文翟艳会段永强梁建庆
张媛媛 ,朱向东 ,苏菲 ,关晓文 ,翟艳会 ,段永强 ,梁建庆
1.甘肃中医药大学,甘肃省中医方药挖掘与创新转化重点实验室,糖尿病实验室,甘肃 兰州 730000;2.宁夏医科大学,宁夏 银川 750004
2型糖尿病(type 2 diabetes mellitus,T2DM)是一种以高血糖为主要症状的糖脂代谢紊乱性疾病。T2DM机制主要涉及胰岛β细胞功能紊乱、胰岛素抵抗、炎症反应和氧化应激反应[1]。研究表明,氧化应激会引起胰岛β细胞功能损伤及外周组织胰岛素抵抗,最终导致糖尿病[2]。肝脏作为胰岛素的重要靶器官,对机体糖脂代谢平衡有重要作用[3]。目前认为,肝脏胰岛素抵抗与氧化应激相关。动物实验表明,葛根芩连汤可有效改善T2DM大鼠胰岛素抵抗[4-5]。本研究旨在探究葛根芩连汤对T2DM小鼠肝脏氧化应激的影响,以期为葛根芩连汤防治T2DM提供依据。
1 实验材料
1.1 动物
SPF级db/db小鼠75只、db/m小鼠15只,8周龄,体质量(20±5)g,常州卡文斯实验动物有限公司提供,动物许可证号SCXK(苏)2016-0010。饲养于甘肃中医药大学实验动物中心SPF级屏障实验室,温度21~25 ℃,相对湿度50%~60%,12 h明暗交替,自由摄食饮水。适应性喂养1周后开始实验。本实验经甘肃中医药大学动物实验伦理委员会批准(2020-280)。
1.2 药物及制备
葛根芩连汤(葛根、黄芩、黄连、炙甘草),饮片购自甘肃中医药大学附属医院。上述饮片按8∶3∶3∶2比例配伍[6],葛根先煎30 min,再与其余药物共煎30 min,纱布过滤,残渣加8倍量水继续煎煮30 min,合并2次滤液,使用旋转蒸发仪浓缩成含原药材3.19、1.91、0.69 g/mL浓缩液。盐酸二甲双胍片,中美上海施贵宝股份有限公司,0.5 g/片,批号ABS5857。将药片粉碎,用蒸馏水配制成浓度为0.02 g/mL溶液。
1.3 主要试剂与仪器
BCA试剂盒,北京索莱宝有限科技公司,货号20220117;腺苷酸活化蛋白激酶(AMPK)抗体、p-AMPK抗体,美国GeneTex公司,批号GTX103487、GTX109608;沉默信息调节因子1(SIRT1)抗体、叉头框蛋白1(FoxO1)抗体、p-FoxO1抗体,英国Abcam公司,批号ab189494、ab52857、ab259337;GAPDH抗体、HRP羊抗兔IgG(H+L)抗体,美国Immunoway公司,批号ym3215、RS0002;ECL超敏发光液、PVDF膜,Millpore公司,批号36208ES60、R6KA9704H;RNA提取液、RT First Strand cDNA Synthesis Kit、2×SYBR Green qPCR Master Mix(None ROX),武汉Servicebio公司,批号G3013、G333、G3320;丙二醛(MDA)、谷胱甘肽过氧化物酶(GSH-Px)、过氧化氢酶(CAT)试剂盒,南京建成生物工程研究所,批号20220117、20220114、22020117;糖化血红蛋白(HbA1c)测定试剂盒,美国PTS公司,批号8193302401。Advantage型血糖仪(德国罗氏公司),Power PacTMBasic垂直电泳仪(美国Bio-Rad公司),Gelwiew 6000Plus凝胶成像仪(广州博鹭腾),CFX荧光定量PCR仪(美国Bio-Rad),NanoDrop2000超微量分光光度计(美国Thermo)。
2 实验方法
2.1 分组及给药
将75只db/db小鼠按血糖随机分为模型组、二甲双胍组和葛根芩连汤高、中、低剂量组,每组15只,另取15只db/m小鼠作为空白组。给药组根据临床成人常用剂量,并参照人与动物体表面积计算小鼠等效剂量,葛根芩连汤高、中、低剂量组分别予31.9、19.1、6.9 g/kg葛根芩连汤药液灌胃,二甲双胍组予0.2 g/kg二甲双胍溶液灌胃,空白组和模型组予等体积生理盐水灌胃,每日1次,连续12周。
2.2 取材
末次给药后禁食12 h,摘眼球取血,血清常温静置1.5 h,4 ℃、3 000×g离心10 min,血清置-20 ℃冰箱保存。冰上分离肝脏,用预冷生理盐水清洗,滤纸吸干水分,放于冻存管中,置-80 ℃冰箱保存。
2.3 体质量及血糖检测
药物干预期间,每周同一时间测量小鼠体质量,禁食6 h后尾静脉采血,用血糖仪测定血糖,末次给药后禁食12 h,取尾静脉血检测空腹血糖(FPG)及糖化血红蛋白(HbA1c)含量。
2.4 HE染色
将肝组织用甲醛固定,全自动脱水机脱水,石蜡包埋,切片,常规HE染色,显微镜下拍照观察。
2.5 氧化应激相关指标测定
取适量肝组织,预冷PBS漂洗,称定质量,加入预冷PBS 5~10 mL,用高通量冷冻组织研磨器(70 Hz/min)冰上研磨,匀浆液4 ℃、3 000 r/min离心10 min,取上清液,用化学发光免疫分析法检测MDA含量和GSH-Px、CAT活性。
2.6 Western blot检测
剪取0.05~0.1 g肝脏,预冷生理盐水漂洗,加入RIPA裂解液和磷酸酶抑制剂,用高通量冷冻组织研磨器研磨,冰上裂解30 min,4 ℃、12 000 r/min离心10 min,取上清液,BCA蛋白定量试剂盒进行定量分析后上样,蛋白经电泳分离,300 mA恒流湿转至PVDF膜,5%脱脂奶粉(磷酸化蛋白使用5%BSA),室温轻摇封闭2 h,TBST洗膜3次,加入AMPK、p-AMPK、SIRT1、FoxO1、p-FoxO1一抗(均为1∶1 000)和GAPDH一抗(1∶5 000),室温轻摇1 h后放入4 ℃冰箱过夜。次日复温30 min,TBST洗膜8 min×4次,加入二抗,37 ℃轻摇2 h,TBST洗膜8 min×4次,ECL显色后曝光。采用Image J 1.8.0软件进行分析,以GAPDH为内参,计算目的蛋白相对表达量。
2.7 RT-qPCR检测
取肝组织100 mg,Trizol法提取总RNA。微量分光光度计测定RNA纯度及浓度。将总RNA反转录为互补cDNA,进行PCR,反应条件:95 ℃预变性30 s,95 ℃变性5 s,55 ℃退火30 s,72 ℃延伸30 s,共40个循环。采用2-ΔΔCt法对各基因mRNA表达进行相对定量分析。引物由宝日医生物技术有限公司设计合成,引物序列见表1。

表1 各基因PCR引物序列
3 统计学方法
采用GraphPad Prism 9.0统计软件进行分析。实验数据以±s表示,符合正态分布组间比较用方差分析,方差不齐用秩和检验。P<0.05 表示差异有统计学意义。
4 结果
4.1 葛根芩连汤对模型小鼠体质量的影响
与空白组比较,模型组小鼠体质量显著增加(P<0.01);与模型组比较,二甲双胍组和葛根芩连汤各剂量组小鼠体质量显著降低(P<0.05,P<0.01);与二甲双胍组比较,葛根芩连汤高剂量组小鼠体质量显著降低(P<0.05)。见表2。
表2 各组小鼠体质量比较(±s,g)
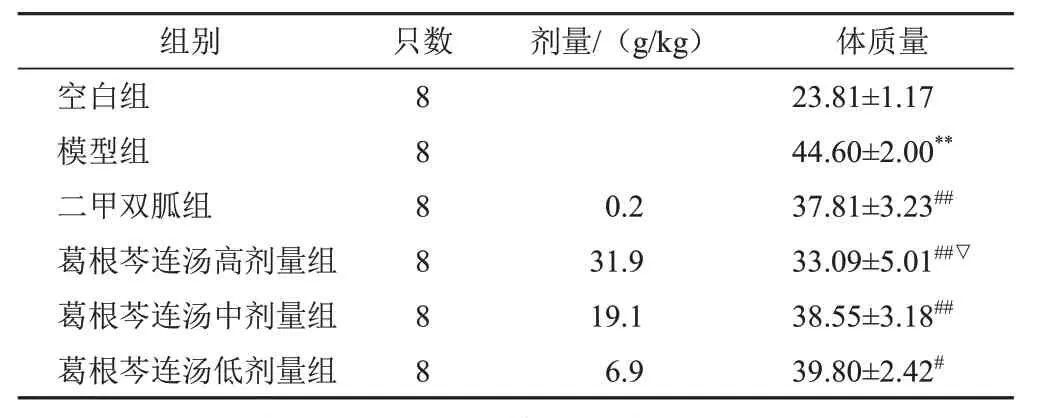
表2 各组小鼠体质量比较(±s,g)
注:与空白组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01;与二甲双胍组比较,▽P<0.05
组别空白组模型组二甲双胍组葛根芩连汤高剂量组葛根芩连汤中剂量组葛根芩连汤低剂量组只数8 8 8 8 8 8剂量/(g/kg)0.2 31.9 19.1 6.9体质量23.81±1.17 44.60±2.00**37.81±3.23##33.09±5.01##▽38.55±3.18##39.80±2.42#
4.2 葛根芩连汤对模型小鼠空腹血糖及糖化血红蛋白含量的影响
与空白组比较,模型组小鼠FPG和HbA1c含量均显著升高(P<0.01);与模型组比较,二甲双胍组和葛根芩连汤各剂量组小鼠FPG和HbA1c含量均显著降低(P<0.05,P<0.01);与二甲双胍组比较,葛根芩连汤高剂量组小鼠FPG和HbA1c含量均显著降低(P<0.05)。见表3。
表3 各组小鼠FPG和HbA1c含量比较(±s)
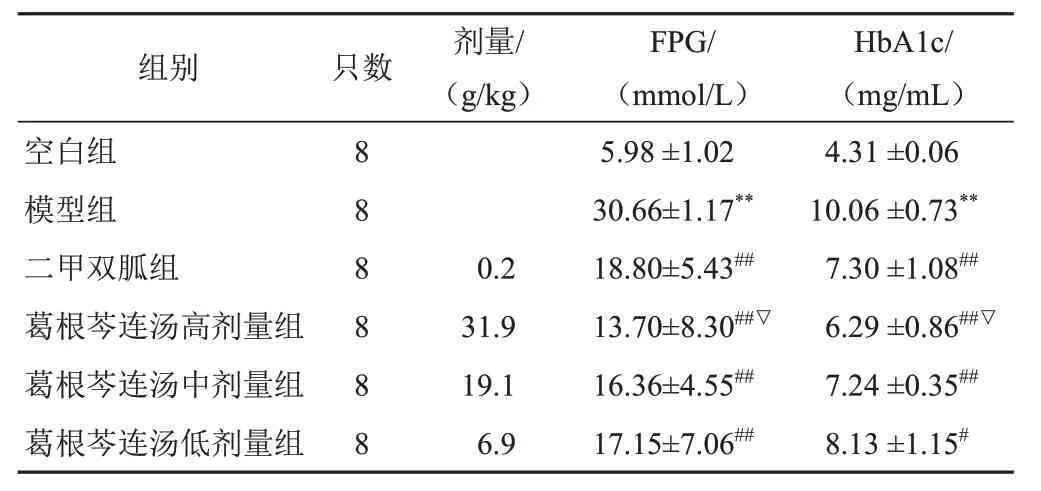
表3 各组小鼠FPG和HbA1c含量比较(±s)
注:与空白组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01;与二甲双胍组比较,▽P<0.05
组别空白组模型组二甲双胍组葛根芩连汤高剂量组葛根芩连汤中剂量组葛根芩连汤低剂量组只数8 8 8 8 8 8剂量/(g/kg)0.2 31.9 19.1 6.9 FPG/(mmol/L)5.98 ±1.02 30.66±1.17**18.80±5.43##13.70±8.30##▽16.36±4.55##17.15±7.06##HbA1c/(mg/mL)4.31 ±0.06 10.06 ±0.73**7.30 ±1.08##6.29 ±0.86##▽7.24 ±0.35##8.13 ±1.15#
4.3 葛根芩连汤对模型小鼠肝组织病理变化的影响
空白组小鼠肝组织结构正常,被膜完整,肝小叶分叶不明显,肝索排列较整齐。与空白组比较,模型组小鼠可见较多肝细胞空泡变性,且少量肝细胞脂肪变性,胞质内含透明圆形脂滴,肝细胞点状坏死,胞核固缩崩解。与模型组比较,葛根芩连汤低剂量组小鼠病变程度略减轻,有少量肝细胞空泡变性,较多肝细胞脂肪变性,内含大小不一脂滴,肝窦轻微淤血;二甲双胍组和葛根芩连汤中、高剂量组明显减轻。见图1。
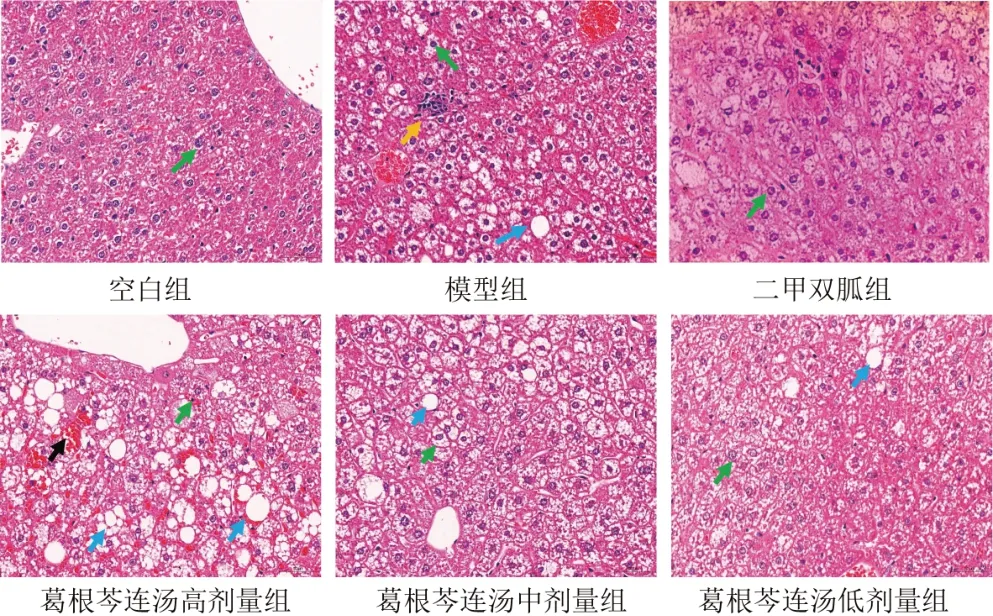
图1 各组小鼠肝组织形态(HE染色,×200)
4.4 葛根芩连汤对模型小鼠肝组织氧化应激相关指标的影响
与空白组比较,模型组小鼠肝组织MDA含量显著增加,GSH-Px、CAT活性显著降低(P<0.01);与模型组比较,二甲双胍组和葛根芩连汤各剂量组小鼠肝组织MDA含量显著减少,GSH-Px、CAT活性显著升高(P<0.05,P<0.01);与二甲双胍组比较,葛根芩连汤高、中剂量组小鼠肝组织MDA含量显著减少,GSH-Px、CAT活性显著升高(P<0.05)。见表4。
表4 各组小鼠肝组织MDA、GSH-Px、CAT水平比较(±s)
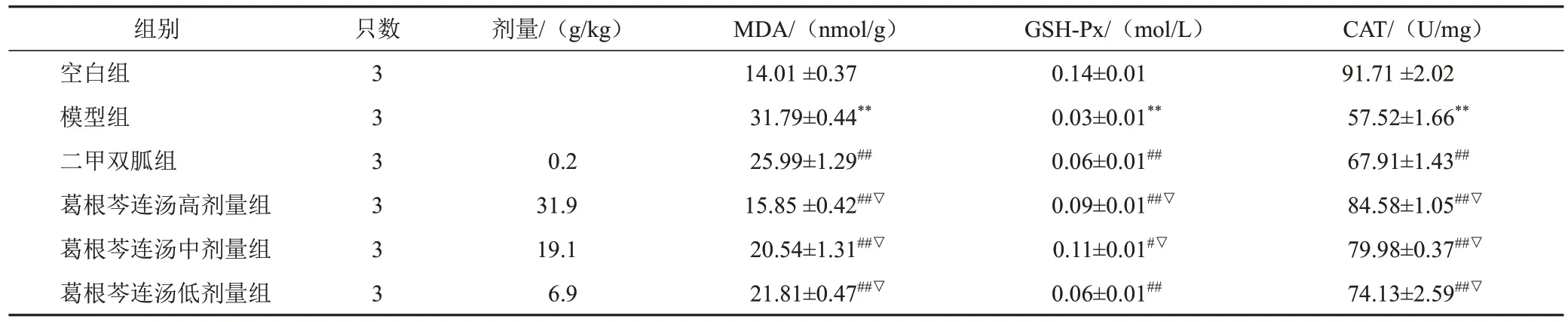
表4 各组小鼠肝组织MDA、GSH-Px、CAT水平比较(±s)
注:与空白组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01;与二甲双胍组比较,▽P<0.05
组别空白组模型组二甲双胍组葛根芩连汤高剂量组葛根芩连汤中剂量组葛根芩连汤低剂量组只数3 3 3 3 3 3剂量/(g/kg)0.2 31.9 19.1 6.9 MDA/(nmol/g)14.01 ±0.37 31.79±0.44**25.99±1.29##15.85 ±0.42##▽20.54±1.31##▽21.81±0.47##▽GSH-Px/(mol/L)0.14±0.01 0.03±0.01**0.06±0.01##0.09±0.01##▽0.11±0.01#▽0.06±0.01##CAT/(U/mg)91.71 ±2.02 57.52±1.66**67.91±1.43##84.58±1.05##▽79.98±0.37##▽74.13±2.59##▽
4.5 葛根芩连汤对模型小鼠肝组织AMPK、SIRT1、FoxO1蛋白表达的影响
与空白组比较,模型组小鼠肝组织AMPK、p-AMPK、SIRT1蛋白表达降低,FoxO1、p-FoxO1蛋白表达升高,差异有统计学意义(P<0.01);与模型组比较,二甲双胍组和葛根芩连汤高、中剂量组小鼠肝组织AMPK、p-AMPK、SIRT1蛋白表达升高,FoxO1、p-FoxO1蛋白表达降低,差异有统计学意义(P<0.05,P<0.01);与二甲双胍组比较,葛根芩连汤高剂量组小鼠肝组织AMPK、p-AMPK、SIRT1蛋白表达升高,FoxO1、p-FoxO1蛋白表达降低,差异有统计学意义(P<0.05)。见表5、图2。
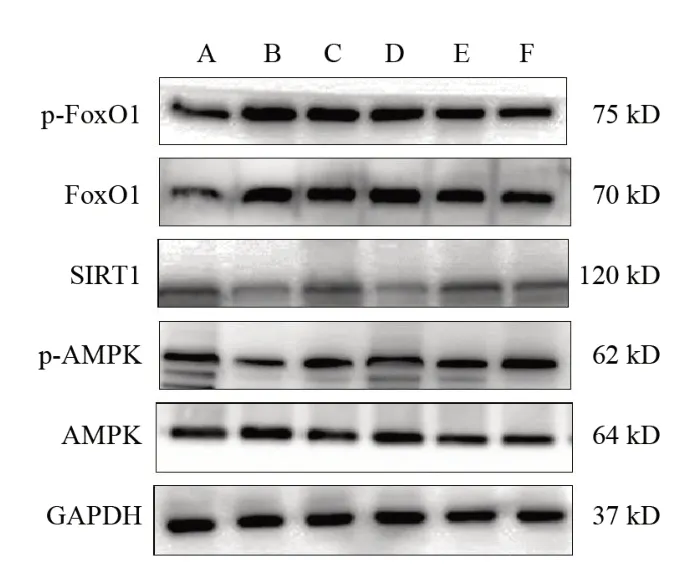
图2 各组小鼠肝组织AMPK、p-AMPK、SIRT1、FoxO1、p-FoxO1蛋白免疫印迹
表5 各组小鼠肝组织AMPK、p-AMPK、SIRT1、FoxO1、p-FoxO1蛋白表达比较(±s)
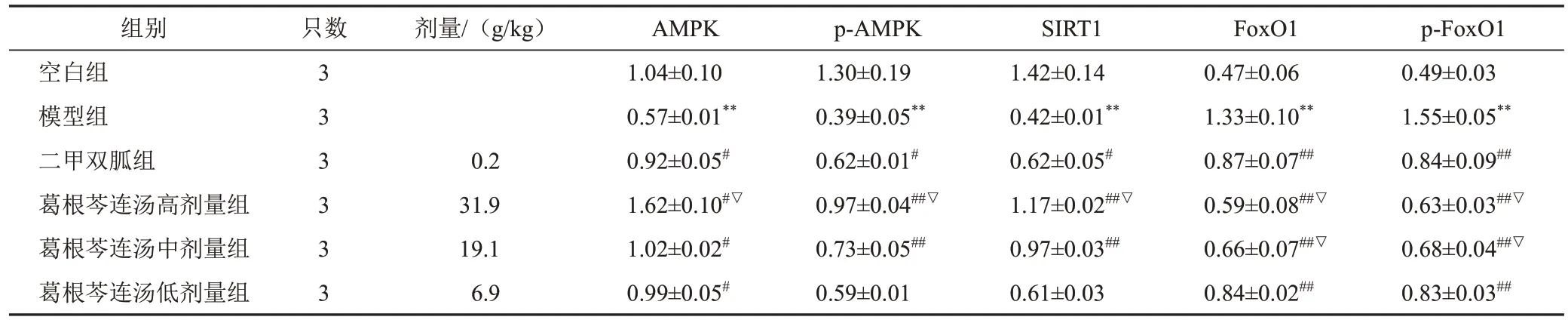
表5 各组小鼠肝组织AMPK、p-AMPK、SIRT1、FoxO1、p-FoxO1蛋白表达比较(±s)
注:与空白组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01;与二甲双胍组比较,▽P<0.05
组别空白组模型组二甲双胍组葛根芩连汤高剂量组葛根芩连汤中剂量组葛根芩连汤低剂量组只数3 3 3 3 3 3剂量/(g/kg)0.2 31.9 19.1 6.9 AMPK 1.04±0.10 0.57±0.01**0.92±0.05#1.62±0.10#▽1.02±0.02#0.99±0.05#p-AMPK 1.30±0.19 0.39±0.05**0.62±0.01#0.97±0.04##▽0.73±0.05##0.59±0.01 SIRT1 1.42±0.14 0.42±0.01**0.62±0.05#1.17±0.02##▽0.97±0.03##0.61±0.03 FoxO1 0.47±0.06 1.33±0.10**0.87±0.07##0.59±0.08##▽0.66±0.07##▽0.84±0.02##p-FoxO1 0.49±0.03 1.55±0.05**0.84±0.09##0.63±0.03##▽0.68±0.04##▽0.83±0.03##
4.6 葛根芩连汤对模型小鼠肝组织AMPK、SIRT1、FoxO1 mRNA表达的影响
与空白组比较,模型组小鼠肝组织AMPK、SIRT1 mRNA表达显著降低,FoxO1 mRNA表达显著升高(P<0.01);与模型组比较,各给药组小鼠肝组织AMPK、SIRT1 mRNA表达显著升高,FoxO1 mRNA表达显著降低(P<0.05);与二甲双胍组比较,葛根芩连汤高剂量组小鼠肝组织AMPK、SIRT1 mRNA表达显著升高,FoxO1 mRNA表达显著降低(P<0.05)。见表6。
表6 各组小鼠肝组织AMPK、SIRT1、FoxO1 mRNA表达比较(±s)

表6 各组小鼠肝组织AMPK、SIRT1、FoxO1 mRNA表达比较(±s)
注:与空白组比较,**P<0.01;与模型组比较,#P<0.05;与二甲双胍组比较,▽P<0.05,▽▽P<0.01
组别空白组模型组二甲双胍组葛根芩连汤高剂量组葛根芩连汤中剂量组葛根芩连汤低剂量组只数3 3 3 3 3 3 AMPK 1.00±0.00 0.33±0.04**0.61±0.57#0.71±0.70#▽0.65±0.01#0.47±0.06#▽SIRT1 1.00±0.00 0.22±0.01**0.52±0.01#0.87±0.04#▽0.74±0.02#▽0.56±0.01#FoxO1 1.00±0.00 3.27±0.03**1.62±0.01#1.04±0.18#▽1.65±0.02#2.16±0.03#▽▽
5 讨论
根据国际糖尿病联合会统计,过去10年,我国糖尿病患者人数由9 000万增加至1.4亿,增幅达56%[7]。《黄帝内经太素》:“五气,五谷之气。液在脾者,五谷液也。肥羹令人热中,故脾行涎液,出廉泉,入口中,名曰脾瘅。内热气溢,转为消渴,以兰为汤饮之,可以除陈气也。”阐述脾瘅主要病机为中满内热。仝小林院士[8]认为,中满日久化热是肥胖型糖尿病发病的关键,也是脾瘅转为消渴的主要枢机,治疗当大剂消导以消中满,同时重用苦寒以清内热,以清为主。
葛根芩连汤源于《伤寒论·太阳病脉证并治》“治太阳病桂枝证,医反下之,利遂不止,脉促者,表未解也;喘而汗出者,葛根芩连汤主之”。全方由葛根、黄连、黄芩、炙甘草4味药组成,主治协热下利,临床多用于治疗湿热所致腹泻和痢疾。葛根芩连汤治疗T2DM早期,属古方新用[9]。方中葛根甘、辛,性凉,入阳明经,善解胃热之消渴;黄芩、黄连苦寒,清肝胃之热;炙甘草甘缓和中,调和诸药。诸药相伍,外解表热,内清里热,清热燥湿,生津润燥,切中T2DM早期“中满内热,湿热内阻”病机。本研究选取db/db小鼠,其表现为肥胖及多饮、多食等症状,与人类T2DM表现极为相似,是研究T2DM的理想动物模型[10]。氧化应激是体内氧化作用与抗氧化作用失去平衡,即活性氧簇和活性氮簇生成过多而抗氧化系统无法完全清除[11]。氧化应激参与多种疾病的发生发展,与糖尿病关系十分密切[12]。在T2DM发生发展过程中,氧化应激产生的主要机制包括葡萄糖自身氧化、蛋白质非酶糖化、多元醇途径激活、蛋白激酶C激活、线粒体氧化磷酸化、抗氧化系统清除能力减弱等[13]。MDA是脂质过氧化反应的终产物,能反映氧化应激受损程度。GSH-Px是机体抗氧化系统中重要的抗氧化酶,能清除细胞呼吸代谢过程中产生的过氧化物和羟自由基,减轻对机体的损伤[14]。CAT是过氧化物酶体系的标志酶,存在于动物各种组织细胞内,以肝脏中浓度最高[15]。本研究结果显示,葛根芩连汤能降低模型小鼠体质量、FPG及HbA1c,HE染色可见少量肝细胞空泡变性,肝细胞点状坏死有所改善,肝组织氧化应激相关指标MDA含量减少,GSH-Px和CAT活性升高,表明葛根芩连汤可有效调节小鼠肝脏氧化应激水平。AMPK作为动物细胞内能量平衡的主要感受器,主要在肝脏内表达,可调节脂肪酸氧化代谢和脂质代谢相关基因表达[16-17]。研究表明,AMPK磷酸化后,通过激活下游SIRT1信号通路,增强线粒体氧化磷酸化水平[18]。SIRT1作为FoxO1上游分子,通过抑制FoxO1磷酸化增强抗氧化系统活性,抑制氧化应激产生[19-20]。本实验结果显示,葛根芩连汤能上调肝组织AMPK、SIRT1 mRNA和蛋白表达,下调FoxO1 mRNA和蛋白表达,改善db/db小鼠肝脏氧化应激状态,发挥抗氧化应激作用。
综上所述,葛根芩连汤可通过上调AMPK/SIRT1通路蛋白表达,下调FoxO1通路蛋白表达,提高db/db小鼠抗氧化能力,减少自由基生成,降低肝脏氧化应激水平,改善T2DM。本研究进一步揭示了葛根芩连汤改善T2DM的可能作用机制,可为中医防治糖尿病提供实验依据。
