正交试验优化二丁口服液提取工艺
2023-03-03康玉霞王亚丽崔小七陈长青郭玉凡
康玉霞,王 欣,王亚丽,崔小七,陈长青,郭玉凡
(郑州百瑞动物药业有限公司,河南 郑州 450000)
二丁口服液主要由紫花地丁、蒲公英、半边莲、板蓝根四味药材组成,方中紫花地丁、蒲公英苦寒,清热解毒,消痈,为君药;板蓝根解毒利咽,消肿,为臣药;半边莲甘淡渗利,为佐使,可使热随体液而出,又兼具消肿解毒之功效。诸药合用,力专而雄,实为清热解毒之重剂。现代药理学研究表明,紫花地丁具有抑菌、抗炎、抗病毒、调节免疫等作用[1],蒲公英具有抑菌、抗病毒、抗炎、抗氧化、调节免疫等作用[2],半边莲具有抑菌、镇痛抗炎、抗氧化等作用[3],板蓝根具有抗菌、抗炎、抗病毒、抗病原微生物、提高机体免疫力等作用[4];方中各味药材通过配伍,相辅相成,不仅能够直接杀灭病毒和细菌等病原体,还能扶助正气、调节机体免疫功能,通过扶正祛邪、标本兼顾,用于治疗火热毒盛所致的热疖痈毒、咽喉肿痛、风热火眼。为尽可能提取药材中的有效成分,本研究通过正交试验设计优化二丁口服液的提取工艺,以液料比、提取次数和提取时间等因素为考察对象,以干膏得率、秦皮乙素和咖啡酸含量的综合考察为评价指标,对处方的提取参数进行筛选,优选出最佳提取工艺,以期为二丁口服液的生产提供理论依据。
1 材料与方法
1.1 主要试剂 秦皮乙素(批号:110741-201708,纯度:99.9%)和咖啡酸(批号:110885-201703,纯度:99.7%),均购自中国食品药品检定研究院;紫花地丁、半边莲、蒲公英和板蓝根,均购自河南禹州药材市场,经检验均符合2020版《中华人民共和国药典》该药材项下的有关规定;纯化水,本实验室自制;分析纯甲醇,购自天津市富宇精细化工有限公司;色谱纯甲醇,购自天津市精细化学品有限公司。
1.2 主要仪器 DZKW-4型水浴锅(北京中兴伟业世纪仪器有限公司);LC-1260高效液相色谱仪(美国安捷伦科技有限公司);KQ5200B型超声波清洗器(昆山市超声仪器有限公司);GZX-9140MBE电热鼓风干燥箱(上海博讯实业有限公司医疗设备长厂);十万分之一分析天平(MS205DU,梅特勒-托利多);TD5Z低速离心机(湖南凯达科学仪器有限公司)。
1.3 试验方法
1.3.1 二丁口服液提取液的制备 分别称取处方量的紫花地丁、蒲公英、半边莲和板蓝根,加12倍量水加热提取2次,每次1 h,滤过,滤液合并,浓缩,离心,上清液制成1 g/mL的药液,备用。
1.3.2 干膏得率 精密吸取1.3.1中制备药液10 mL置于干燥至恒重的蒸发皿中,蒸干,105 ℃烘箱干燥4 h至恒重,取出,迅速置干燥器中冷却至室温,称重,按公式(1)计算干膏得率(%)[5]。

(1)
1.3.3 含量测定 采用高效液相色谱法(High performance liquid chromatography,HPLC)进行含量测定,并进行方法学验证。色谱条件:色谱柱:ODS2 C18(4.6 mm×250 mm,5 μm);流动相:甲醇-0.1%磷酸(20∶80,v/v);流速:1.0 mL/min;检测波长:324 nm;柱温:30 ℃;进样量:10 μL。在此条件下,秦皮乙素、咖啡酸与其他组分均有较好的分离,理论塔板数按各峰计算,均不低于3 000。
1.3.3.1 对照品溶液的制备 精密称取秦皮乙素对照品18.62 mg,置于20 mL量瓶中,加甲醇溶解,定容至刻度,摇匀,得质量浓度为0.93 mg/mL的对照品储备液。精密吸取该对照品储备液3.5 mL,置于10 mL量瓶中,加甲醇定容至刻度,摇匀,得质量浓度为0.33 mg/mL的秦皮乙素对照品溶液。精密称取咖啡酸对照品11.85 mg,置于25 mL量瓶中,加甲醇溶解,定容至刻度,摇匀,得质量浓度为472.58 μg/mL的对照品储备液。精密吸取该对照品储备液1.0 mL,置于25 mL量瓶中,加甲醇定容至刻度,摇匀,得质量浓度为18.90 μg/mL的咖啡酸对照品溶液。
1.3.3.2 供试品溶液的制备 精密吸取1.3.3.1中制备的药液5 mL,置150 mL具塞锥形瓶中,精密加入甲醇20 mL,密塞,摇匀,称定重量,超声处理(功率250 W,频率40 kHz)30 min,取出,放冷,再称定重量,用甲醇补足减失的重量,摇匀,滤过,取续滤液,即得。
1.3.3.3 阴性对照溶液的制备 取紫花地丁、蒲公英阴性样品适量,按1.3.3.2项下的方法制备阴性对照溶液。
1.3.3.4 专属性试验 精密吸取对照品溶液、供试品溶液和阴性对照溶液各10 μL,按1.3.3项下的色谱条件进样测定。
1.3.3.5 线性关系考察 精密量取秦皮乙素对照品储备液0.35、0.70、1.00、1.40、1.80、2.10和2.50 mL,分别置于5 mL量瓶中,加甲醇定容至刻度,摇匀,制成质量浓度为0.065、0.130、0.186、0.260、0.335、0.391和0.465 mg/mL的秦皮乙素对照品系列溶液。精密量取咖啡酸对照品储备液0.20、0.40、0.60、0.80、1.00、1.20和1.40 mL,分别置于25 mL量瓶中,加甲醇定容至刻度,摇匀,制成质量浓度为3.78、7.56、11.34、15.12、18.90、22.68和26.46 μg/mL 的咖啡酸对照品系列溶液。精密吸取秦皮乙素和咖啡酸对照品系列溶液各10 μL,按照1.3.3项下的色谱条件进样测定,记录峰面积。以各对照品的峰面积(Y)对其进样质量浓度(X)进行线性回归,计算线性回归方程。
1.3.3.6 精密度试验 按照1.3.3项下的色谱条件,精密吸取对照品溶液各10 μL,重复进样6次,记录峰面积,计算秦皮乙素和咖啡酸的RSD值。
1.3.3.7 稳定性试验 精密吸取同一供试品溶液10 μL,在0、2、4、6、8、10和12 h,按照1.3.3项下的色谱条件,分别进样测定,记录峰面积,计算秦皮乙素和咖啡酸的RSD值。
1.3.3.8 重复性试验 取同一批药液,按照1.3.3.2项下的方法,制备6份供试品溶液,并按照1.3.3项下的色谱条件,分别进样测定,记录峰面积,计算秦皮乙素和咖啡酸的平均含量和RSD值。
1.3.3.9 加样回收率试验 精密量取1.3.3.8中药液2.5 mL共6份,加入一定量的秦皮乙素和咖啡酸对照品储备液,加甲醇18 mL,密塞,摇匀,称定重量,超声处理(功率250 W,频率40 kHz)30 min,取出,放冷,再称定重量,用甲醇补足减失的重量,摇匀,滤过,取续滤液,即得。精密吸取10 μL,按照1.3.3项下的色谱条件进样测定,计算加样回收率。
1.3.3.10 检测限 按信噪比3∶1为标准,精密称取秦皮乙素、咖啡酸对照品适量,加甲醇分别配制成相应的浓度,进样检测,分别测定秦皮乙素和咖啡酸的检测限。
1.3.3.11 定量限 按信噪比10∶1为标准,精密称取秦皮乙素、咖啡酸对照品适量,加甲醇分别配制成相应的浓度,进样检测,分别测定秦皮乙素和咖啡酸的定量限。
1.3.4 单因素考察 影响中药制剂提取工艺的因素有很多,但主要影响因素为液料比、提取时间和提取次数。现结合生产实际,分别对每个因素进行考察,以干膏得率、秦皮乙素和咖啡酸的含量为综合评价指标,以干膏得率、秦皮乙素和咖啡酸含量的最大值为参照,对数据进行归一化法分析,干膏得率、秦皮乙素和咖啡酸含量的权重系数分别为0.4、0.3和0.3,按公式(2)计算综合评分[6]。
综合评分=(干膏得率/干膏最大得率)×0.4+(秦皮乙素/秦皮乙素最大值)×0.3+(咖啡酸/咖啡酸最大值)×0.3
(2)
1.3.4.1 液料比 分别称取处方量的药材,按液料比10∶1、12∶1、15∶1、18∶1,加热提取2次,每次1 h,滤过,滤液合并,浓缩,离心,上清液制成1 g/mL的药液,分别测定干膏得率、秦皮乙素和蒲公英的含量,按公式(2)计算综合评分。
1.3.4.2 提取时间 分别称取处方量的药材,按液料比12∶1加水,加热提取2次,每次提取时间分别为1、2和3 h,滤过,滤液合并,浓缩,离心,上清液制成1 g/mL的药液,分别测定干膏得率、秦皮乙素和蒲公英的含量,按公式(2)计算综合评分。
1.3.4.3 提取次数 分别称取处方量的药材,按液料比12∶1,加热提取次数分别为1、2和3次,每次提取1 h,滤过,滤液合并,浓缩,离心,上清液制成1 g/mL的药液,分别测定干膏得率、秦皮乙素和蒲公英的含量,按公式(2)计算综合评分。
1.3.5 正交试验 根据单因素试验和检索相关文献的结果[6,7],液料比、提取时间和提取次数为影响提取效果的主要因素。因此正交试验选择液料比、提取时间和提取次数3个因素为考察对象,每个因素分别选取3个水平,按L9(34)正交表进行试验,优选最佳提取参数。正交试验采用综合评分的方法,以干膏得率、秦皮乙素和咖啡酸含量为综合评价指标,按公式(2)计算综合评分。
1.3.6 工艺验证 称取处方量的药材共50 g,平行称取3份,按照最佳工艺参数进行提取,分别制成3批1 mg/mL的药液,测定干膏得率、秦皮乙素和咖啡酸含量,分别对3批药液进行验证。
2 结果
2.1 含量测定
2.1.1 专属性试验 结果显示,供试品溶液和对照品溶液的色谱峰保留时间一致,阴性对照溶液在对照品相应的保留时间均未出现色谱峰(图1)。表明该色谱条件下,秦皮乙素和咖啡酸吸收良好,药液中其他组分对其含量测定均无干扰。
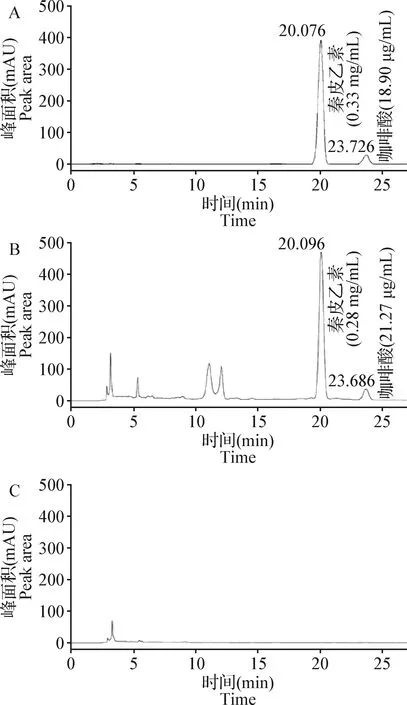
图1 HPLC色谱图
2.1.2 线性关系考察 以各对照品的峰面积(Y)对其进样质量浓度(X)进行线性回归,分别得到秦皮乙素线性回归方程为Y=37 776X+162.95(R2=0.999)(图2);咖啡酸线性回归方程为Y=57.076X+26.357(R2=0.998 3)(图3)。结果表明,秦皮乙素质量浓度在0.065~0.465 mg/mL、咖啡酸质量浓度在3.78~26.46 μg/mL范围内线性关系良好。
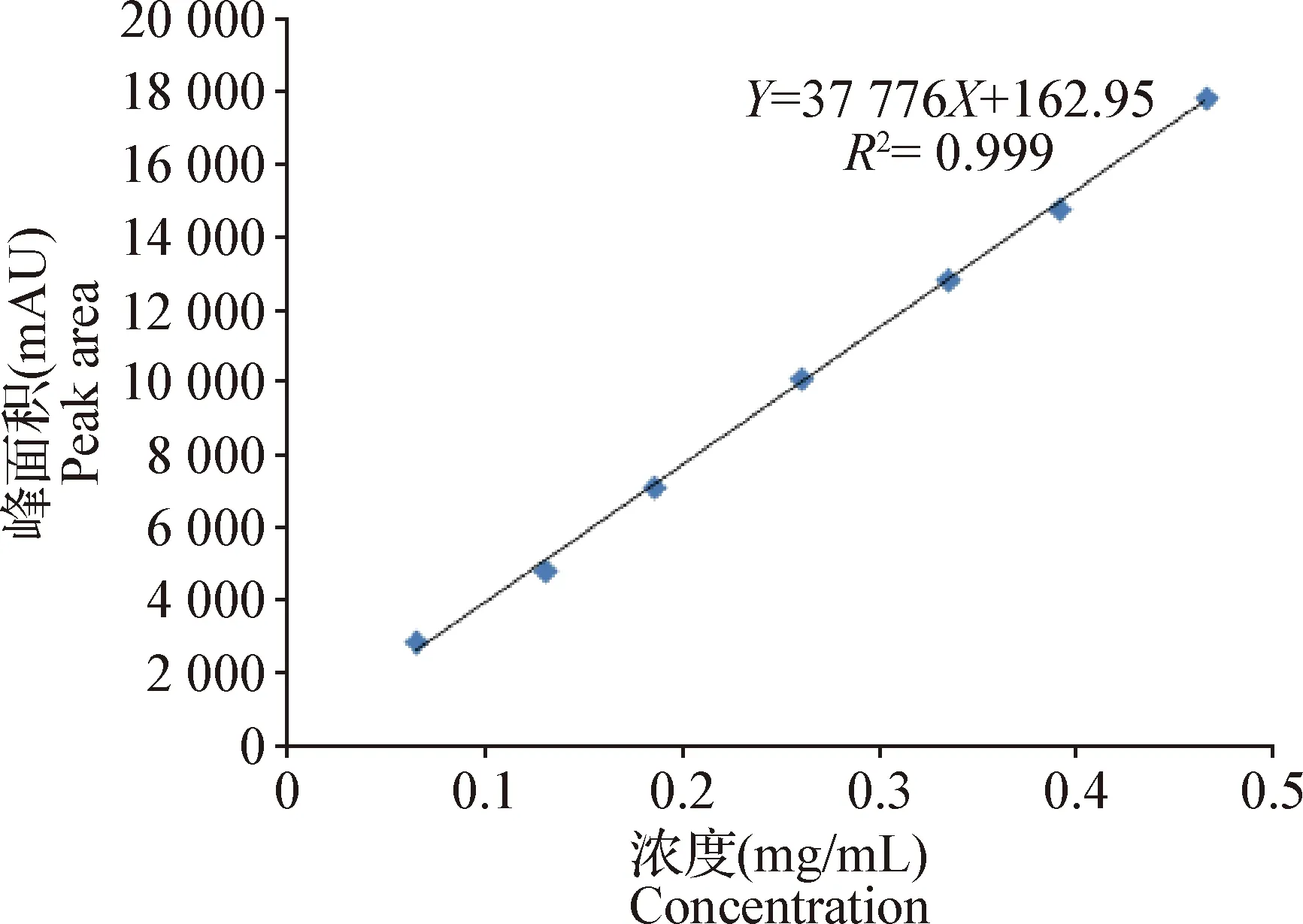
图2 秦皮乙素的标准曲线

图3 咖啡酸的标准曲线
2.1.3 精密度试验 秦皮乙素和咖啡酸RSD值分别为0.41%和0.96%,表明仪器精密度良好。
2.1.4 稳定性试验 秦皮乙素和咖啡酸的RSD值分别为0.89%和1.27%,表明供试品溶液在12 h内稳定性良好。
2.1.5 重复性试验 秦皮乙素的平均含量为1.48 mg/mL,RSD值为1.12%;咖啡酸的平均含量为91.06 μg/mL,RSD值为1.46%。表明该方法重复性良好。
2.1.6 加样回收率试验 由表1可知,秦皮乙素平均加样回收率99.69%,RSD值为1.72%,咖啡酸加样回收率92.80%,RSD值为1.92%,均符合要求。
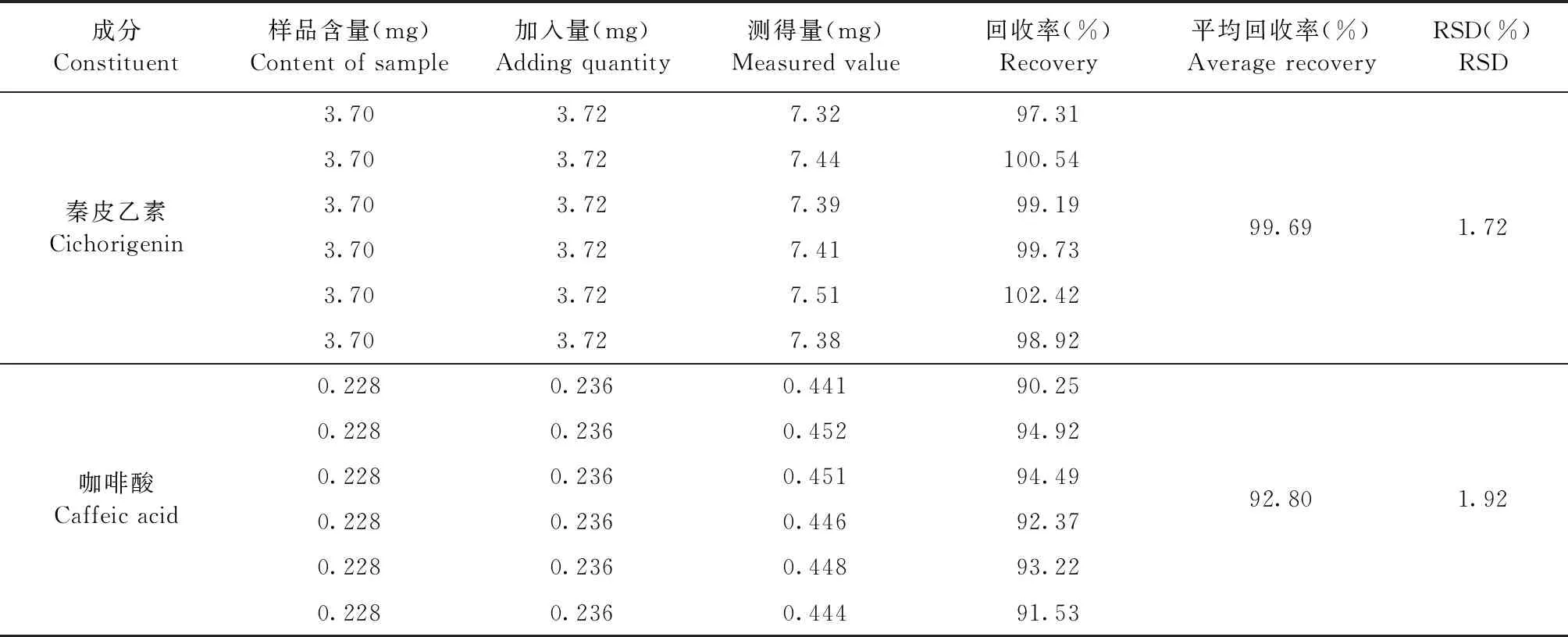
表1 加样回收率试验结果
2.1.7 检测限 秦皮乙素的检测限为0.07 μg/mL,咖啡酸的检测限为0.04 μg/mL。
2.1.8 定量限 秦皮乙素的定量限为0.33 μg/mL,咖啡酸的定量限为0.21 μg/mL。
2.2 单因素考察
2.2.1 液料比 由表2可知,随着液料比的增大,干膏得率、秦皮乙素和咖啡酸含量随之增加,但当液料比增大到12∶1之后,干膏得率变化不明显,液料比增大到15∶1之后,秦皮乙素和咖啡酸的含量增加幅度较小。
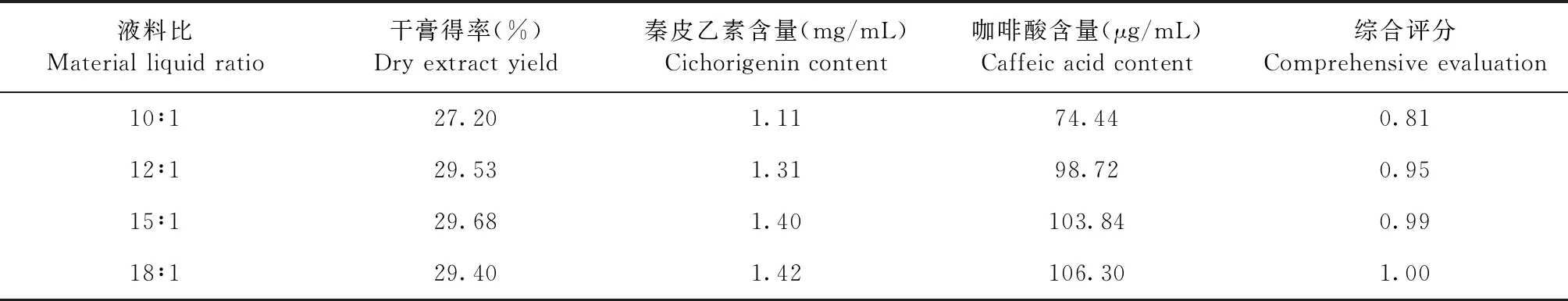
表2 不同液料比对干膏得率、秦皮乙素和咖啡酸含量的影响
2.2.2 提取时间 由表3可知,随提取时间的增加,干膏得率随之增加,当提取时间增加至2 h后无明显变化,秦皮乙素和咖啡酸的含量随着提取时间的增加略有增加,当提取时间增加至3 h后,咖啡酸含量略有增加,而秦皮乙素含量反而显著下降。

表3 不同提取时间对干膏得率、秦皮乙素和咖啡酸含量的影响
2.2.3 提取次数 由表4可知,随着提取次数的增加,干膏得率、秦皮乙素和咖啡酸含量均随之增加,当提取次数在2次之后,各参数的增加幅度变小。
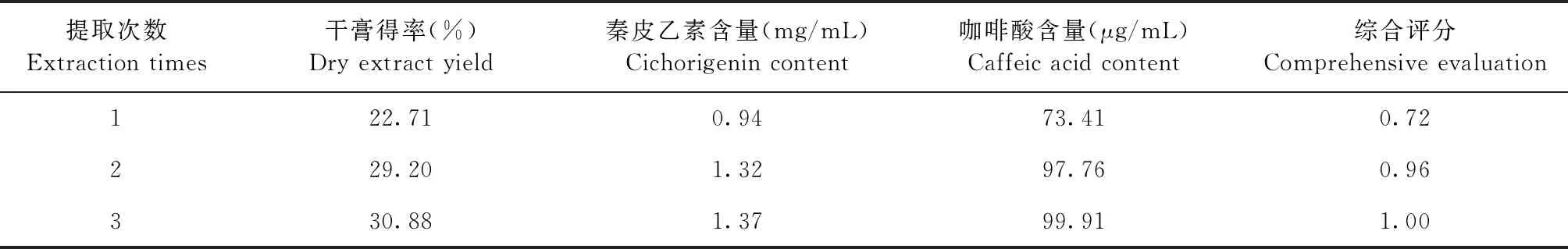
表4 不同提取次数对干膏得率、秦皮乙素和咖啡酸含量的影响
2.3 正交试验 根据单因素试验的结果,正交试验选择液料比(A)、提取时间(B)、提取次数(C)3个因素为考察对象,每个因素分别选取3个水平,依据L9(34)正交表分别进行试验,因素水平见表5。采用正交助手专业版软件进行设计,用方差分析评价各因素水平对提取工艺影响的显著性。正交试验结果见表6,方差分析结果见表7。
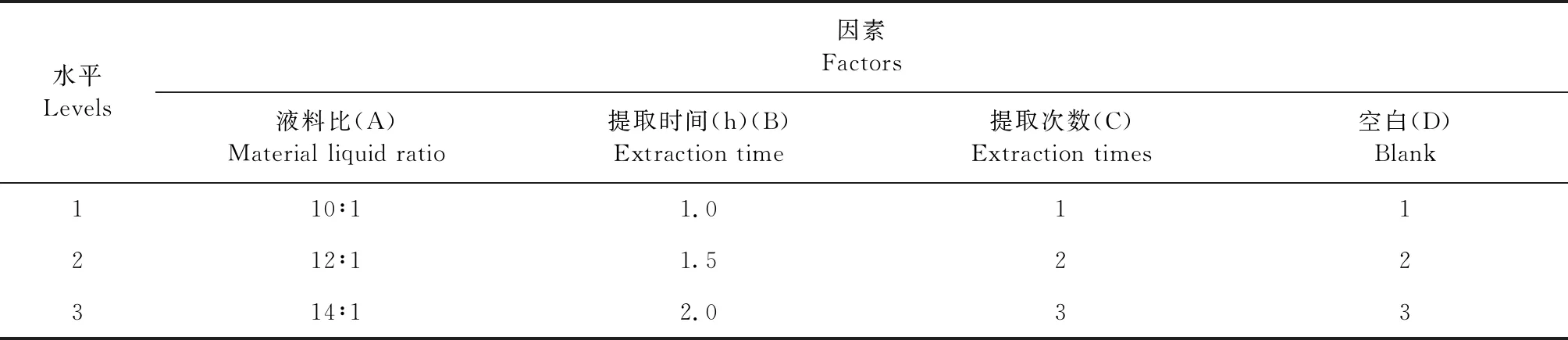
表5 L9(34)正交试验因素水平
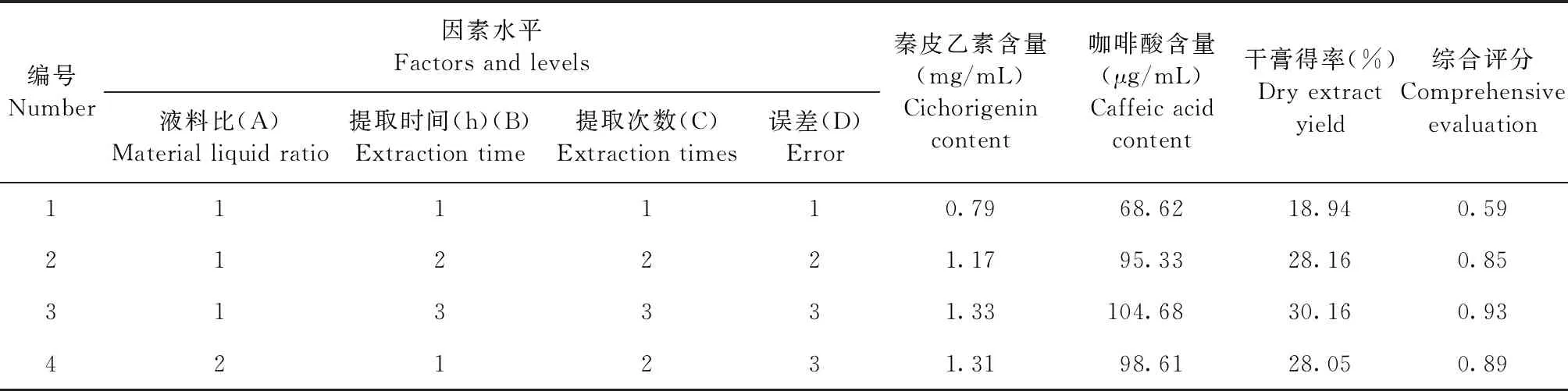
表6 L9(34)正交试验结果
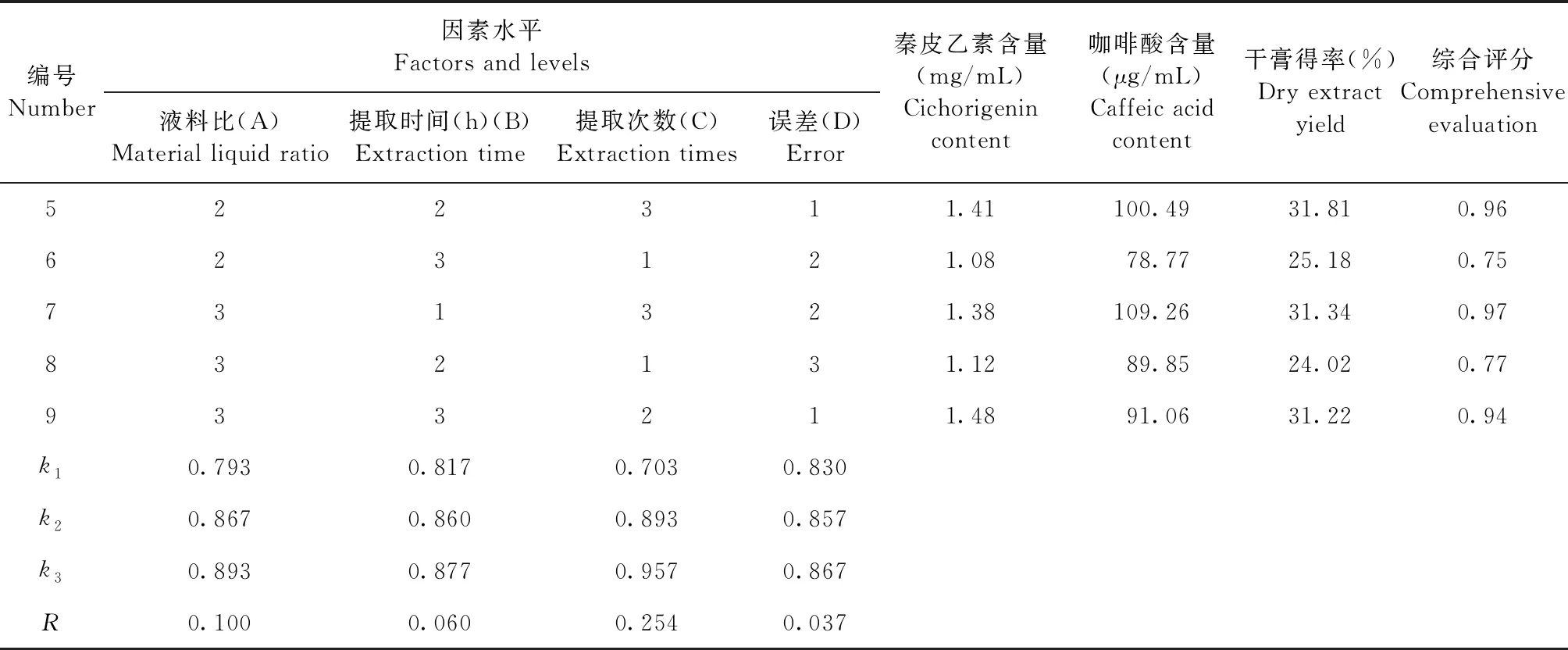
续表

表7 方差分析
由表6可知,各因素对综合评分的影响依次为C>A>B,即提取次数影响最大,然后是液料比,提取时间对综合评分的影响最小。
由表7可知,提取次数对综合评分的影响具有显著性差异(P<0.05)。根据正交试验结果可知,最佳提取工艺参数为A3B1C3,即液料比为14∶1,提取时间为1 h,提取3次。
2.4 工艺验证 按照最佳工艺参数A3B1C3提取制成3批1 mg/mL的药液,测定干膏得率、秦皮乙素和咖啡酸含量,结果见表8。3批药液的平均干膏得率为31.16%,秦皮乙素的平均含量为1.37 mg/mL,咖啡酸的平均含量为108.14 μg/mL。表明该工艺条件稳定,重复性良好,可用于工业化生产。
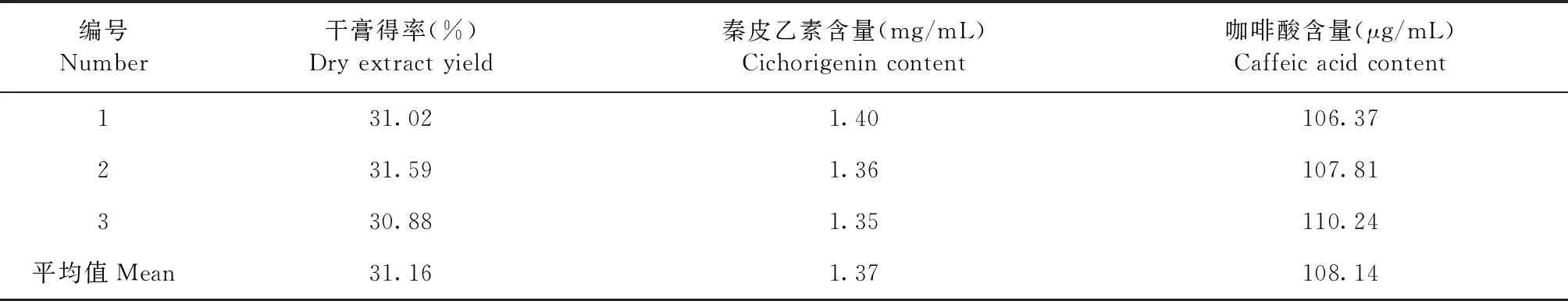
表8 验证试验结果(n=3)
3 讨论
关于考察指标的选择,由于紫花地丁和蒲公英同为处方的君药,秦皮乙素是紫花地丁的主要药效成分之一,咖啡酸是蒲公英的主要药效成分之一,而干膏得率又是影响提取效率的重要因素,所以选择三者的综合评分作为提取工艺的考察指标,更加科学、合理。
关于检测波长的选择,秦皮乙素的最大吸收波长为353 nm,咖啡酸的最大吸收波长为324 nm,由于样品中咖啡酸的含量较低,峰面积比较小,为同时兼顾两组分的吸收,选择324 nm为检测波长。
关于流动相的选择,笔者考察了乙腈-0.4%冰醋酸、甲醇-0.4%冰醋酸、甲醇-0.6%冰醋酸、乙腈-0.1%磷酸、甲醇-0.1%磷酸[8-11],发现甲醇-0.1%磷酸能把两者较好的分离,且峰形良好。流动相的水相使用冰醋酸溶液时,色谱峰有拖尾现象,有机相选择乙腈时,两组分的分离度不好。
关于供试品溶剂的选择,根据检索相关文献的结果[10-13],分别考察了50%甲醇、60%甲醇、70%甲醇和100%甲醇等提取溶剂,结果发现以甲醇为提取溶剂,杂质更少,几种提取溶剂制得的样品,含量相差无几,所以最终选择甲醇为供试品的提取溶剂。
单因素试验结果发现,药液的提取时间超过2 h,秦皮乙素的含量显著降低,可能是由于持续长时间受热导致秦皮乙素化学结构遭到破坏所致。
二丁口服液采用正交试验设计优选出最佳提取工艺,最佳工艺参数为液料比14∶1,提取3次,每次1 h。该提取工艺的综合考察指标明显优于2020版《中华人民共和国药典》二丁颗粒提取工艺的综合考察指标,且该工艺稳定,重复性良好,为二丁口服液的后续开发研究提供了有力的理论基础。
