高原兔肠道菌群多样性分析
2023-03-03候建平郑思思李佳妮朱丽琳
龙 鑫,候建平,郑思思,李佳妮,王 稳,朱丽琳
(1. 青海大学 省部共建三江源生态与高原农牧业国家重点实验室,青海 西宁 810016 ;2. 西宁市野生动物疫源疫病监测站,青海 西宁 810001)
高原兔(Lepusoiostolus)又名灰尾兔,隶属于兔形目,兔科,主要分布于我国青藏高原及其毗邻地区,是世界上分布海拔最高的兔种。目前,关于野生高原兔的生理研究偏少,主要集中于形态学观察、生活习性、种群数量及人工防控、栖息地利用等内容[1]。近年来,越来越多的研究发现,肠道菌群与动物宿主的神经系统、内分泌系统、免疫系统存在相互调控,进而与宿主的发育、免疫、代谢等诸多生理过程及众多疾病的发生存在关联[2]。基于此,深入了解高原兔肠道菌群的组成及功能在其生理生态学研究中具有重要意义。目前,16S rDNA扩增子测序、宏基因组、培养基分离培养等技术手段被广泛应用于动物肠道微生物研究[3]。本试验利用16S rDNA高通量测序方法,分析高原兔小肠与大肠部位菌群种类及相对丰度,同时利用不同培养基对高原兔新鲜粪便中的微生物进行分离培养,获得可培养的肠道微生物菌株,并进一步对获得的菌株进行耐药性检测。本试验结果有助于丰富对高原兔肠道微生物的认识,并为高原兔生理生态研究提供参考。
1 材料与方法
1.1 主要试剂 LB琼脂和肉汤、MRS琼脂和肉汤、M17琼脂和肉汤、乳酸杆菌选择性培养基(LBS)琼脂和肉汤,均购自青岛高科技工业园海博生物技术有限公司;细菌基因组DNA提取试剂盒、2 ×TaqPCR Master Mix和DL 2 000 Marker,均购自宝日医生物技术(北京)有限公司;大肠埃希菌(EscherichiacoliATCC8099)、肠炎沙门菌(SalmonellaenteritidisCMCC 50041)、金黄色葡萄球菌(StaphylococcusaureusATCC6538)、痢疾志贺氏菌(ShigelladysenteriaeCMCC 51105)和铜绿假单胞菌(PseudomonasaeruginosaCMCC 10104),均购自北京医田生物技术有限公司;34种药敏纸片,均购自上海源叶生物科技有限公司。
1.2 主要仪器 KG-SX-500高压灭菌锅,购自上海珂淮仪器有限公司;SW-CJ-1FD无菌超净台、NRY-2102C恒温培养箱和摇床,均购自上海昕仪仪器仪表有限公司;UV-3600Plus紫外可见分光光度计,购自屹谱仪器制造(上海)有限公司;ProFlex PCR仪,购自赛默飞世尔科技(中国)有限公司。
1.3 试验材料 利用网捕法在青海省海北藏族自治州海晏县境内捕获高原兔2只,及时运回实验室,用注射空气造成气体栓塞方法处死后,在实验室无菌条件下进行剖检。采集小肠段和大肠段内容物共4份样本,冻存于-80 ℃冰箱,用于16S rDNA扩增子测序。同时采集高原兔新鲜粪便数枚,混合后置于4 ℃冰箱,用于肠道微生物分离培养。动物捕获及样本采集严格遵守青海大学医学院医学伦理委员会的相关规定。
1.4 试验方法
1.4.1 16S rDNA扩增子测序及生物信息分析 所有待测小肠段和大肠段内容物样本按照细菌基因组DNA提取试剂盒说明书的操作方法,进行微生物基因组DNA的提取。利用1%琼脂糖凝胶电泳检测抽提的基因组DNA。以微生物基因组DNA为模板,对细菌16S rDNA的V4~V5区域进行PCR扩增。由北京奥维森基因科技有限公司进行基于MiSeq平台(PE 2×300 bp)的16S rDNA建库和高通量测序。
生物信息分析:首先,对原始测序数据进行一系列质量控制,得到可用于后续分析的高质量纯净序列(Clean reads)。然后,进行操作分类单元(Operational Taxonomic Units,OTU)分析,使用Uparse(Version 7.0.1090)方法进行OTU聚类,序列相似性设为97%,得到OTU代表序列。使用Usearch_global方法将优化序列比对OTU代表序列,得到各个样品的OTU序列丰度统计表。为了得到每个OTU对应的物种分类信息,采用RDP classifier(Version 2.2)对97%相似水平的OTU代表序列进行物种组成分析,置信度阈值设为0.8,并在各个分类水平(界、门、纲、目、科、属)统计每个样本的微生物群落组成。细菌分类比对的参考数据库是Silva 16S rRNA database(Release128 http://www.arb-silva.de)。最后利用R语言绘制OTU水平韦恩图。
1.4.2 细菌分离与纯化 在无菌条件,将高原兔粪便样本放入1 mL无菌水中,3 000 r/min离心5 min。取离心后悬液100 μL,从10倍开始对悬液进行10倍梯度稀释至109倍。分别取稀释倍数为10、103、105、107和109的悬液涂布在LB、MRS、M17和LBS琼脂培养基表面,有氧条件下,在培养箱中恒温培养24~48 h。挑选表征(颜色、大小、形状)不同的单菌落在上述肉汤中培养12 h后,再次在相应的琼脂培养基上进行单菌落培养分离。重复上述步骤5次,直至得到纯化的单菌落。
1.4.3 基于16S rRNA基因的菌种鉴定 提取纯化单菌落总DNA,利用细菌16S rRNA基因通用扩增引物对[上游引物7F:5′-CAGAGTTTGATCCTGGCT-3′;下游引物1540R:5′-AGGAGGTGATCCAGCCGCA-3′,引物由生工生物工程(上海)股份有限公司合成]进行PCR扩增。取10 μL PCR扩增产物,用1%琼脂糖凝胶电泳进行检测。将PCR扩增阳性的产物送往生工生物工程(上海)股份有限公司进行一代测序。将测序结果基于NCBI的BLAST程序进行序列相似性比对,明确细菌的分类水平。并将同一种细菌的最长序列作为代表性序列提交至NCBI的GenBank数据库。运用MEGA X软件,以Maximum composite likelihood模型计算遗传距离,采用邻接法(Neighbor-joining,NJ)构建系统进化树,Bootstrap自展1 000次检验进化树拓扑结构置信区间,以痰液弯曲菌(Campylobactersputorumstrain ATCC 33709)为外类群。
1.4.4 药敏试验 采用药敏纸片琼脂扩散法(K-B法),将麦氏度调节为0.5的菌液均匀涂在琼脂培养基上,贴上34种药敏纸片,每种药敏纸片重复3片。培养箱中37 ℃培养14 h后测量抑菌圈直径,并依据中华人民共和国卫生行业标准《抗菌药物敏感性试验的技术要求(WS/T 639—2018)》[4]判定结果。
1.4.5 抑菌试验 利用牛津杯法测定2种潜在有益菌株对5种病原菌的抑菌圈大小。分别在LB和LBS琼脂平板上加入50 μL病原菌菌液,并涂布均匀。在培养基表面等距离摆放牛津杯并轻轻按压,使其与培养基接触无空隙。在牛津杯中加入2种潜在有益菌株菌液各200 μL,培养24 h后,测定抑菌圈的大小。每种菌株做3次重复。
2 结果
2.1 16S rDNA扩增子测序及生物信息分析 高原兔小肠部位的菌群在菌门水平主要由拟杆菌门(Bacteroidetes)22.30%、厚壁菌门(Firmicutes)20.02%、互养菌门(Synergistetes)2.92%、放线菌门(Actinobacteria)1.07%组成;大肠部位的菌群在菌门水平主要由厚壁菌门16.70%、放线菌门14.24%、拟杆菌门11.43%、蓝细菌门(Cyanobacteria)1.87%组成(图1A)。高原兔小肠部位相对丰度大于1.00%的菌属包括:理研菌科RC9肠道群(RikenellaceaeRC9 gut group)8.47%、拟杆菌属(Bacteroides)7.89%、克里斯滕森菌科R-7群(ChristensenellaceaeR-7 group)7.26%、dgA-11 gut group 2.87%、金字塔杆菌属(Pyramidobacter)2.28%、瘤胃球菌属(Ruminococcus)2.21%、月形单胞菌属(Selenomonas)1.78%、芽孢杆菌属(Bacillus)1.39%、副拟杆菌属(Parabacteroides)1.21%、臭味杆菌属(Odoribacter)1.21%;高原兔大肠部位相对丰度大于1.00%的菌属包括:肠杆菌属(Enterorhabdus)10.28%、拟杆菌属7.33%、芽孢杆菌属3.44%、克里斯滕森菌科R-7群3.04%、红蝽杆菌科UCG-002属(CoriobacteriaceaeUCG-002)1.64%、理研菌科RC9肠道群1.54%、副拟杆菌属1.13%(图1B)。OTU水平的韦恩图显示,高原兔小肠和大肠部位微生物OTU总数为452,小肠部位微生物OTU数小于大肠部位微生物OTU数,2个部位共有微生物OTU数高达254(图2)。
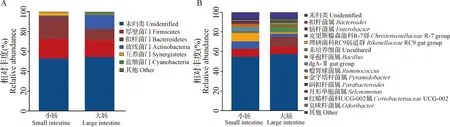
图1 高原兔小肠和大肠部位菌群在门水平(A)和属水平(B)上的组成
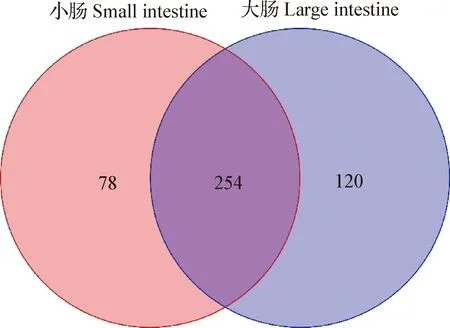
图2 高原兔小肠和大肠部位菌群OTU分布韦恩图
2.2 细菌分离与纯化以及基于16S rRNA基因的菌种鉴定 经5轮纯化后,最终获得25个单菌落。经生工生物工程(上海)股份有限公司进行一代测序后,获得所有25个单菌落的16S rRNA基因序列。将所有测序序列利用NCBI的BLAST程序进行序列相似性比对,发现这些菌株隶属于3门、6属、9种,分别是萎缩芽孢杆菌(Bacillusatrophaeus)、巨大芽孢杆菌(Bacillusmegaterium)、运动芽孢杆菌(Bacillusmobilis)、耐久肠球菌(Enterococcusdurans)、蒙氏肠球菌(Enterococcusmundtii)、托尔豪特链球菌(Streptococcusthoraltensis)、大肠埃希菌(Escherichiacoli)、神户肠杆菌(Enterobacterkobei)、柠檬节杆菌(Arthrobactercitreus)。将上述每个种的最长序列作为代表性序列提交到NCBI的GenBank数据库获得登录号,并构建系统进化树。由图3可知,不同分离菌株与相应参考菌株亲缘关系较近,均处系统进化树同一分支。

图3 基于16S rRNA基因序列的系统进化树
2.3 药敏试验 结果如表1所示,9种菌株对3~27种抗菌药物表现出耐药性。其中,耐久肠球菌、蒙氏肠球菌、运动芽孢杆菌、神户肠杆菌可耐受的抗菌药物至少有14种,而托尔豪特链球菌、萎缩芽孢杆菌、巨大芽孢杆菌可耐受的抗菌药物低于5种。进一步从抗菌药物抑制细菌的角度进行分析,发现有15种抗菌药物能够抑制本试验中分离的6~9种菌株,分别是哌拉西林、头孢西丁、甲氧苄胺嘧啶、头孢他啶、头孢拉定、厄他培南、诺氟沙星、氨苄青霉素、头孢唑林、丁胺卡那、链霉素、氧氟沙星、环丙氟哌酸、多西环素、左氧氟沙星;其中左氧氟沙星可抑制分离到的9种菌株;而吉他霉素、氨曲南、克林霉素、制霉菌素、林可霉素对6~9种分离菌株无抑制作用,其中制霉菌素和林可霉素对所有分离到的菌株均无抑制作用。
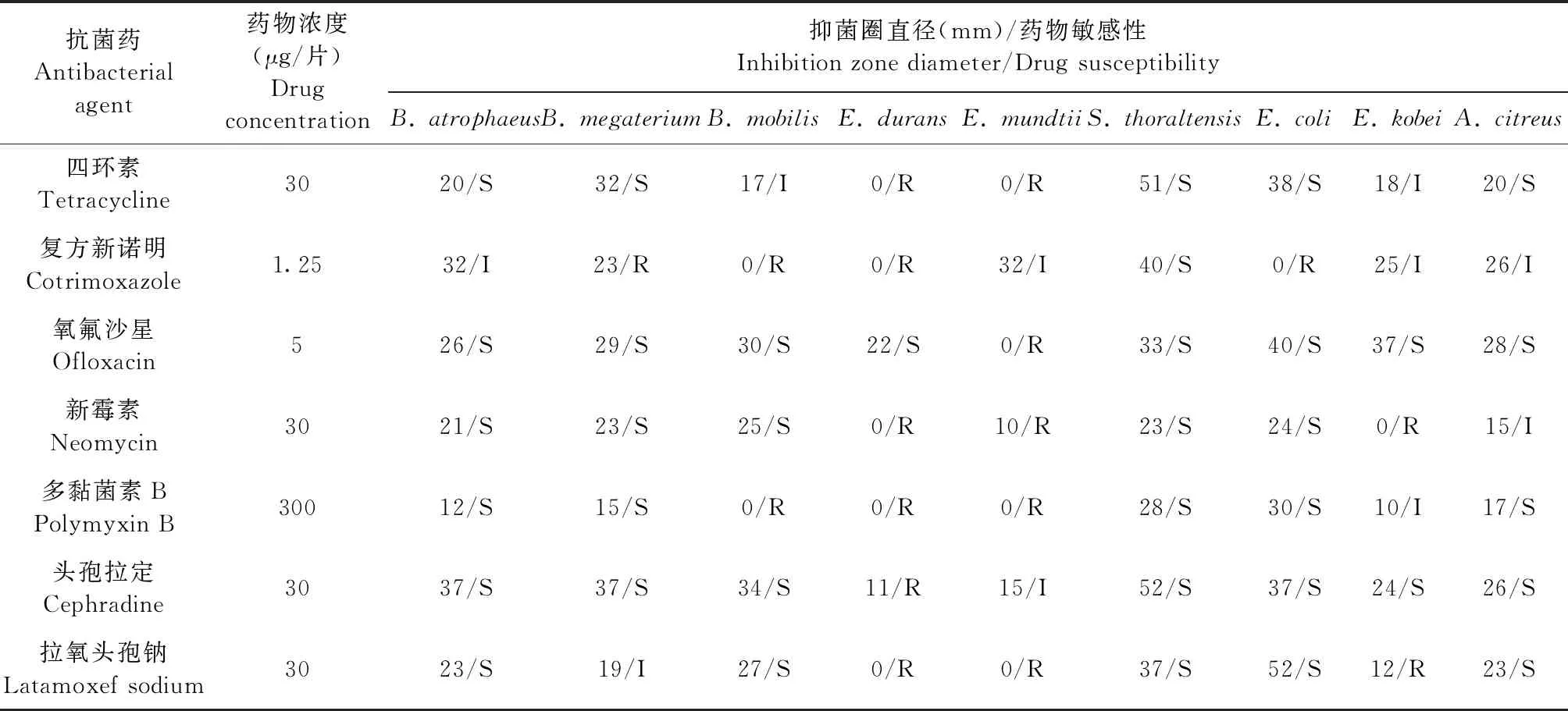
表1 分离菌株药敏试验
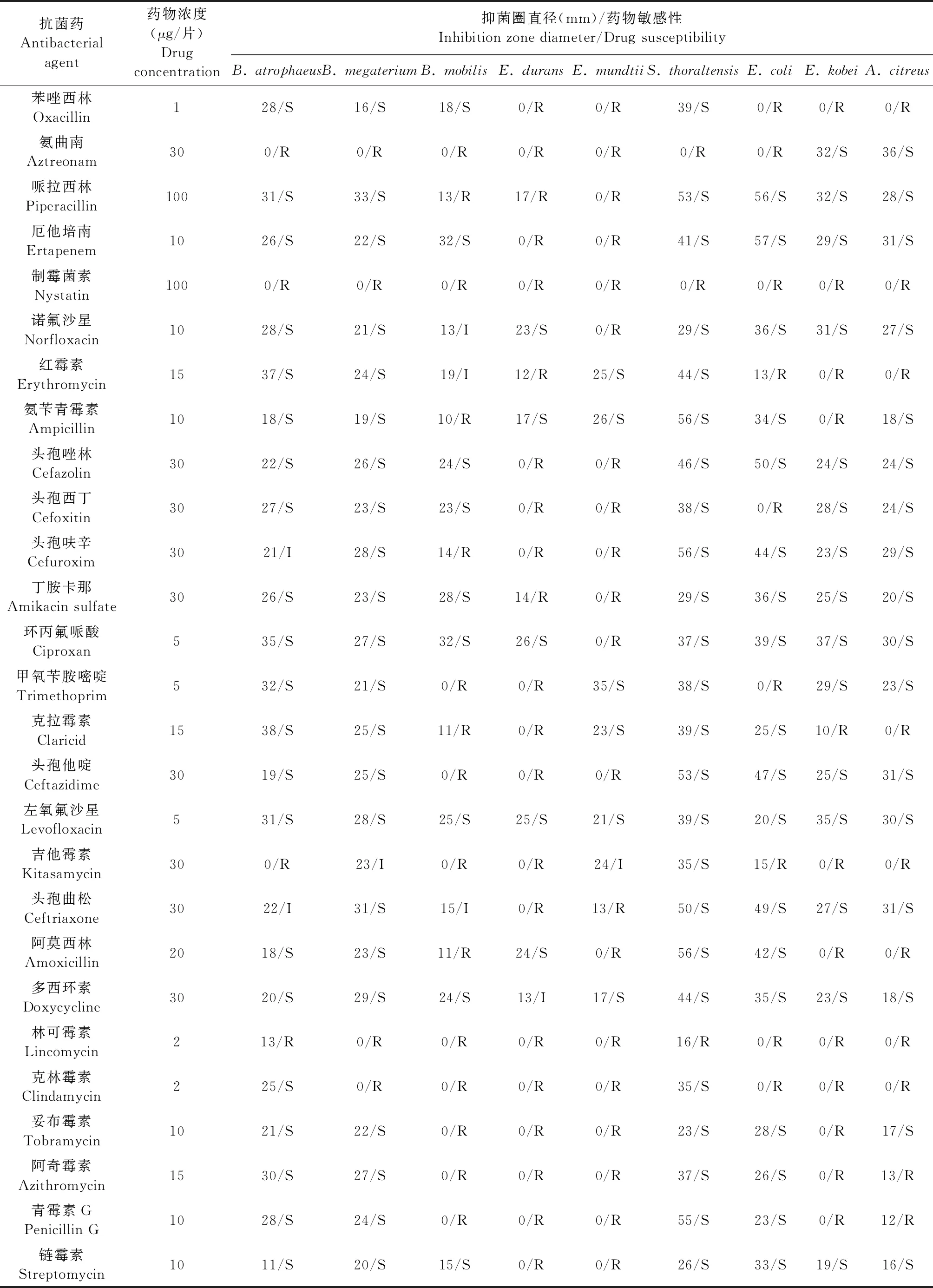
续表
2.4 抑菌试验 选取本试验分离到的2株肠球菌进行抑菌试验。由图4可知,蒙氏肠球菌对5种肠道病原菌均有一定的抑制效果,尤其对肠炎沙门菌、铜绿假单胞菌的抑制效果较好;耐久肠球菌对肠炎沙门菌、金黄色葡萄球菌的抑制效果较好,而对另外3种肠道病原菌无抑制效果。
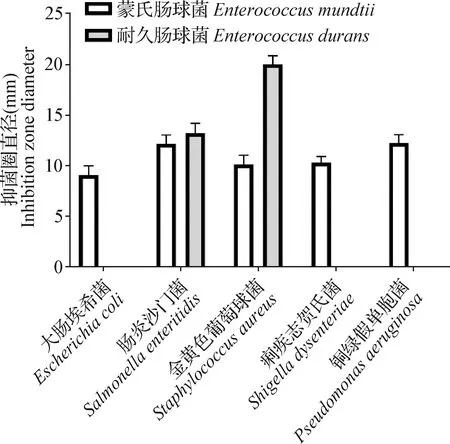
图4 两种菌株对5种肠道病原菌的抑制效应
3 讨论
本试验综合利用16S rDNA高通量测序技术和细菌培养分离技术,分别从肠道微生物种类和分离菌株耐药性、抑菌性2个方面揭示高原兔肠道菌群特征。16S rDNA高通量测序结果揭示高原兔小肠和大肠部位微生物组成的整体特征,小肠部位菌群主要由厚壁菌门和拟杆菌门组成;大肠部位菌群除上述2种菌门外,还包括放线菌门。该结果与宋冰等[5]对工厂兔、散养兔和野兔盲肠菌群研究结果一致。这3种菌门也是脊椎动物普遍共栖的肠道微生物类别[2]。属水平结果显示,小肠和大肠部位微生物的优势菌群在种类上存在一定相似性,均含有拟杆菌属、芽孢杆菌属、克里斯滕森菌科R-7群、理研菌科RC9肠道群、副拟杆菌属。食性被认为是影响动物肠道菌群组成的重要因素之一,动物借助肠道菌群消化、吸收食物中的营养物质,进而适应其特有食性[6]。高原兔的植食特性有利于在纤维物质消化中起主要作用的厚壁菌门、拟杆菌门细菌在肠道内定殖和生长[7]。比如,拟杆菌门的拟杆菌属被认为与纤维素、淀粉和果胶等复杂多糖消化有关[8]。Tavella等[9]研究表明,大量的克里斯滕森菌与理研菌科成员通过降低内脏脂肪含量对相关的心血管和代谢性疾病产生保护效应,进而对机体健康发挥有益作用。本试验发现,高原兔小肠与大肠部位存在特异OTU,可能与肠道不同部位的结构和生理功能有关。而高达56.19%的OTU为高原兔小肠与大肠共有,提示这些微生物稳定存在于高原兔肠道微生物群落中,可能发挥核心生理功能。未来可借助宏基因组学手段深入研究核心菌群的基因功能和代谢通路等。
基于细菌培养分离技术,本试验利用4种培养基共获得9种高原兔肠道菌株,隶属于3门、6属。目前,培养组学多应用于人体、经济动物和模式动物的肠道菌群培养,野生动物肠道菌群的培养工作相对滞后。较之于菌群高通量测序结果,本试验分离的菌株较少。究其原因,一方面,本试验使用的培养基类型及培养条件较为单一,难以覆盖绝大多数菌株的生长条件;另一方面,本试验以粪便为材料进行菌群培养,并不能完全代表真实的肠道菌群状况。本试验分离菌株中,神户肠杆菌、蒙氏肠球菌、托尔豪特链球菌、柠檬节杆菌所占比例较高。王恩召等[10]研究发现,神户肠杆菌可通过释放3-甲基丁酸进而对小孢根霉(Rhizopusmicrosporus)产生抑制作用。王雅君等[11]从雉鸡嗉囊中分离筛选到1株蒙氏肠球菌Sna,具有较强的抗氧化活性和胆固醇清除活性。托尔豪特链球菌为条件致病菌,可引起脓胸、感染性心内膜炎、菌血症等[12]。李俊琴[13]分离的藏羚羊和高原鼠兔肠道菌群中,柠檬节杆菌是二者共有的优势菌种。本试验发现的2种肠球菌,蒙氏肠球菌和耐久肠球菌,对5种常见肠道致病菌表现出一定的抑制能力,提示未来潜在的应用价值[14]。以上结果表明,高原兔肠道菌群中致病菌和有益菌共存,是高原兔宿主与肠道菌群协同演化、相互适应的结果。这些分离菌株丰富了高原兔可培养肠道菌株资源,不仅为进一步优化培养条件以分离更多高原兔源菌株提供参考,而且为适于家兔养殖业的高原兔源有益菌株研发奠定基础。
动物源细菌的抗菌药耐药性在全球范围内蔓延,耐药细菌和耐药基因在“动物、食品、环境和人群”链条内流通,严重威胁着人类公共卫生安全[15]。药敏试验结果显示,9种分离菌株对3~27种抗菌药物表现出耐药性,而制霉菌素、林可霉素对所有分离到的菌株均无抑制作用。因此推测高原兔肠道耐药菌株可能来自与其共享草地及水源的牦牛、藏羊等家养动物。高原畜牧养殖业中广泛使用的治疗性抗菌药使得家养动物肠道菌群面临高选择性压力,产生耐药菌株和耐药基因,并随着家养动物粪便转移至高原生态环境中,进一步导致耐药菌株和耐药基因在不同高原野生动物之间传播[16]。本试验结果增添了对高原兔肠道菌株耐药性的新认识,为后续深入探讨“高原家养动物粪便—环境(土壤、水源、草地)—野生动物”的潜在传播路径提供基础数据。
