产地加工与炮制一体化工艺对秦皮饮片抗炎作用的影响*
2018-10-30赵重博邹俊波吴建华李晓尧史亚军王昌利
赵重博,王 晶,邹俊波,吴建华,李晓尧,史亚军,王昌利
(陕西中医药大学药学院 咸阳 712046)
秦皮为木犀科植物苦枥白蜡树Fraxinus rhynchophylla Hance、白蜡树 Fraxinus chinensis Roxb.、尖叶白蜡树Fraxinus szaboana Lingelsh.或宿柱白蜡树Fraxinus stylosa Lingelsh.的干燥枝皮或干皮,主产于陕西,春秋两季采收[1],尤以3-4年生的干皮药材质量为好。秦皮为清热燥湿药,传统用于治疗湿热泻痢、目赤肿痛等症,现临床上多用于治疗肠炎、慢性支气管炎、细菌性痢疾、目赤肿痛、牛皮癣等症[2]。现代药理研究表明秦皮有抗炎、镇痛、抗氧化、利尿的作用[3],这与秦皮所含的香豆素类、酚类、皂苷、鞣质、生物碱等成分有关,其中秦皮甲素、秦皮乙素、秦皮素等香豆素类成分是秦皮药材质量控制的指标成分[4]。
秦皮饮片的炮制方法为秦皮药材除去杂质,洗净,润透,切丝,干燥。而目前市场上的秦皮饮片多存在不去粗皮或粗皮去不净的现象,严重影响秦皮的临床疗效和调剂时的剂量准确性。皮类药材市场上多以面积大小来显示药材等级[5],由于秦皮药材价格便宜,且采收费时费力,导致药农在采收时只采生长年限长(尤其5年以上[6])的树皮,虽然这些树皮面积大,但是纤维性很强、栓皮部位很厚。秦皮药材产地加工的时候为彰显药材等级,多进行简单的切割压成整张的大树皮后干燥,尽可能地保证树皮的完整,不要求去粗皮直接干燥。这样的树皮在饮片厂即使反复闷润也很难刮去粗皮,因此很多饮片厂生产的秦皮不去粗皮,这样不仅难以保证有效部位的含量,且秦皮切丝多采取横切,干燥后秦皮丝出现分层或韧皮部与栓皮部分离的现象,既不美观,也容易掉渣。且秦皮药材长时间反复闷润,由于秦皮甲素等香豆素类成分可溶于水,容易导致此类有效成分的流失。
有学者对秦皮进行了产地加工与饮片炮制一体化技术研究[7],认为采用一体化加工的秦皮饮片相较于传统加工炮制方法的秦皮饮片中的有效成分含量有所增加。但仅从化学成分含量的角度对传统工艺和一体化生产工艺进行了比较,没有对这2种工艺加工的饮片药理作用进行研究。因此本实验对一体化加工和传统方式加工的秦皮饮片进行了主要功效的研究,进一步评价一体化生产方式的可行性,在确保饮片质量及其功效的前提下建立规范的秦皮饮片生产工艺。
1 材料
1.1 仪器
U3000型反相高效液相色谱仪(美国戴安);AR1140型电子天平(万分之一,梅特勒-托利多仪器,(上海)有限公司);DZF-6050真空干燥箱(上海欣齐科学仪器有限公司);KH-400-KDE型高功率数控超声波清洗器(昆山禾创超声仪器有限公司);QE-300 g粉碎机(浙江屹立工贸有限公司);iMark酶标仪18485(美国BIO-RAD公司)。
1.2 动物
SD大鼠,50只,雄性,SP F级,体重(165±15)g,购自西安交通大学医学部实验动物中心,动物合格证号SCXK(陕)2012-003。
1.3 试药
秦皮药材于2017年7月采自于陕西省宝鸡市,由陕西中医药大学药学院王昌利教授鉴定为木犀科植物宿柱白蜡树Fraxinus stylosa Lingelsh.的干燥干皮,凭证标本保存于陕西中医药大学炮制教研室。传统秦皮饮片(秦皮-1)和产地加工炮制一体化秦皮饮片(秦皮-2)均为实验室自制。秦皮甲素、秦皮乙素、秦皮素对照品(购于中国食品药品检定研究院,HPLC≥98%,批号:秦皮甲素110740-200104、秦皮乙素110741-200607,秦皮素111731-200501);秦皮苷对照品购自西玛实验室,HPLC≥98%;戊巴比妥钠(中国医药(集团)上海化学试剂公司,批号F20090417);甲醇、磷酸均为分析纯(成都市科龙化工有限公司);乙腈为色谱纯(赛默飞世尔中国有限公司);水为娃哈哈纯净水;阿司匹林肠溶片(辰欣药业股份有限公司,批号为BJ27748);λ-角叉菜胶(美国Sigma公司,22049-5G-F);白细胞介素1β(IL-1β)、肿瘤坏死因子-α(TNF-α)、丙二醛(MDA)、超氧化物歧化酶(SOD)酶联免疫吸附试验(ELISA)试剂盒均购自南京森贝伽生物科技有限公司。
2 实验方法
2.1 样品制备
2.1.1 传统秦皮饮片制备
取新鲜秦皮药材,自然干燥,快速淋洗去除附着杂质,加水闷润至内外水分一致,刮去粗皮,切宽丝,70℃恒温烘箱中干燥4 h,记为秦皮-1。
2.1.2 一体化加工秦皮饮片制备
取新鲜秦皮药材,刮去粗皮,快速淋洗去除附着杂质,切6 mm丝,70℃恒温烘箱中干燥4 h,记为秦皮-2。
2.2 秦皮饮片水提物的制备取
两种秦皮饮片各称取500 g,分别依次加水浸泡30 min,再加10倍量水煎煮2次,每次1.5 h,合并水煎液浓缩,真空干燥,即得传统秦皮饮片水提物(秦皮-1#)和一体化加工秦皮饮片水提物(秦皮-2#)50.2 g,47.3 g。
2.3 药理作用比较
2.3.1 造模及给药
SD大鼠50只适应性喂养7 d后,随机分为5组,即空白组、模型组、传统秦皮饮片水提物组、一体化工艺秦皮饮片水提物组、阿司匹林组,每组各10只。称重并给药,各组实验动物给药剂量如下,两组秦皮饮片提取物组7.2 g·kg-(1按生药量算)[8],阿司匹林组0.225 g·kg-1(去薄膜包衣),模型组和空白组灌胃10 mL·kg-1生理盐水,每天灌胃1次,连续8 d。最后一次灌胃结束1 h后,除空白组外,其余大鼠右足趾部皮下注射1%角叉菜胶溶液0.1 mL致炎[9],空白组注射0.1 mL生理盐水,标记右足测量部位,分别在致炎前与致炎后1,2,3,4,5 h测量右足厚度,参考文献方法计算大鼠足肿胀度[10]。足肿胀度=致炎后足厚度-致炎前足厚度。
2.3.2 血样采集及指标测定
足肿胀测定完成后,以1%戊巴比妥钠溶液(40 mg/kg)麻醉大鼠,腹主动脉取血,血样在室温下静置1 h。3000 rpm离心10 min,小心吸取上清液即得到血清,保存-20℃冰箱备用。按照ELISA试剂盒说明书测定血清中的IL-1β,TNF-α,MDA含量及SOD(超氧化物歧化酶)活性。
2.3.3 统计处理
2.4 主要化学成分的含量测定
2.4.1 色谱条件[11-12]
色谱柱:Betasil C18柱(250 mm×4.6 mm,5 μm);流动相:乙腈-0.1%磷酸水溶液(12:88);检测波长:334 nm;柱温:30℃;流速:1 mL·min-1;进样量:10 μL。
2.4.2 对照品溶液的制备
分别精密称取秦皮甲素、秦皮乙素、秦皮素、秦皮苷对照品适量,加甲醇溶解并配制成含秦皮甲素0.33 mg ·mL-1、秦 皮 苷 0.13 mg ·mL-1、秦 皮 乙 素0.21 mg·mL-1、的秦皮素0.16 mg·mL-1混合标准品溶液,混匀备用。
2.4.3 供试品溶液的制备
分别取秦皮-1#样品和秦皮-2#样品约0.5 g粉末(过三号筛),精密称定,置具塞圆底烧瓶中,再精密加入50 mL甲醇,密塞,称定总重量,加热回流1 h,放冷,拆下,再称定总重量,用甲醇补足失重,摇匀,滤过,取续滤液过0.45 μm微孔滤膜,即得秦皮-1#溶液和秦皮-2#溶液。
2.4.4 样品测定
分别精密吸取秦皮香豆素混标溶液、秦皮-1#样品溶液和秦皮-2#样品溶液10 μL,注入高效液相色谱仪,记录色谱图像和数据并进行计算。
2.5 理化鉴别检查
根据《中华人民共和国药典》2015年版收载的秦皮饮片项下的规定对秦皮-1#和秦皮-2#饮片样品分别进行检查,包括性状、鉴别、检查和浸出物测定。
2.5.1 性状
按照《中华人民共和国药典》2015年版收载的秦皮饮片项下的性状描述与制备的秦皮饮片进行对比并记录。
2.5.2 鉴别
(1)荧光反应:
分别取秦皮-1#和秦皮-2#饮片粉末,加热水浸泡,浸出液在日光下观察出现的情况。
(2)薄层鉴别:
供试品溶液的制备:称取2种秦皮饮片样品粉末1 g,加10倍量甲醇回流10 min,滤过,取续滤液即可。
对照品溶液的制备:精密称定秦皮甲素标准品、秦皮乙素标准品、秦皮素标准品各20 mg至10 mL容量瓶,加甲醇补至刻度,制成每1 mL含秦皮甲素标准品、秦皮乙素标准品及秦皮素标准品分别为2 mg的对照品混合溶液。
测定法:,吸取上述两种溶液各10 μL,分别点于同一硅胶G薄层板薄层板上,以三氯甲烷-甲醇-甲酸(6·1·0.5)为展开剂,展开,取出,晾干,置紫外光灯(365 nm)下检视。
2.5.3 检查
(1)水分测定:
分别取3份秦皮-1#和秦皮-2#饮片粉末,每份5 g(过二号筛),平铺于干燥至恒重的扁形称量瓶中,精密称定,开启瓶盖在105℃的烘箱干燥5 h,将瓶盖盖好,移置干燥器中,放冷30 min,精密称定,再开启瓶盖在105℃的烘箱干燥1 h,放冷,称重,至连续两次称重的差异不超过5 mg为止。根据减失的重量,计算供秦皮-1#和秦皮-2#饮片含水量(%)。
(2)总灰分:
分别取3份秦皮-1#和秦皮-2#饮片粉末,每份3g(过二号筛),置炽灼至恒重的坩埚中,称定重量,在马弗炉中程序升温至完全炭化,逐渐升高温度至600℃,使完全灰化并至恒重。根据残渣重量,计算秦皮-1#和秦皮-2#饮片中总灰分的含量(%)。
2.5.4 浸出物
分别取3份秦皮-1#和秦皮-2#饮片粉末,每份3 g(过二号筛),精密称定,置250 mL的锥形瓶中,精密加95%乙醇100 mL,密塞,称定重量,静置1h后,连接回流冷凝管,加热至沸腾,并保持微沸1h。放冷后,取下锥形瓶,密塞,再称定重量,用水补足减失的重量,摇匀,用干燥滤器滤过,精密量取滤液25 ml,置已干燥至恒重的蒸发皿中,在水浴上蒸干后,于105℃干燥3 h,置干燥器中冷却30 min,迅速精密称定重量。分别计算秦皮-1#和秦皮-2#饮片醇溶性浸出物的含量(%)。
3 实验结果
3.1 不同工艺秦皮饮片抗炎测定结果
测定各组大鼠的右足厚度,计算各组大鼠的足肿胀度,结果见表1,测定各组大鼠血清中IL-1β、TNF-α、SOD、MDA的活性,结果见表2。
大鼠注射角叉菜胶后,除空白组外,各组大鼠右足相继表现出肿胀的现象,在第4个小时的时候,一体化秦皮饮片组和传统秦皮饮片组的大鼠足肿胀程度开始出现抑制,而阿司匹林组在2 h就表现出抑制作用。血清炎症因子的检测结果表面,模型组与空白组比较,IL-1β、TNF-α、MDA的活性均显著升高,SOD的活性显著降低;与模型组相比,一体化秦皮饮片组、传统秦皮饮片组、阿司匹林组的IL-1β、TNF-α、MDA的活性均显著降低,SOD的活性显著升高;一体化秦皮饮片组与传统秦皮饮片组相比,IL-1β、TNF-α、MDA的活性有所降低,SOD的活性有所升高,但两组间的差异均无显著性。
3.2 不同工艺秦皮饮片香豆素类成分含量测定结果
不同工艺秦皮水提物样品秦皮-1#和秦皮-2#的高效液相结果见图1。分别按10.04%(500 g传统秦皮饮片得秦皮水提物50.2 g)和9.46%(500 g一体化秦皮饮片得秦皮水提物47.3 g)还原为秦皮饮片的量,即秦皮-1样品中秦皮甲素、秦皮苷、秦皮乙素和秦皮素的质量分数分别为0.72%,0.43%,0.21%,0.18%,四种成分之和为1.54%;这些成分在秦皮-2样品中的质量分数分别为1.13%,0.62%,0.37%,0.19%,四种成分之和为2.31%,即一体化秦皮饮片的主要香豆素类成分为传统秦皮饮片水提物的1.5倍,且《中华人民共和国药典》规定的秦皮甲素和秦皮乙素的总量约为其1.6倍。
表1 各组大鼠足肿胀度(s,cm)
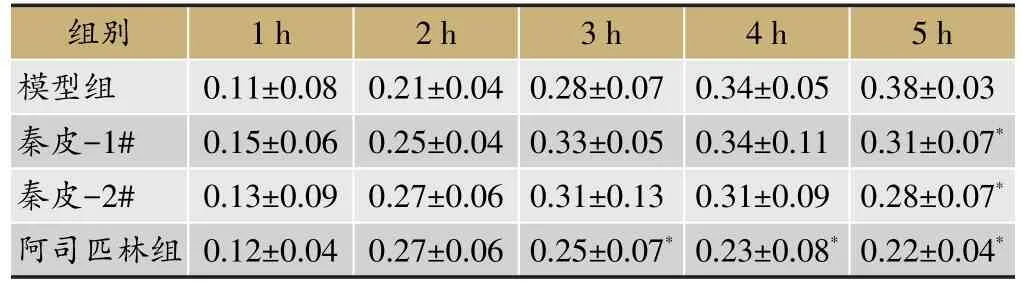
表1 各组大鼠足肿胀度(s,cm)
注:与模型组比较,*P<0.05;一体化秦皮饮片组与传统秦皮饮片组相比,▲P<0.05
5 h 0.38±0.03 0.31±0.07*0.28±0.07*0.22±0.04*组别模型组秦皮-1#秦皮-2#阿司匹林组1 h 0.11±0.08 0.15±0.06 0.13±0.09 0.12±0.04 2 h 0.21±0.04 0.25±0.04 0.27±0.06 0.27±0.06 3 h 0.28±0.07 0.33±0.05 0.31±0.13 0.25±0.07*4 h 0.34±0.05 0.34±0.11 0.31±0.09 0.23±0.08*
表2 各组大鼠血清中IL-1β、TNF-α、SOD、MDA含量(s,n mol/mL)
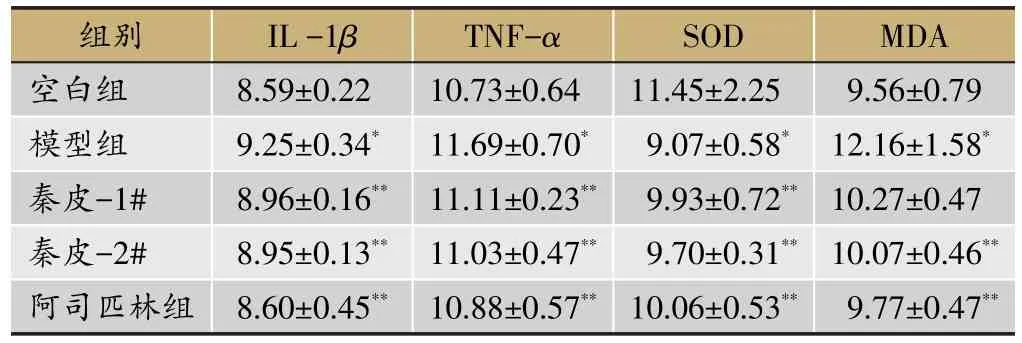
表2 各组大鼠血清中IL-1β、TNF-α、SOD、MDA含量(s,n mol/mL)
注:与空白组比较,*P<0.05;与模型组比较,**P<0.05;一体化秦皮饮片组与传统秦皮饮片组相比,▲P<0.05
MDA 9.56±0.79 12.16±1.58*10.27±0.47 10.07±0.46**9.77±0.47**组别空白组模型组秦皮-1#秦皮-2#阿司匹林组IL-1β 8.59±0.22 9.25±0.34*8.96±0.16**8.95±0.13**8.60±0.45**TNF-α 10.73±0.64 11.69±0.70*11.11±0.23**11.03±0.47**10.88±0.57**SOD 11.45±2.25 9.07±0.58*9.93±0.72**9.70±0.31**10.06±0.53**

图2 秦皮饮片
3.3 不同工艺秦皮饮片理化鉴别检查结果
3.3.1 性状比较
秦皮-1#和秦皮-2#饮片的外观性状图见图2,其中:
秦皮-1#:本品长短不一的宽丝,丝宽9-12 mm。外表面灰棕色或黑棕色。内表面黄白色或棕色,平滑。切面纤维性。质硬。气微,味苦。
秦皮-2#:本品长短不一的宽丝,丝宽5-6 mm。外表面灰棕色或黑棕色。内表面黄白色或棕色,平滑。切面纤维性。质硬。气微,味苦。
由以上结果可知秦皮-1#和秦皮-2#均符合《中华人民共和国药典》2015年版秦皮饮片项下的性状描述。但可明显看出,相比秦皮-2#饮片,秦皮-1#饮片存在少部分栓皮,且饮片碎渣较多,这与饮片厂反复干燥且粗皮分离不彻底有一定的关系。
3.3.2 鉴别比较
(1)荧光反应:秦皮-1#和秦皮-2#饮片的荧光反应图见图3,两者在日光下观察,均可见碧蓝色荧光。
(2)薄层鉴别:秦皮-1#和秦皮-2#饮片的薄层色谱图见图4,两者在与秦皮甲素、秦皮乙素和秦皮素相应的位置上,显相同颜色的斑点。
由以上结果可知秦皮-1#和秦皮-2#均符合《中华人民共和国药典》2015年版秦皮饮片项下的鉴别项要求。
3.3.3 检查比较
(1)水分测定结果:秦皮-1#水分测定结果为4.07%±0.25%,秦皮-2#水分测定结果为4.75%±0.19%,由以上结果可知秦皮-1#和秦皮-2#均符合《中华人民共和国药典》2015年版秦皮饮片项下的水分的要求。
(2)总灰分测定结果:秦皮-1#总灰分测定结果为5.35%±0.42%,秦皮-2#总灰分测定结果为5.42%±0.36%,由以上结果可知秦皮-1#和秦皮-2#均符合《中华人民共和国药典》2015年版秦皮饮片项下的总灰分的要求。
3.3.4 醇溶性浸出物含量比较
醇溶性浸出物含量测定结果:秦皮-1#浸出物测定结果为10.43%±2.27%,秦皮-2#浸出物测定结果为11.56%±3.73%,由以上结果可知秦皮-1#和秦皮-2#均符合《中华人民共和国药典》2015年版秦皮饮片项下的浸出物的要求。
4 讨论
本试验以角叉菜胶致大鼠足肿胀作为炎症模型,以降低足肿胀程度和TNF-α、IL-1β、MDA、SOD作为评价指标,考察一体化生产的秦皮饮片与传统秦皮饮片的抗炎药效差异。TNF-α和IL-1β是重要的促炎因子,TNF-α是由巨噬细胞产生的一种能刺激破骨细胞和抑制成骨细胞的细胞因子,能够参与炎症的发生、免疫调节和发热。IL-1β又称淋巴细胞刺激因子,主要通过刺激炎症和自身免疫病相关基因的表达,在免疫调节及炎症进程中扮演着重要的角色。SOD和MDA为可作为自由基基础代谢情况的评价指标,SOD是氧自由基清除体系的关键因子,可降低细胞受到自由基的损害。自由基受损时,可引发脂质过氧化反应,脂质过氧化物反应在炎症及免疫调节过程中起着重要的作用,MDA是脂质过氧化物反应产生的因子,用MDA活性来评价脂质过氧化反应及细胞受损的程度;然而自由基引起脂质过氧化及一些基因的表达,在炎症和免疫过程中起着重要的作用。SOD能催化具有抗炎作用的氧及过氧化氢的生成,得以减轻炎性症状[13-14]。一体化秦皮饮片和传统秦皮饮片水提物能够显著降低炎症大鼠血清中IL-1β、TNF-α、MDA的水平,能够抑制急性炎症的发展程度,同时升高SOD的水平,降低细胞受到自由基的损害发挥抗炎作用。且结果表明一体化秦皮饮片组的抗炎效果略优于传统秦皮饮片组,但两者的抗炎作用之间的差异没有显著性。

图3 秦皮饮片沸水荧光反应
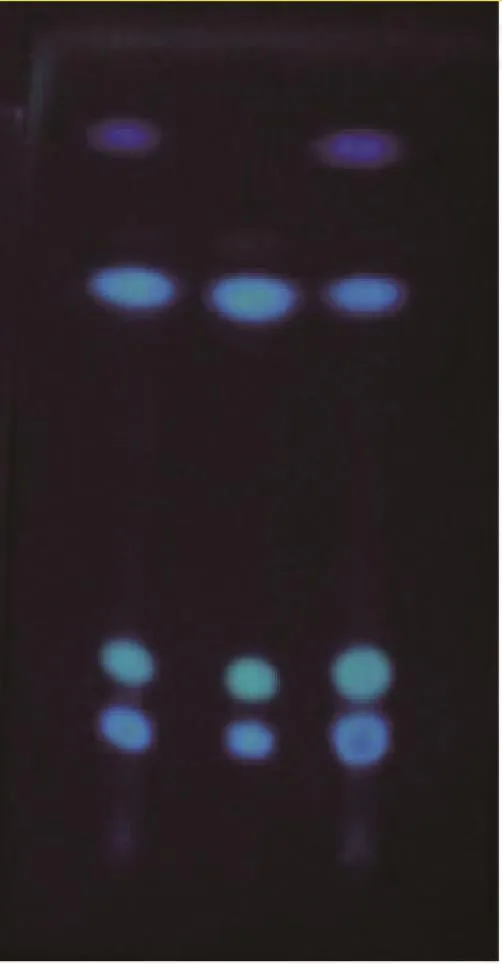
图4 秦皮饮片TLC图
有研究表明,秦皮香豆素类成分(尤其是秦皮甲素和秦皮乙素)具有消炎、镇痛和调节免疫的功效[15-18],这与本次药理实验结果与成分定量测定结果具有一致性,两种饮片水提物中秦皮甲素、秦皮苷、秦皮乙素、秦皮素等4种主要有效成分的含量,这四种香豆素类成分在一体化加工秦皮饮片总量约为传统秦皮饮片的1.5倍,且一体化加工秦皮饮片秦皮甲素和秦皮乙素的含量约为传统秦皮饮片的1.6倍。结合药理实验结果分析,秦皮饮片中香豆素类成分的含量差异是导致其抗炎消肿效果差异的原因,其抗炎机制可能与降低血清中IL-1β、TNF-α、MDA的水平和升高SOD的水平等有关。
按照《中华人民共和国药典》2015年版秦皮饮片项下相关项目对传统加工方式和产地一体化加工方式的秦皮饮片进行检查,结果表明两种方法制备的秦皮饮片均符合药典相关规定,总体来说产地一体化加工方式的秦皮饮片质量优于传统加工方式的秦皮饮片,但是水分检查项传统加工方式的秦皮饮片低于产地一体化加工方式的秦皮饮片,但是也导致秦皮饮片在保存的时候会出现掉渣等情况影响外观。
本文通过对不同加工方式的秦皮饮片进行主要药效作用与化学成分研究,结果表明两者在抗炎消肿功效上以及化学成分组成上均具有较好的相似性。同时,秦皮产地加工与炮制一体化的生产方式,解决了饮片传统生产方式中原料药材软化时间长且软化程度不一致导致饮片质量不稳定的问题以及晒干药材粗皮难以去处的问题,并且大大缩短了加工周期,为秦皮饮片生产模式的变革提供借鉴。