毒害艾美耳球虫山西株的分离和鉴定
2023-03-03郑龙龙吕晓玲郑明学
张 黎,郑龙龙,白 冰,谭 凡,王 辰,吕晓玲,白 瑞,郑明学
(山西农业大学动物医学学院,山西 太谷 030801)
山西省太谷区某蛋鸡场57日龄青年鸡出现精神萎靡、排番茄样粪便等临床症状,发病后3 d死亡率高达30%。剖检病死鸡可见其空肠肿胀变短,浆膜面有多量散在出血点,十二指肠近空肠段浆膜和黏膜出现弥漫性针尖大小出血点,空肠充满紫黑色血样内容物,黏膜有多量出血斑。镜检可见空肠内容物有大量红细胞和多量裂殖体,盲肠内有少量卵囊,粪便中有多量卵囊,疑似感染毒害艾美耳球虫(Eimerianecatrix,E.necatrix)。本试验采用饱和食盐水漂浮法收集被感染病鸡的粪便和盲肠内容物中卵囊,利用单卵囊技术分离纯化得到1株山西省流行虫株,检测其生物学特点,初步确定其虫株类型;随后使用序列特征性扩增区域(Sequence characterized amplified region,SCAR)标记技术进一步确定虫株类型。本试验结果不仅丰富了山西省E.necatrix流行毒株的生物信息,还为鸡球虫疫苗免疫效果评价提供了良好的种子资源。
1 材料与方法
1.1 样品来源 太谷区某鸡场57日龄青年鸡含血粪便和肠道内容物。
1.2 实验动物 50只健康SPF级白来航鸡由购自北京梅里亚维通实验动物技术有限公司的SPF种鸡蛋孵化而来,在隔离器中饲养至50 日龄备用。
1.3 主要仪器和试剂 PCR扩增仪,购自Bio-Rad公司;凝胶成像分析仪,购自北京六一生物科技有限公司;普通光学显微镜,购自Olympus Corporation公司。QIAamp DNA Mini Kit,购自QIAGEN公司;EasyTaq聚合酶、DL1 000 DNA Marker,均购自TaKaRa公司;其他化学试剂,均购自Sigma-Aldrich公司。
1.4 试验方法
1.4.1 单卵囊的分离纯化与卵囊扩增 采用饱和食盐水漂浮法[1]收集感染鸡粪便和肠内容物中的卵囊并计数。
利用单卵囊技术[2]分离纯化虫株。PBS稀释卵囊液至显微镜下观察每滴只有1~2个球虫卵囊,用一次性无菌针头蘸取稀释好的卵囊液滴于明胶玻璃纸,盖上糖衣纸,口服给予10只实验鸡。将感染单个卵囊的鸡隔离饲养144 h,逐只收集粪便,用饱和食盐水漂浮法收集卵囊,涂片法镜检,观察有无球虫卵囊。当检测到卵囊后,用饱和盐水漂浮法收集此后0~24 h和24~48 h粪便中的卵囊。检测到卵囊后48 h取感染鸡盲肠内容物收集卵囊。收集的卵囊混悬于2.5%重铬酸钾溶液,28 ℃通气培养16 h后开始吸取少量卵囊液,显微镜检测卵囊最短孢子化时间(即出现第1个卵囊内形成4个孢子囊的时间),待孢子化率达到85%以上时将卵囊液保存于4 ℃冰箱。
以5 000个/羽的剂量将分离的卵囊口服接种给5只实验鸡,采集接种后144~192 h的粪便,以饱和盐水漂浮法收集卵囊。
1.4.2 虫株生物学特点鉴定 将35只体重相近的50 日龄实验鸡称重后随机分为3个组:空白对照组(C组)10 只,不接种球虫;低剂量接种组(T1组)15只,口服卵囊5.0×104个/羽;高剂量接种组(T2组)10 只,口服卵囊1.1×105个/羽;接种卵囊后每天观察各组鸡只的精神状况和死亡情况。对于死亡鸡,即死即剖检,涂片,苏木精-伊红(Hematoxylin-eosin staining,H.E.)染色镜检观察肠组织病理变化和虫体寄生情况。
于接种后120 h时剖检5只T1组鸡只,肉眼观察其肠道病变,刮取各肠道黏膜,涂片镜检观察裂殖体寄生部位并测定裂殖体大小。
于接种后135 h开始,每小时收集T1组和T2组鸡只粪便,镜检有无球虫卵囊,确定潜隐期。潜隐期后0~48 h收集T1组和T2组粪便,检测卵囊产量和大小,并在潜隐期后48 h时对各组鸡只称重并剖杀,观察肠道病变,刮取各肠道黏膜,镜检观察肠道病理组织学变化,参考Johnson和Reid[5]描述的方法判定肠道病变记分,检测观察卵囊寄生部位,取肠道组织制作石蜡切片进行H.E.染色镜检观察肠道病变。
计算各组鸡只接种当天到剖杀时的平均增重、相对增重率和死亡率,以及平均肠道病变记分。
1.4.3 PCR鉴定与测序分析 提取1.4.1项纯化扩增卵囊的DNA,以提取的DNA作为模板,参考E.necatrixSCAR标记序列[3],设计产物长度为230 bp的特异性引物[4](SCAR-F:5′-GGTACTGACTTCATTCATATTGCG-3′,SCAR-R:5′-ACAACGCCTCATAACCCCAA-3′),委托生工生物工程(上海)股份有限公司合成引物。PCR扩增体系:2×EasyTaq PCR SuperMix 12.5 μL,上、下游引物各0.5 μL,ddH2O 10.5 μL,模板1.0 μL,总体积25.0 μL。PCR反应条件:98 ℃ 2 min;98 ℃ 10 s,60 ℃ 15 s,68 ℃ 30 s,共29个循环;72 ℃延伸5 min。PCR产物送深圳华大基因股份有限公司测序,对测序所得基因序列使用MEGA 11软件Clustal W方法进行进化树分析。
1.5 数据分析 试验结果以“平均值±标准差”方式表示。使用SPSS Statistics 19.0软件对平均增重和平均肠道病变记分进行t检验。P<0.05表示差异显著。
2 结果
2.1 单卵囊分离纯化与卵囊扩增 通过饱和盐水漂浮法从1只感染鸡的粪便和肠道内容物中分离到2.0×105个卵囊。通过单卵囊技术分离到1株纯净的球虫虫株,卵囊最短孢子化时间为18 h,卵囊形态见图1。
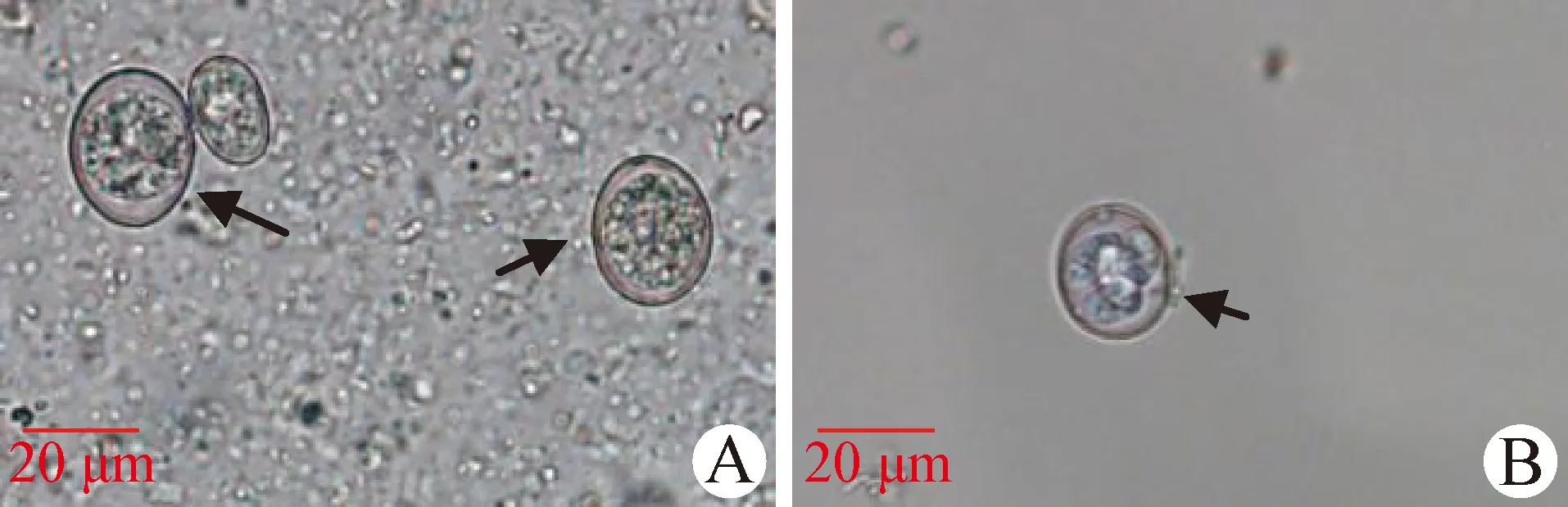
图1 球虫卵囊形态(400×)
2.2 虫株生物学特点鉴定 接种卵囊后120 h T1组和 T2组鸡精神萎靡,排出番茄样带血粪便。剖检T1组5只实验鸡,可见其空肠肠管直径肿胀至正常空肠的2倍以上,长度缩短至仅为正常长度的约1/2,在浆膜面可见多量出血斑和灰白色坏死灶,肠腔内充满血液和组织碎片,病变甚者波及十二指肠(图2B);刮取肠黏膜涂片镜检,十二指肠和盲肠均未见裂殖体,空肠中段有大量成簇的大裂殖体,偶尔见裂殖体破裂,裂殖子从内释放出来,呈月牙形,蜷曲蠕动,裂殖体平均大小为(63.17±7.66) μm×(47.12 ±6.91) μm(图2C)。表明本试验分离球虫主要感染鸡空肠导致病变,裂殖体寄生部位为空肠,且裂殖体较大。
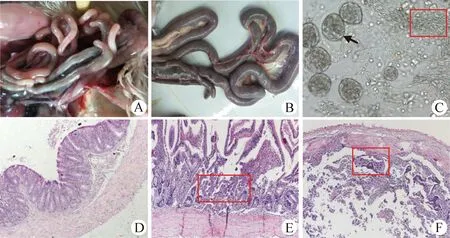
图2 肠道病变和虫体镜检
于接种后152 h在T1组和T2组实验鸡粪便中初次检出卵囊,即该虫株潜隐期为152 h。接种后152~200 h(即潜隐期后0~48 h)T1组和T2组卵囊产量分别为193.67×104个/羽和320.00×104个/羽,T2组鸡只卵囊产量高于T1组(表1),卵囊平均大小为(19.92±0.20) μm×(19.27±0.11) μm。
于接种后144 h,T1组和T2组均出现死亡鸡,剖检发现其空肠病变较120 h时更严重,十二指肠和空肠除含有多量大小不等的裂殖体外,肠内容物含多量脱落的上皮细胞和释放的裂殖子,盲肠段未见裂殖体,染色镜检可见空肠固有层寄生有大量裂殖体,肠绒毛断裂脱落至肠腔,并伴有多量红细胞(图2E)。于接种后168 h剖检T1组和T2组死亡鸡只,眼观病变同144 h,染色镜检见裂殖体数量减少,但是肠绒毛断裂脱落更严重(图2F);于接种后200 h剖杀T1组和T2组存活鸡只,眼观鸡只浆膜面有大量白色结节,肠管高度肿胀,黏膜大量出血,内容物呈红色凝块状或乳酪状凝块。镜检十二指肠和空肠中段见多量裂殖体,未见卵囊,盲肠见有大量卵囊。C组鸡只未出现死亡,剖检肠道未见异常,也未见球虫虫体。表明本试验分离球虫卵囊的寄生部位为盲肠。
综合以上特征,初步判断本试验分离球虫疑似为E.necatrix。
接种后200 h内T1组和T2组鸡只死亡率分别为40%和50%,相对增重率仅为C组的31.61%和20.87%,T1组和T2组的鸡只平均增重均显著低于C组(P<0.05),T2组的平均增重显著低于T1组(P<0.05);T1组和T2组的鸡只平均肠道病变记分均显著高于C组(P<0.05),T1组和T2组的平均肠道病变记分差异不显著(P>0.05)(表1)。

表1 致病力和卵囊产量
2.3 PCR鉴定与测序分析 对PCR扩增获得的阳性产物进行测序分析,结果显示,所分离虫株的SCAR标记基因与E.necatrixKT423374同源性为97.1%,与布氏艾美耳球虫(Eimeriabrunetti,E.brunetti)AY571558、堆型艾美耳球虫(Eimeriaacervulina,E.acervulina)AY571546、巨型艾美耳球虫(Eimeriamaxima,E.maxima)FN813238、和缓艾美耳球虫(Eimeriamitis,E.mitis)AY571598、早熟艾美耳球虫(Eimeriapraecox,E.praecox)KT423376和柔嫩艾美耳球虫(Eimeriatenella,E.tenella)KT985455同源性介于29.8%~41.4%;进化树分析显示,所分离虫株的SCAR标记基因与E.necatrixKT423374虫株位于同一分支,进化同步;与E.brunettiAY571558、E.acervulinaAY571546、E.maximaFN813238、E.mitisAY571598、E.praecoxKT423376、E.tenellaKT985455位于不同分支,进化差异较大(图3),故将本试验分离虫株命名为E.necatrix-CN-SX-2018。
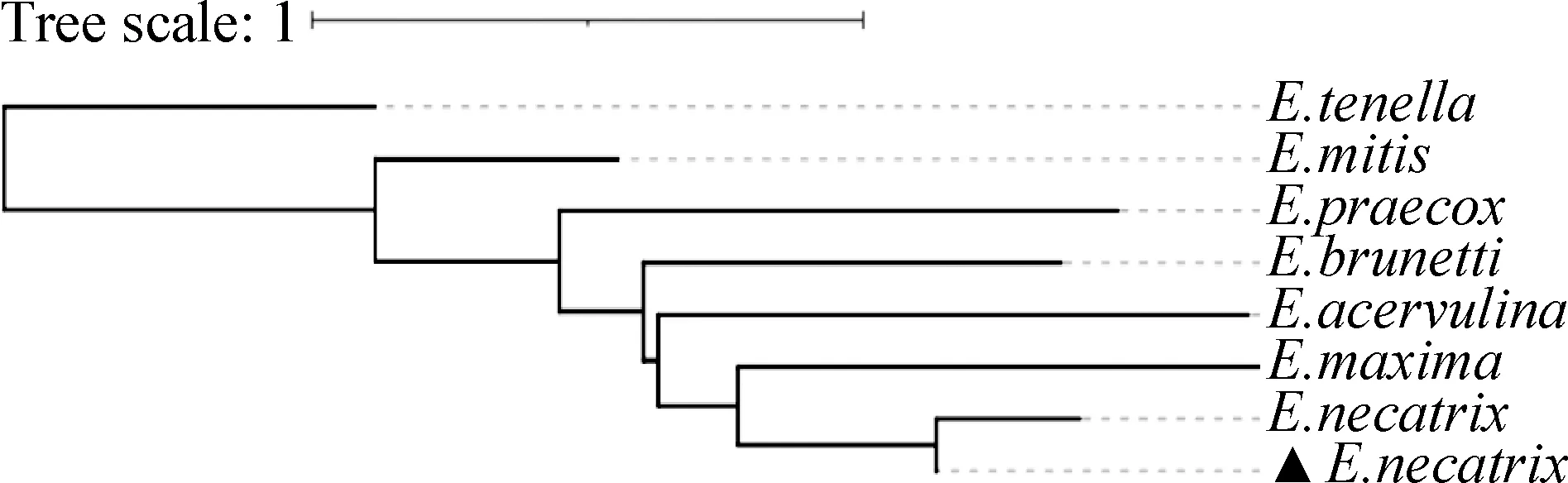
图3 E. necatrix-CN-SX-2018 SCAR标记基因进化树
3 讨论
SCAR标记技术由于需要匹配高特异性长序列,使其保持了高特异性、稳定性和重复性,可准确获得微量寄生虫DNA的高可信度结果,已广泛应用于鸡艾美耳球虫的虫株种类鉴定[6-8]。本试验根据感染鸡只的病变部位、裂殖体寄生部位和大小、卵囊寄生部位和大小、最短孢子化时间等经典生物学特征[9,10],初步判断分离的野生球虫疑似为E.necatrix,结合PCR方法扩增和测序获得E.necatrix特异性SCAR标记序列,确定分离的野生虫株为E.necatrix,并将该虫株命名为E.necatrix-CN-SX-2018。
E.necatrix是鸡艾美耳球虫中致病力最强的球虫之一,主要感染8~18周龄的鸡群[11],患鸡出现精神萎靡、腹泻、便血等临床症状,小肠中段肠管鼓气和出血是主要病变,严重者可导致死亡[12]。本试验结果显示,5.0×104个/羽的分离E.necatrix可致40%感染鸡只死亡,相对增重率下降至31.61%;据董青[13]报道,5.0×104个/羽E.necatrix河南强毒株可造成10%实验鸡死亡,相对增重率为92.25%,两者相比,本试验分离的E.necatrix致病力更强。颜静蕊[14]在评价早熟株免疫效果时,以11×104个/羽的E.necatrix山西分离株接种易感鸡,引起的空肠病变记分为3.5分,并伴有44.4%的死亡率和44.4%的相对增重率,本试验以此剂量的新分离E.necatrix感染易感鸡,死亡率可达50%,相对增重率下降至20.87%,平均空肠病变记分为4分,且病变波及附近肠道,致病力大大增加,目前报道的鸡球虫活疫苗使用剂量[15]能否有效抵抗本虫株的损害还待进一步研究。
综上,本试验分离的E.necatrix虫株对易感鸡的致病性很强,为鸡球虫疫苗评价提供了良好的检验用种子虫株,也给鸡球虫病的防控带来新的挑战。
