基因自然重排鸡传染性法氏囊病病毒的分子特征
2023-03-03廖振芸王威威李宜海何秀苗
陈 睿,周 跃,廖振芸,王威威,李宜海,韦 平,何秀苗
(1. 广西民族大学海洋与生物技术学院 广西多糖材料与改性重点实验室,广西 南宁 530006 ; 2. 桂林市临桂区黄沙瑶族乡水产畜牧兽医站,广西 临桂 541113 ; 3. 桂林市临桂区中庸镇水产畜牧兽医站,广西 临桂 541114 ;4. 广西大学动物科学技术学院,广西 南宁 530005)
鸡传染性法氏囊病(Infectious bursal disease,IBD)是由传染性法氏囊病病毒(Infectious bursal disease virus,IBDV)引起的雏鸡急性、高度接触性、免疫抑制性疾病[1]。IBDV主要攻击3~6周龄鸡重要的淋巴器官法氏囊(Bursa of Fabricius,BF)中未成熟的 B 淋巴细胞,造成雏鸡免疫力低下进而继发感染其他疾病死亡,因此 IBD 被许多学者称为“鸡的艾滋病”。IBDV基因组较大的 A节段编码1个多聚蛋白pVP2-VP4-VP3和1个非结构蛋白VP5,较小的 B节段编码 RNA 聚合酶VP1。IBDV有2个血清型,仅血清Ⅰ型病毒对鸡致病,不同的血清Ⅰ型分离株在抗原性和致病性上存在差异[2],因此将血清Ⅰ型IBDV分为超强毒株(vvIBDV)、经典毒株(cIBDV)、致弱毒株(attIBDV)和变异株(vIBDV)。近年来,由于IBDVVP2基因高变区(vVP2)的快速遗传进化,Jackwood等[3]提出了 IBDV 的7个主要基因型类群。然而,IBDV的致病型和遗传进化不仅与 A 节段有关,而且还与 B 节段有关,所以一种新的基于 A、B 节段的分类方法应运而生[4,5]。目前,本课题组亦建立了包含中国新型变异株类群的最新分类方法[6]。
近年来,我国 IBDV 的流行出现了一些新的变化,如病毒基因重排和不同抗原变异株出现[7]、免疫鸡群发病[8]和非典型病例增多等,感染鸡无明显外观症状,但其中枢免疫器官法氏囊却严重萎缩,免疫抑制严重,威胁养禽业健康发展[9]。本课题组最近在临床中遇到了一起发生于黑五品种鸡中的 IBD 疑似病例,该鸡群在10日龄通过点眼滴鼻途径同时免疫接种了新城疫、传染性支气管炎二联疫苗和FW2512中等偏强毒力活疫苗,鸡群55日龄发病,病鸡肛门粘粪,精神差,流泪,舌头肿大,食欲下降。发病鸡场共有鸡只9 200羽,累计损失大约50羽。病死鸡剖检病变表现为法氏囊肿大、出血并有炎症渗出物。对该病例进行逆转录聚合酶链反应(Reverse transcription polymerase chain reaction,RT-PCR)诊断,通过鸡胚绒毛尿囊膜(Chorioallantoic membrane,CAM)途径接种进行病毒分离鉴定,应用 MEGA 7.0等软件对其重要基因 A-vVP2和 B-VP1-b的分子特征进行分析,旨在为临床 IBD 的防控提供科学依据。
1 材料与方法
1.1 样品来源 2019年10月,广西桂林某鸡场经初步诊断为 IBD 的黑五品种病鸡的法氏囊样品。
1.2 主要仪器 冷冻离心机(赛默飞世尔科技公司),PCR仪(伯乐生命医学产品有限公司),涡旋混合器(海门市其林贝尔仪器制造有限公司),电泳仪(北京市六一仪器厂),全自动凝胶成像仪(北京赛智创业科技有限公司),生化培养箱(上海博迅实业有限公司医疗设备厂)。
1.3 主要试剂 病毒RNA提取试剂 TRIzon Reagent、反转录试剂盒 HiFiScript cDNA Synthesis Kit和PCR试剂盒2×EsTaqMasterMix,均购自康为世纪生物科技有限公司。
1.4 引物设计 根据已发表的经典毒 STC 株的 A 节段全基因核苷酸序列[10]分别设计了2对针对 IBDVvVP2 的特异引物,用于vVP2 的巢式 RT-PCR 扩增。外引物为 pts:5′-CAACAGCCAACATCAACG-3′,pta:5′-AGCTCGAAGTTGCTCACC-3′,预期扩增片段 679 bp;内引物为 IBDs:5′-CCCAGAGTCTACACCATA-3′,IBDa:5′-TCCTCTTGCCACTCTTTC-3′,预期扩增片段 474 bp。根据已发表的 IBDV CEF94 株的 B 节段设计1对引物,X3:5′-CGGTGAGGATGACAAGCCC-3′(756~774 nt);X4:5′-GGCACGATGAGTCCACCAC-3′(1 504~1 522 nt),预期扩增片段 767 bp[11]。引物均由大连 TaKaRa 生物工程有限公司合成,-20 ℃ 保存备用。
1.5 病毒核酸检测 参照韦平等[12]的方法进行 IBDV 核酸检测:采集到的法氏囊组织剪碎、研磨,加1 mL无菌 PBS 研磨制成悬液,反复冻融 3 次,3 000 r/min 离心5 min 后取上清250 μL,将上清用 Trizol 法[13]抽提总 RNA。逆转录体系为10 μL,42 ℃孵育50 min,85 ℃孵育5 min,即得cDNA。PCR反应程序:95 ℃ 3 min;94 ℃ 30 s,52 ℃ 30 s,72 ℃ 1 min,35个循环;72 ℃延伸10 min,结束反应[14]。PCR产物进行1%琼脂糖凝胶电泳,电压80 V,电泳结果于紫外线365 nm下观察。PCR产物阳性所对应的法氏囊悬液用于进一步的病毒分离。
1.6 病毒分离鉴定 取经冻融、离心、过滤除菌后的法氏囊悬液上清,通过CAM途径接种9日龄 SPF 鸡胚,0.2 mL/枚,置于 37 ℃ 培养箱孵育,每隔 24 h 照胚观察 1 次,弃去24 h内死亡的鸡胚,收获24 h后死胚的尿囊液、尿囊膜和胚体,使用vVP2特异引物IBDs、IBDa通过RT-PCR进行病毒核酸的鉴定,方法同1.5。同时扩增分离毒株的VP1-b节段,PCR引物同1.4,PCR反应程序:94 ℃ 4 min;94 ℃ 45 s,52 ℃ 45 s,72 ℃ 1 min,30个循环;72 ℃ 10 min。产物经1%琼脂糖凝胶电泳检测。
1.7 分子特征分析 经过1.6获得的IBDVvVP2、VP1-b基因PCR产物送到武汉奥科鼎盛生物科技有限公司测序,使用BLAST和DNASTAR对分离株和参考毒株的vVP2序列(第206~350位氨基酸)、VP1-b序列进行核酸序列和氨基酸序列比对,并使用MEGA 7.0 绘制遗传进化树,所用参考毒株信息如下(vVP2/VP1-b):vvIBDV:HK46(香港,AF092943/AF092944)、OKYM(日本,D49706/D49707)、MB(中国,DQ927040/DQ927041)、UK661(英国,NC004178/X92761)以及 B节段属于HLJ-0504样vvIBDV毒株:Harbin-1(中国,EF517528/EF517529)、HLJ-0504(中国,GQ451330/GQ451331)、NN1172(中国,MW245064/MW245065);clIBDV:Cu-lwt (德国,AF362747/AF362748)、FW2512(中国,DQ656499/KC986359)、Faragher_52_70(法国,HG974565/HG974566);attIBDV:Gt(中国,DQ403248/DQ403249)、Cu-1M(德国,AF362771/AF362772)、B87(中国,DQ906921/DQ906922)、CEF94(荷兰,AF194428/AF194429);vIBDV:Variant_E(美国,AF133904/AF133905)、9109(美国,AY462027/AY459321)、SHG358(中国,MT179721/MT179723)、SHG352(中国,MT179720/MT179722)、SHG19(中国,MN393076/MN393077);血清Ⅱ毒株(Serotype Ⅱ IBDV):OH(加拿大,IBU30818/IBU30819)、23_82(德国,AF362773/AF362774)。
2 结果
2.1 病毒核酸检测 法氏囊研磨液上清提取的RNA经过逆转录和巢式RT-PCR扩增,电泳结果在474 bp 处有清晰的条带,与预期的vVP2基因片段大小相符,表明疑似病鸡的法氏囊样品中含有 IBDV 核酸。
2.2 病毒分离鉴定 将初步检测为IBDV核酸阳性的法氏囊悬液上清进行无菌处理后,通过CAM途径接种9日龄 SPF 鸡胚,盲传至第2代,鸡胚在5 d内死亡,死胚CAM增厚,胚体表现为全身皮下严重出血,尤其是头颈部和四肢末端的出血最为严重(图1)。取死胚尿囊液、尿囊膜、胚体,经研磨、冻融处理,样品经RT-PCR扩增得到大小为474 bp的IBDVvVP2特异性条带(图2A),vVP2经序列测定,结果与参考IBDV序列一致;同时亦能从样品中扩增获得与IBDVVP1-b片段大小相符的767 bp的目的片段(图2B),测序结果亦与IBDV序列相符,证实鸡胚样品中含有 IBDV,本试验成功分离到1株IBDV毒株,命名为 GL1906。

图1 IBDV核酸阳性法氏囊悬液上清接种SPF鸡胚病变
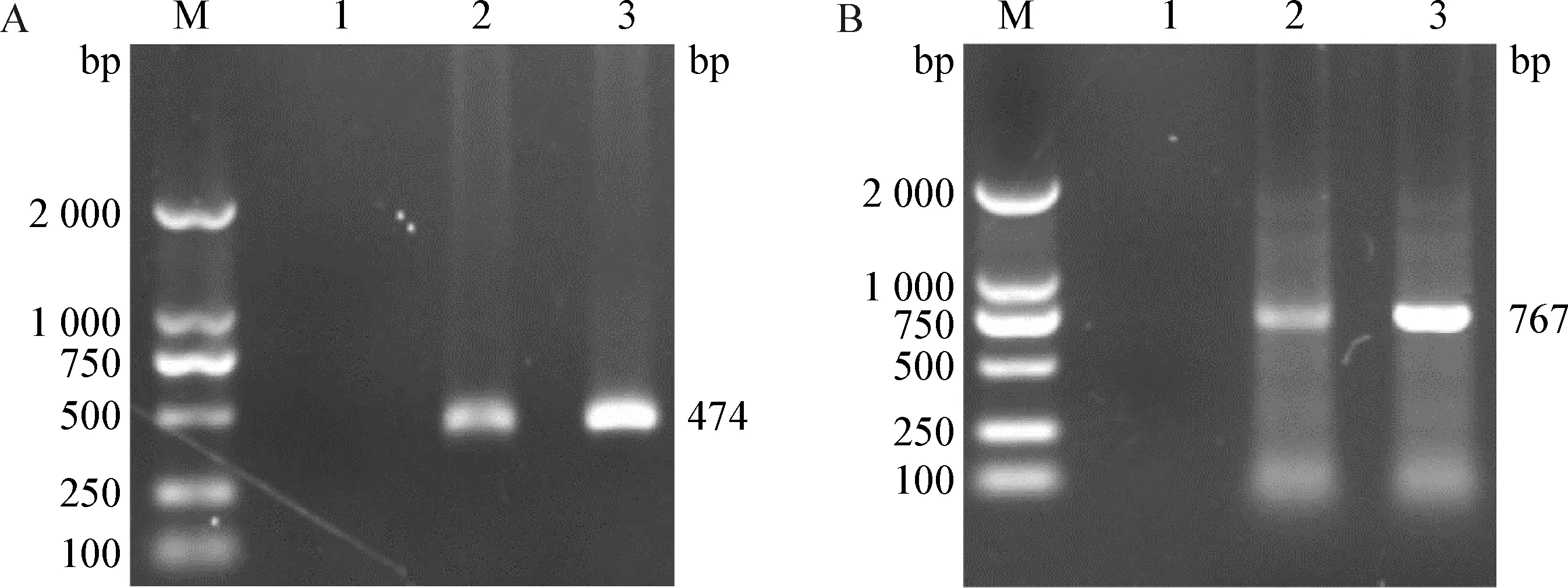
图2 分离株的RT-PCR扩增
2.3vVP2、VP1-b基因的同源性分析 基于vVP2的序列同源性分析发现,GL1906与国内外参考vvIBDV如OKYM等的核苷酸和氨基酸序列同源性较高,分别为 95.6%~99.4%和96.8%~98.7%,其中与广西前期分离株NN1172[15]的同源性最高;与参考clIBDV如Cu-1wt等的核苷酸和氨基酸序列同源性分别为90.1%~92.8% 和90.4%~94.9%,最低同源性数值出现在与所免疫的中等偏强毒株FW2512的比较中。
基于VP1-b的序列分析发现,GL1906与国内外参考vvIBDV如OKYM等的核苷酸和氨基酸序列同源性分别为 87.7%~99.3% 和96.1%~99.2%,最高值出现在与B片段属于独特分支的NN1172参考株的比较中;与其他类型毒株的核苷酸和氨基酸序列同源性分别为90.2%~90.9% 和97.6%~98.8%,其中与所免疫的FW2512疫苗株的核苷酸和氨基酸序列同源性分别为90.4%和98.8%。
2.4vVP2、VP1-b基因特征性氨基酸位点分析 利用 DNASTAR分别对分离株GL1906的vVP2和VP1-b序列中与病毒毒力相关的特征性氨基酸位点进行分析,结果如表1所示,GL1906 的vVP2特征性氨基酸位点在第222、256、284、294、299位与 vvIBDV 参考株相同,而279N与致弱毒株相同[16],此外,GL1906 表现出了与大多数参考株不同的212N。在VP1-b序列的分析上,分离株 GL1906 的242D、287A、390L、393E[17]与重排株如NN1172、HLJ-0504相同,其中242D、390L、393E的特征与弱毒株一致,287A与超强毒株一致。此外,分离株 GL1906的第777~782位核苷酸序列是GGTGCC,不能形成超强毒株所具有的KpnⅠ 酶切位点[18],具有与弱毒株一致的核苷酸序列特点[19]。表明 GL1906 在VP1-b上既有弱毒株的分子特征,又有超强毒株的分子特征。

表1 IBDV A-vVP2和B-VP1-b特征性氨基酸位点
2.5vVP2、VP1-b基因序列系统进化树分析 将分离株GL1906和疫苗株FW2512及其他参考毒株的vVP2和VP1-b序列通过 MEGA 7.0 软件绘制系统进化树,结果显示,基于vVP2的分析中,所有毒株被分为2个大分支,分离株GL1906与其他血清Ⅰ型毒株同属1个大分支,血清 Ⅱ 型23_82和OH 为另1个分支;在血清 Ⅰ 型大分支中,所有毒株又被分为4个不同的小分支,分离株 GL1906和vvIBDV参考毒株属于A3分支,并与NN1172、HLJ-0504距离最近,与本病例所用疫苗株FW2512不在同一分支(图3A)。基于VP1-b的分析中,所有毒株被分为3个大分支,attIBDV、cIBDV、vIBDV等同属B1大分支;vvIBDV中的OKYM、HK46等参考株属于B2分支,分离株GL1906与NN1172、HLJ-0504等VP1属于特殊来源的毒株同属B3分支(图3B),这一结果与VP1-b序列同源性分析及编码的关键氨基酸位点分析的结果基本一致。
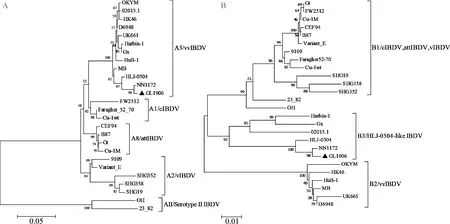
图3 根据IBDV vVP2 (A)和VP1-b (B)基因绘制的系统进化树
3 讨论
广西是我国最大的地方品种鸡饲养产区,山林放养的饲养特性使得鸡场生物安全措施不到位,场地很容易被污染而极易发生疾病的传播。本病例根据发病情况、剖检病变、病毒核酸检测、病毒分离以及序列分析结果证实该鸡群发生了IBD,并成功分离出1株基因自然重排IBDV毒株,命名为GL1906。GL1906的vVP2 和VP1-b序列分析显示,GL1906 在vVP2 序列同源性、关键氨基酸位点和遗传进化分析上均具有 vvIBDV 的特征;而在基于VP1-b的分析中,GL1906VP1-b在特征氨基酸位点上既有弱毒株的特征,又有强毒株的特征,系统进化树中与参考株HLJ-0504和NN1172处于同一分支,而HLJ-0504与NN1172的VP1-b已被证实具有独特来源[20,21],不属于其他参考株,表明分离株GL1906的vVP2 和VP1-b片段具有不同的来源。He等[8]研究表明,vVP2 和VP1-b可分别代表IBDV 基因组A、B节段进行分子特征分析,并具有流行病学意义,鉴于以上分析结果,GL1906为基因自然重排病毒,且根据课题组建立的基因型分类方法[6],GL1906是基因型为A3B3的毒株。
值得注意的是,GL1906与NN1172和HLJ-0504具有高度的相似性,众所周知,自1979年中国首次报道IBD病例以来,vvIBDV在中国流行并广泛传播,其中,HLJ-0504株成为所有鸡群的显性基因型,因此推测HLJ-0504类似株将成为临床诊断中的优势毒株。同时,GL1906分离株具有与近年分离株类似的vVP2基因的D212N突变和相似的VP1-b基因,但不同的是,GL1906 在vVP2关键位点第279位发生了由 D(vvIBDV)变为N(致弱毒株)的突变,研究表明,VP2序列是毒力和细胞趋向性的主要决定因素[22],VP2 蛋白的第279位(D→N)突变是IBDV适应细胞培养所必须的重要氨基酸位点之一[23],GL1906 D279N的变化预示着该分离株有能适应体外细胞培养的潜质。NN1172是本课题组2011年田间分离毒株,已经成为课题组试验的模式毒株,而本次分离的GL1906有望成为下一个模式毒株。同时SWSASGS 七肽区的保守性以及 279D 和 284A 这2个特征氨基酸是强毒株的重要标志[24],第279位的突变可能会改变毒株抗原性[25]和致病力[26],具体影响有待于进一步研究。IBDV的致病性与2个基因组片段(片段A和片段B)都有关,A-vv/B-att重排毒株通常导致病毒致病性降低[27],A-att/B-vv重排株往往表现出更高的致病性[28],而研究发现A-vv/B-HLJ-0504 like的重排使IBDV仍然保持着高毒力,代表着一种超强毒力的表型,而GL1906正是A-vv/B-HLJ-0504 like表型,因此推测本病例分离株GL1906可能具有较强的致病力,从而引起感染鸡发病死亡。
本病例鸡群于10日龄通过点眼滴鼻途径同时免疫接种过新支二联苗和FW2512活疫苗,55日龄发生IBD,结合分离株GL1906的分子特征分析发病原因如下:第一,不同疫苗同时经过同一途径免疫,可能造成鸡群免疫不均匀致部分鸡免疫失败。本病例养鸡场饲养量大,但损失的鸡只不多的现象极有可能是这个原因,因此建议养鸡场加强对鸡群体内抗体水平的监测,制定合理有效的免疫方案,适时调整免疫程序;第二,中等偏强毒力的活疫苗致使法氏囊损伤,活疫苗具有模仿被IBDV感染的优点,能诱导有效的细胞和体液免疫,但活疫苗具有通过抗原性漂移的方式发生变异和使法氏囊萎缩的缺点[29],造成鸡群的免疫抑制而易于被野毒感染;第三,鸡场在使用活疫苗免疫后,消毒不彻底,造成场地污染而使疫苗株在鸡体内循环感染,同时又遭受野毒感染,2种不同毒力的病毒混合感染鸡群,给病毒基因重排创造了机会,毒力不断改变而形成新的感染源所致[11];第四,鸡群感染的 IBDV 野毒株突破了疫苗的保护从而使鸡群发病。该鸡群感染的 GL1906在基因组双节段重要氨基酸位点上均表现既具有超强毒株的特征,又具有弱毒株的特征,并在vVP2上具有与国内近十几年的分离株所普遍具有的D212N改变[30],该突变被认为可能与毒株抗原性发生漂变有关。此外,GL1906VP2的D279N可能使该毒株VP2蛋白构象发生一些改变,从而突破抗体保护引起感染。
本病例分析结果发现,当前 IBD 仍对广西地区的养鸡业存在威胁,强毒株依然是流行毒株,特征性氨基酸位点 D279N使毒株可适应细胞,有望用于后续细胞感染试验。IBDV易变异,对环境有较强的抵抗力,新毒株不断被发现,目前传统疫苗免疫的保护效果不再理想,本课题组也已分离出新型变异株[31],预示着 IBD 的防控面临着新挑战,因此持续跟踪和分离流行株,掌握病原进化规律对于指导广西地区 IBD 的防控具有重要的意义。
