青岛地区3株犬细小病毒全基因组分析
2023-03-03原昆鹏曲雪婷孙军昌齐昊南陈淑贞王冬冬臧立钰衣玉颖刘均华尹燕博温建新
原昆鹏,曲雪婷,孙军昌,王 旭, 齐昊南,陈淑贞,王冬冬,尹 月 ,臧立钰,衣玉颖,刘均华,尹燕博,温建新
(1.青岛农业大学动物医学院,山东 青岛 266109 ; 2.青岛市即墨区畜牧业发展服务中心,山东 青岛 266225 ;3.青岛博隆实验动物有限公司,山东 青岛 266225 ; 4.青岛市农业行政执法支队,山东 青岛 266071)
犬细小病毒病是幼犬最危险的传染病之一,受感染犬临床特征是呕吐、发烧、腹泻、出血性肠炎、心肌炎和白细胞减少症[1]。犬细小病毒病是由犬细小病毒(Canine parvovirus,CPV)引起的,CPV属于细小病毒科,细小病毒属,是一种无囊膜单股负链DNA病毒[2]。CPV全长约5.3 kb,包括2个主要的开放阅读框(Open reading frame,ORF),1个编码结构蛋白VP1和VP2,另1个编码非结构蛋白NS1和NS2[3]。
CPV于1978年首次被发现,为了与犬微小病毒(Minute virus of canine,MVC)区分被命名为CPV-2[4]。1979—1981年发现抗原变异株CPV-2a[5],1984年变异株CPV-2b被发现[6]。抗原变异株CPV-2c于2000年首次报道[7]。在我国,CPV-2感染于1982年首次被报道[8],CPV-2a于1986年被报道[9],CPV-2b出现于1997年[10],CPV-2c于2010年在吉林省被发现[11]。近年来,new CPV-2a和new CPV-2b开始在中国流行[12]。目前,new CPV-2a和new CPV-2b似乎已经取代了CPV-2a和CPV-2b的原型株,并已成为许多国家的主要流行型[9]。
CPV-2在抗原多样性方面持续增加,其进化速度接近每年每个位点10-4个替代[13]。目前,我国宠物临床CPV防疫多使用进口疫苗,这些进口疫苗均源于原始的CPV-2毒株[14]。本研究从2012—2020年青岛地区使用进口疫苗免疫过的临床CPV发病犬中,先后分离到3株CPV,全基因组序列分析发现,与传统的CPV-2毒株相比,分离毒株已发生较大变异,这可能是导致CPV临床免疫失败的主要原因。
1 材料与方法
1.1 病料采集 青岛市使用进口CPV疫苗免疫过的,临床症状为呕吐、血样腹泻的发病犬,采集新鲜肠道组织作为分离病毒所用病料,低温冻存。采集青岛市使用进口CPV疫苗免疫过的成年健康犬粪便为健康犬对照样品。
1.2 主要试剂 DMEM培养基、胎牛血清,均购自Cytiva公司;病毒DNA提取试剂盒(TaKaRa MiniBEST Viral RNA/DNA Extraction Kit Ver.5.0)、DL-2 000 DNA Marker、DL-5 000 DNA Marker、pMD18-T载体(pMDTM18-T Vector Cloning Kit)、DH5α感受态细胞、PrimeStar HS DNA聚合酶,均购自宝日医生物技术(北京)有限公司;快速琼脂糖凝胶DNA回收试剂盒,购自康为世纪生物科技有限公司。
1.3 主要仪器 PCR基因扩增仪[TC-96/G/H(b)型],杭州博日公司产品;电泳仪(JY600E型)、核酸电泳槽(JY-SPFT型)、凝胶成像仪(JY04S-3C型),君意东方公司产品。
1.4 样品处理 将病料与无菌PBS(pH=7.2)按照1∶5比例混合研磨,反复冻融3次后8 000 r/min 高速离心10 min,取上清用0.22 μm滤器过滤除菌,-80 ℃保存。
1.5 病毒分离 采用同步接毒的方式,向传代后的F81 细胞悬液按1∶9(体积比)接入经处理后的样品,置于37 ℃、5% CO2培养箱中,次日用含1%血清的细胞维持液进行换液。每天观察细胞病变(Cytopathic effect,CPE)情况,传至出现较稳定的 CPE 后收毒,同时设正常 F81 细胞为阴性对照。
1.6 PCR鉴定 按照本实验室建立的犬细小病毒 PCR 诊断检测方法[15]对健康犬对照样品、第3代F81细胞培养物进行PCR鉴定,同时设立阳性对照(本实验室保存的CPV分离株)和阴性对照(未接种样品的F81细胞培养物)。通过病毒DNA提取试剂盒提取DNA,以提取后DNA为模板进行PCR扩增。PCR反应体系(25.0 μL):2×Mix 12.5 μL,ddH2O 8.5 μL,模板 2.0 μL,上游引物 1.0 μL,下游引物 1.0 μL。PCR反应程序:95 ℃ 5 min;95 ℃ 30 s,55 ℃ 30 s,72 ℃ 40 s,共35个循环;72 ℃,10 min。PCR产物4 ℃保存,取PCR产物进行1%琼脂糖凝胶电泳,在紫外灯下观察结果。
1.7 病毒全基因组分析
1.7.1 全基因组扩增 参照参考文献[3,16]扩增病毒的全基因组,方法同1.6,并将本实验室于2012年和2015年分离到的2株病毒(CPV-QD12和CPV-QD15)一同扩增。扩增的DNA产物经1%琼脂糖凝胶电泳鉴定。阳性PCR产物利用胶回收试剂盒进行胶回收纯化后克隆至pMD18-T载体,连接体系:胶回收产物4 μL,SolutionⅠ5 μL,Vector 1 μL,混匀后16 ℃连接过夜。次日将连接产物转化到DH5α感受态细胞中,涂板后挑取单菌落,扩大培养后进行菌液PCR鉴定,阳性菌液送青岛睿博生物科技有限公司测序。
1.7.2 全基因组及VP2、NS1序列分析与系统进化树构建 利用DNASTAR进行序列拼接,得到病毒全基因组序列。利用MegAlign软件对本研究获得的序列与参考株序列进行同源性分析。通过与GenBank中近几年发表的其他CPV序列进行比较,进行全基因组及VP2、NS1核苷酸、氨基酸比对分析,并进行基因分型与氨基酸非同义替代分析。利用MEGA 7邻接法构建系统进化树。
2 结果
2.1 病毒分离 样品同步接种F81细胞,盲传到第3代开始出现典型的CPE,表现为接毒细胞脱落、变形、大范围的拉网状病变,阴性对照正常F81细胞生长良好,排列紧密,形状统一(图1)。将本研究于2020年分离到的CPV命名为CPV-QD20株。
图1 光学显微镜下细胞形态(40×)
2.2 PCR鉴定 PCR扩增产物经1%琼脂糖凝胶电泳检测,分离毒株的细胞培养物和阳性对照均与预期相符,在481 bp处出现明亮条带;细胞阴性对照培养物PCR扩增结果为阴性(图2)。
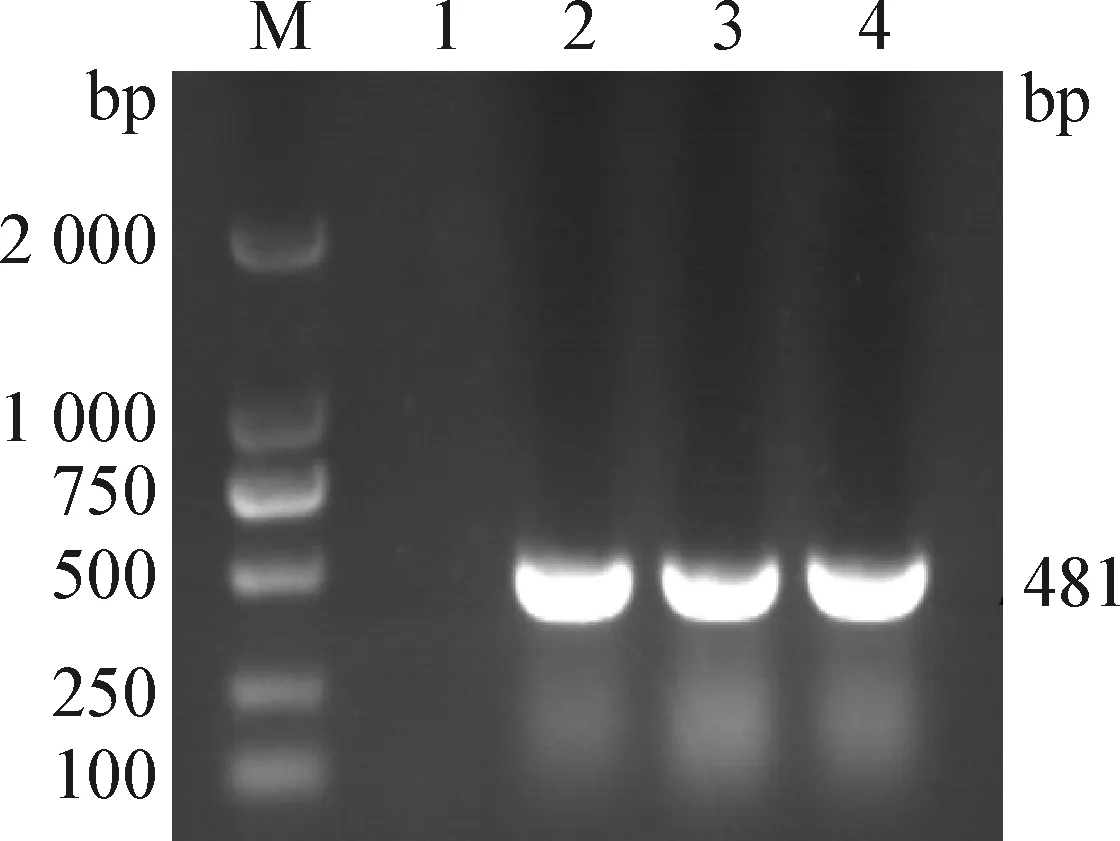
图2 PCR扩增鉴定
2.3 病毒全基因组扩增 通过PCR对CPV全基因组进行扩增,结果显示,在712、2 105、1 728、1 591、635、66和100 bp处出现与预期相符的7个条带(图3)。

图3 全基因组的PCR扩增
2.4 序列分析 序列分析发现,分离获得的3株CPV的基因组全长为5 055~5 062 bp。3株CPV全基因核苷酸同源性为99.0%~99.8%。NS1基因核苷酸同源性为99.1%~99.3%,氨基酸同源性为99.0%~99.4%。VP2基因核苷酸同源性为99.3%~99.9%,氨基酸同源性为99.7%~100%。3株CPV与参考毒株全基因核苷酸同源性为90.9%~99.8%。
2.5 系统进化树构建 基于全基因组构建的系统进化树显示,CPV-QD12株与中国分离株MH476593、MF805798、MF805794亲缘关系较近,其中亲缘关系最近的是MH476593,核苷酸同源性为99.7%;CPV-QD15株与2017年中国分离株MH476590亲缘关系最近,核苷酸同源性为99.9%。CPV-QD20株与MG013488、MH476592、MH476584、MH476583、MH476587处在同一分支,与2017年上海分离株CPV-SH1516核苷酸同源性最高,为99.8%(图4)。

图4 基于犬细小病毒全基因组的系统进化树
2.6VP2、NS1蛋白氨基酸非同义替代分析 对3株CPV分离株编码VP2蛋白、NS1蛋白的氨基酸序列与参考序列进行对比,氨基酸非同义替代结果如表1和表2所示。根据CPV基因分型的相关报道[17],CPV-QD12和CPV-QD15为new CPV-2a型,CPV-QD20为CPV-2c型,健康犬对照样品检出CPV-2c型。
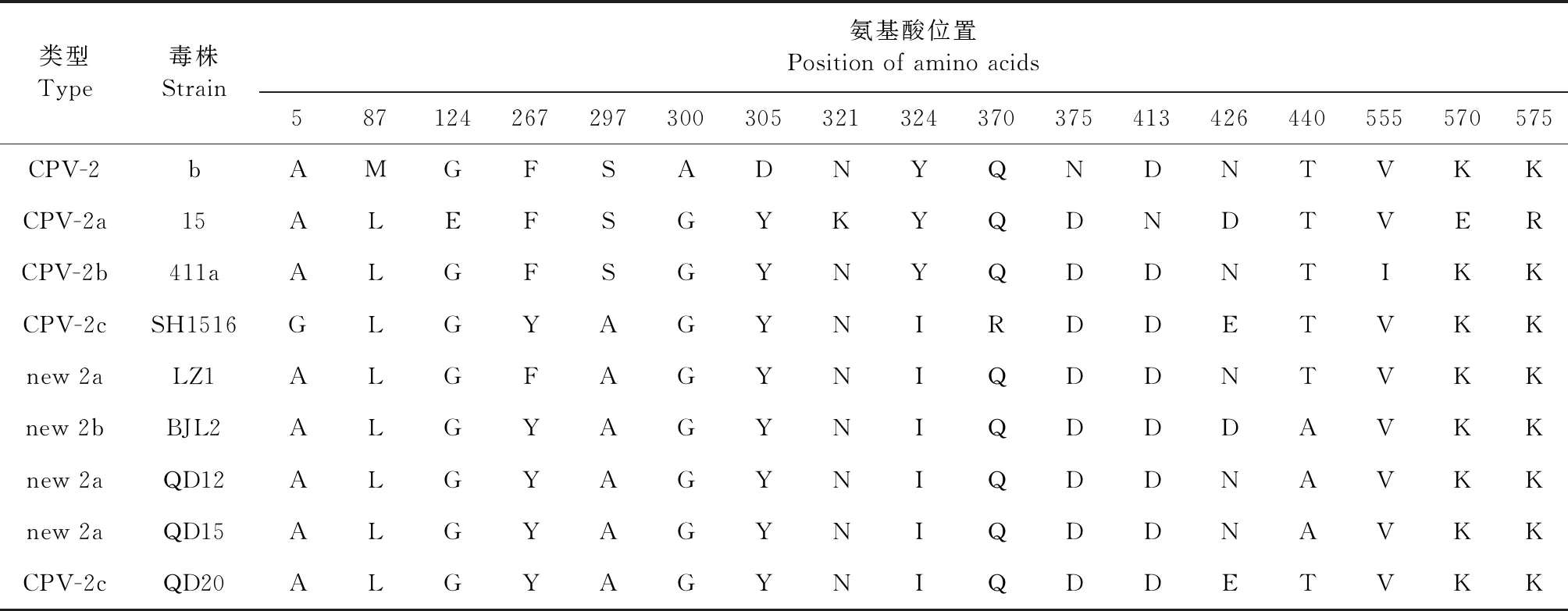
表1 VP2蛋白中非同义替代的氨基酸

续表

表2 NS1蛋白中非同义替代的氨基酸
3 讨论
CPV-2的感染在世界各地非常普遍,本研究进行全基因组测序的3株CPV的基因型分别为new CPV-2a、CPV-2c。CPV-2a、CPV-2b、new CPV-2a、new CPV-2b和CPV-2c在我国均为流行株[9]。近年来,new CPV-2a成为我国部分地区的主要流行型,CPV-2c除了在我国流行之外,还是意大利、德国、乌拉圭、阿根廷、尼日利亚等国家的主要抗原变异型[18]。全基因组系统进化树结果显示,3株CPV与国外CPV分离株亲缘关系较远,与国内参考毒株同源性较高,都处在同一大分支中并没有形成明显独立分支,这说明在青岛地区分离的3株CPV与国内其他CPV流行株均源自同一祖先。但是,本研究全基因组测序的3株CPV的基因型,CPV-QD12和CPV-QD15为new CPV-2a型,CPV-QD20为CPV-2c型,健康犬对照样品也检出CPV-2c型,均与原始的CPV-2存在差异。本研究分离的CPV-QD20为CPV-2c型,说明青岛地区CPV毒株出现了新的基因型,不排除new CPV-2a型和CPV-2c型同时流行的可能。
VP2蛋白是CPV-2的主要结构蛋白,参与宿主免疫应答,VP2基因的突变可能改变CPV-2的类型、感染和致病性[19]。VP2基因的第5、87、267、300、322、323、324、334、341、370、440、555位氨基酸的突变已被证实与CPV-2的感染和致病性有关[3]。2014年以后的大部分CPV-2c分离株中VP2基因的第5位氨基酸都发生A→G突变,此处突变可能改变了CPV的抗原性和免疫原性[20]。本研究中3株CPV分离株都出现了第267位氨基酸F→Y突变,第324位氨基酸 Y→I突变。第267位氨基酸F→Y突变可能在传播和感染中发挥重要作用[12]。第297位氨基酸S→A突变是new CPV-2a和new CPV-2b的标志[9],本研究的2株new CPV-2a分离株均发生了该突变。第324位氨基酸 Y→I突变是近几年来我国CPV分离株常见的氨基酸突变[21]。第370位氨基酸Q→R突变可能与宿主范围的改变以及宿主红细胞的血凝有关[20]。第426位的突变被用来区分CPV-2a、CPV-2b和CPV-2c[3]。本研究中new CPV-2a 型CPV-QD12株和CPV-QD15株都在第440位出现氨基酸突变(T→A),而CPV2c型CPV-QD20株则未出现此突变。
CPV的非结构蛋白NS1和NS2与病毒复制相关[22]。亚洲CPV-2c变异株在NS1基因的第60、544、545、630位氨基酸中都表现出特定的改变,这些氨基酸突变可能有助于进一步阐明CPV的进化情况[23],对推断CPV变异株的传播是至关重要的[24]。关于CPV非结构基因的研究有限[13],它们的作用需要进一步评估。
本研究中的3株CPV分离株均是从接种过疫苗的临床发病犬中分离到的。在我国,CPV的商业疫苗株大多数是CPV-2型。接种CPV-2型疫苗可以对免疫动物形成交叉保护,使免疫动物抵抗强毒CPV-2a、CPV-2b和CPV-2c的攻击[25-27]。有报道显示,近年来new CPV-2a成为我国部分地区的优势变异株[28],CPV-2型疫苗不能保护免疫犬抵抗new CPV-2a和new CPV-2b的攻击[29]。本研究中的3株CPV分离株分属new CPV-2a和CPV-2c两个基因型,与原始CPV-2毒株存在差异。与其他CPV-2c型相比,本研究分离的CPV-20株在VP2基因和NS1基因中均出现了不同的氨基酸非同义替代。上述发现是否是CPV-2型疫苗免疫失败的原因有待进一步试验验证。
CPV主要经粪口传播,这是幼犬感染的重要原因。本研究从健康犬对照样品中检测到CPV-2c型病毒,说明使用进口CPV弱毒活疫苗的成年犬存在排毒问题。可见,将成年犬与幼犬隔离饲养是保护幼犬的重要措施。本研究认为应该使用CPV流行株研发灭活疫苗,做加强免疫,防止疫病扩散。CPV进化速度快,作为一种易变异的DNA病毒,在时间、空间和宿主方面对CPV进行持续的流行病学监测能够及时掌握CPV变异情况,为疾病防控和疫苗株的更新提供参考。
