miR-142-5p对LPS诱导的小鼠乳腺上皮细胞炎性因子释放和增殖、凋亡的影响
2023-03-03卢劲晔顾蓓蓓法艳梅何祥来
卢劲晔,顾蓓蓓,法艳梅,刘 静,何祥来
[1. 江苏农牧科技职业学院,江苏 泰州 225300 ; 2. 泰州海关综合技术服务中心,江苏 泰州 225300 ;3. 青岛西海岸新区(黄岛区)农业农村局,山东 青岛 266427]
乳腺炎是困扰奶牛养殖业并造成严重经济损失的重要疾病之一。乳腺炎的防治效果不仅关系到奶牛养殖业的经济效益,更为重要的是与公众食品安全和人类健康密切相关[1]。大肠埃希菌(Escherichiacoli,E.coli)是临床上引起奶牛乳腺感染最重要的病原菌之一,也是环境性乳腺炎病原菌的代表。抗菌药频繁使用致使耐药菌株的不断产生,增加了临床上乳腺炎防治的难度[2,3]。脂多糖(Lipopolysaccharide,LPS)是大肠埃希菌细胞膜的主要元件,通过Toll样受体4(Toll-like receptors 4,TLR4)促进细胞内信号转导,激活核因子κB(Nuclear transcription factor-κB,NF-κB),增加炎性细胞因子的分泌,进一步促进乳腺炎的发展[4-6]。有趣的是,作为乳腺组织的主要功能细胞,乳腺上皮细胞不仅在乳汁的合成和分泌中起着重要作用,还是一种重要的病原体屏障[7,8]。因此,探讨乳腺上皮细胞的自身防御机制对预防炎症具有重要意义。
微RNA(microRNAs,miRNAs)是一类由21~23个碱基组成的单链小RNA分子,具有高度的保守性。miRNAs在转录后起重要作用,与靶基因特异性结合后通过降解或抑制mRNA调控靶基因的表达[9,10]。研究表明,miRNA通过调节细胞的增殖、凋亡和免疫防御反应在动物抵御乳腺感染中发挥了重要作用[11,12]。Wang等研究表明,牛miR-146a可通过靶向调节TRAF6基因增加乳腺上皮细胞炎症因子的表达,提高乳腺上皮细胞的免疫应答水平[13]。Lai等研究发现,miR-92a可作为奶牛乳腺炎的标记分子[14]。Sun等研究表明,奶牛乳腺炎发生时miR-142-5p表达上调[15]。然而miRNA在乳腺炎发病机制中的研究尚处于起步阶段,本试验通过研究miR-142-5p对LPS引起的乳腺上皮细胞增殖、凋亡和免疫应答的影响,探讨miR-142-5p对乳腺炎的影响,为临床上研究奶牛乳腺炎的防治新策略提供理论依据。
1 材料与方法
1.1 主要试剂 胎牛血清、DMEM培养基和TRIzol®Reagent,均购自美国英杰生命技术有限公司;小鼠miR-142-5p模拟物(Mimics)、抑制剂(Inhibitors)和相应的阴性对照小分子RNA,均购自上海吉玛制药技术有限公司;细胞因子ELISA检测试剂盒,购自武汉新启迪生物科技有限公司;细胞凋亡试剂盒和EdU试剂盒,均购自上海碧云天生物技术有限公司;羊抗兔AKT、p-AKT、P65、p-P65、GAPDH和HRP标记山羊抗家兔IgG抗体,均购自艾博抗(上海)贸易有限公司;细胞核蛋白与总蛋白提取试剂盒和BCA蛋白定量试剂盒,均购自北京博迈德科技发展有限公司;ECL化学发光检测试剂盒,购自安诺伦(北京)生物科技有限公司。
1.2 主要仪器 UV755B型分光光度计,上海精密科学仪器有限公司产品;光学显微镜,日本奥林巴斯公司产品;MIKRO-22R型高速冷冻离心机,德国赫提驰公司产品;垂直板电泳槽和半干转印仪,美国伯乐公司产品;流式细胞仪,美国BD生物科学公司产品。
1.3 细胞来源 小鼠乳腺上皮细胞系(EpH4-Ev),购自美国模式培养物集存库(American Type Culture Collection,ATCC)。
1.4 试验方法
1.4.1 细胞培养及处理 小鼠乳腺上皮细胞系置于含10%胎牛血清和1%青链霉素的DMEM培养基中,37 ℃、5%CO2条件下培养,每2~3 d换液。待细胞密度达90%后用0.25%胰蛋白酶进行细胞消化和传代。取对数生长期的细胞,待细胞融合至80%~90%时,接种到6孔板中,完全贴壁后换液,将细胞分为6个组,分别是对照组(Control,CON)、脂多糖组(LPS)、脂多糖+抑制剂阴性对照组(LPS+inhibitors NC)、脂多糖+抑制剂组(LPS+inhibitors)、脂多糖+模拟物阴性对照组(LPS+mimics NC)和脂多糖+模拟物组(LPS+mimics),每组设6个重复孔(n=6),对应组别细胞中加入抑制剂或模拟物继续培养48 h后,加入LPS(10 μg/mL)共培养2 h,收集样品进行后续检测。
1.4.2 ELISA检测细胞因子表达 收集细胞上清液,采用ELISA方法检测肿瘤坏死因子α(Tumor necrosis factor α,TNF-α)、白细胞介素6(Interleukin 6,IL-6)、白细胞介素1β(Interleukin 1β,IL-1β)和白细胞介素8(Interleukin 8,IL-8)表达水平,具体操作按照试剂盒说明书进行。
1.4.3 流式细胞术检测细胞周期和细胞凋亡 胰酶消化并收集细胞,PBS洗涤后,分别进行细胞周期和细胞凋亡的检测。细胞周期检测:收集的细胞于预冷的70%乙醇中4 ℃固定4 h,离心重悬细胞,用RNase A和PI溶液对细胞进行染色,混匀,室温下避光孵育30 min,利用细胞内DNA能与PI结合的特性,通过流式细胞仪检测细胞各个时期的DNA含量,重复3次。细胞凋亡检测:细胞加入Annexin V-FITC混匀,室温下避光孵育15 min,上机前5 min再加入PI溶液,1 h内流式细胞仪检测细胞凋亡。
1.4.4 EdU法检测细胞增殖活力 具体操作按照试剂盒说明书进行。细胞接种于24孔板,每孔加入10 μmol/L EdU溶液,37 ℃孵育4 h后去除培养液,PBS洗涤。4%多聚甲醛室温固定15 min,清洗,0.3% TritonX-100通透15 min,按照试剂盒说明书配置Click反应液,37 ℃避光孵育30 min。Hoechst避光复染细胞核5 min,荧光显微镜下观察细胞增殖活力。
1.4.5 Western blot检测蛋白表达 提取细胞的总蛋白,BCA法测定蛋白浓度。取20 μg总蛋白经12% SDS-PAGE电泳分离后转印到PVDF膜上,5%脱脂奶粉室温封闭2 h,分别加入GAPDH、AKT、p-AKT、P56、p-P56一抗(1∶1 000稀释),4 ℃摇床中孵育过夜。次日TBST充分洗涤,经辣根过氧化物酶标记二抗(1∶5 000)室温孵育1 h,充分洗涤,用ECL化学发光检测试剂盒显色。以GAPDH 为内参,经凝胶图像分析系统对条带进行光密度测定并分析,以目的蛋白和内参条带的光密度比值代表相应蛋白的相对表达水平。试验重复3次,取平均值。
1.5 数据分析 数据以“平均数±标准差(Mean±SD)”表示,采用SPSS 19.0中ANOVA程序对试验结果进行方差分析和Duncan氏多重比较,以P<0.05(差异显著)作为差异显著性判断标准。
2 结果
2.1 miR-142-5p对细胞因子表达的影响 与对照组比较,LPS组TNF-α(图1A)、IL-6(图1B)、IL-1β(图1C)、IL-8(图1D)的分泌水平均显著升高(P<0.05);与LPS组相比,LPS+inhibitors组显著抑制LPS诱导的上述上调作用(P<0.05),LPS+mimics组上述上调作用进一步增强(P<0.05),LPS+inhibitors NC组和LPS+mimics NC组差异均不显著(P>0.05)。
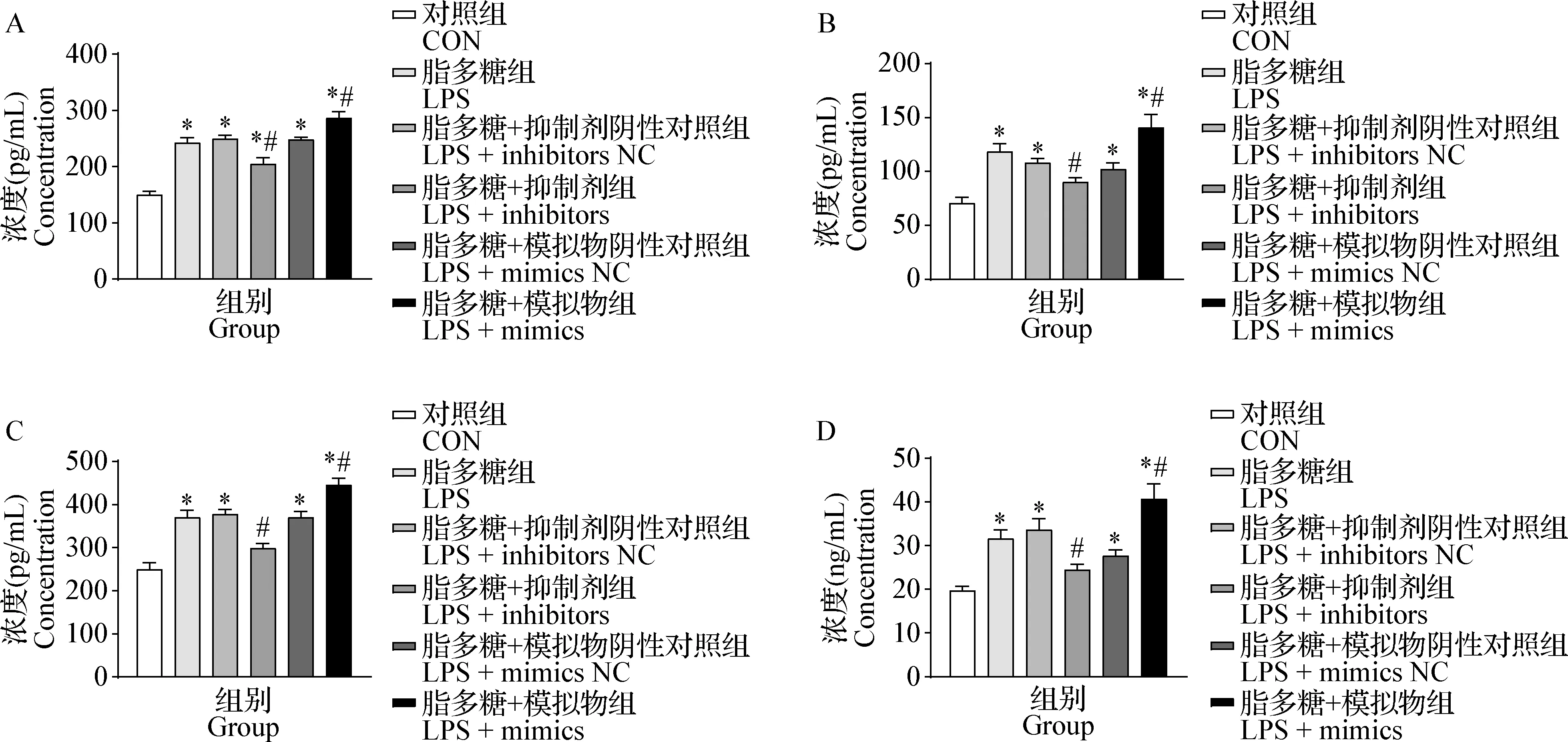
图1 乳腺上皮细胞炎性因子的变化
2.2 miR-142-5p对AKT和P65蛋白磷酸化水平的影响 如图2所示,与对照组比较,LPS组p-AKT和p-P65蛋白相对表达水平显著上调(P<0.05);与LPS组相比,LPS+inhibitors组上述上调作用被显著抑制(P<0.05),而LPS+mimics组上调作用显著增强(P<0.05),LPS+inhibitors NC组和LPS+mimics NC组则差异均不显著(P>0.05)。
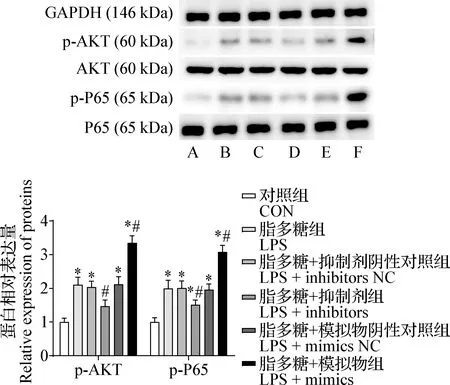
图2 乳腺上皮细胞AKT、P65及其磷酸化水平的变化
2.3 miR-142-5p对小鼠乳腺上皮细胞细胞周期和细胞增殖的影响 与对照组相比(图3A),LPS组G0/G1期细胞比率上升(图3B),LPS+mimics组G0/G1期细胞比率进一步上升(图3F)。同时,与对照组相比,LPS组S期细胞比率下降(图3B),LPS+mimics组下降更明显(图3F)。细胞增殖检测结果显示,与对照组相比(图4A),LPS组乳腺上皮细胞的增殖活力受到抑制(图4B);与LPS组相比,LPS+mimics组抑制效果更明显(图4F)。说明miR-142-5p过表达可抑制细胞S期DNA合成过程,导致乳腺上皮细胞周期被阻滞在G0/G1期,抑制细胞增殖。

图3 miR-142-5p对乳腺上皮细胞细胞周期的影响

图4 miR-142-5p对乳腺上皮细胞细胞增殖活力的影响
2.4 miR-142-5p对小鼠乳腺上皮细胞细胞凋亡的影响 为验证miR-142-5p在调节LPS诱导的乳腺上皮细胞凋亡进程中的作用,本试验检测了细胞凋亡率。如图5所示,与对照组相比,LPS组乳腺上皮细胞凋亡率显著升高(P<0.05);与LPS组相比,LPS+inhibitors组细胞凋亡率显著下调(P<0.05),LPS+mimics组细胞凋亡率进一步升高(P<0.05),LPS+inhibitors NC组和LPS+mimics NC组差异均不显著(P>0.05)。说明miR-142-5p在LPS诱导的乳腺上皮细胞的凋亡中起促进作用。
3 讨论
miRNAs是一类内源性的,长度为18~24个核苷酸的小RNA,广泛存在于动植物体内,具有高度的保守性。miRNAs参与细胞增殖、分化、凋亡等多种生命活动,在疾病的发病机制中发挥了重要的作用。研究证实,炎症刺激后miR-142在骨骼、肺等器官中均有表达,其在炎症的发生与发展过程中具有重要的调节作用[16,17]。急性肺损伤小鼠支气管肺泡灌洗液和外周血中miR-142的表达均显著增加,LPS诱导的急性肾损伤大鼠系膜细胞中miR-142-3p的表达亦上调[18]。关节炎患者关节滑液中miR-142的表达水平与炎症持续的时间相关,提示其参与了炎症预后,与滑膜组织的增生和修复密切相关[19]。本试验结果显示,经LPS处理的乳腺上皮细胞中miR-142-5p的表达上调,且miR-142-5p 模拟物能促进NF-κB通路的激活,并进一步上调LPS诱导的细胞因子的表达,该结果与Sun等的研究结果一致[20],表明miR-142-5p可能在乳腺炎中起到促炎作用。
本试验进一步研究了LPS和miR-142-5p对小鼠乳腺上皮细胞增殖和凋亡的影响。结果显示,LPS处理后细胞阻滞于G0/G1期,经miR-142-5p模拟物处理后细胞周期的阻滞效果显著提高,miR-142-5p模拟物抑制剂处理对阻滞效果则有所缓解,表明miR-142-5p能抑制细胞增殖,促进细胞凋亡,而凋亡的上皮细胞降解会诱导有毒物质和促炎性物质的分泌。
本试验也存在一些局限性,1个miRNA可能有多个靶点,1个基因可能有多个miRNAs靶点,因此本结果有待在体内进一步证实。体外试验结果表明,miR-142-5p可能通过调节炎性因子的释放分泌以及细胞的增殖和凋亡在乳腺炎中发挥促炎作用,该结果为临床上乳腺炎的防治提供了一种新的思路。
