基于谱效关系的核桃楸皮治疗肝癌药效物质基础研究
2023-03-01王诗蒙王帅李天骄孟宪生包永睿赵琳
王诗蒙,王帅,2,3,李天骄,2,3,孟宪生,2,3,包永睿,2,3*,赵琳*
(1.辽宁中医药大学药学院,辽宁 大连 116600;2.辽宁省中药多维分析专业技术创新中心,辽宁 大连 116600;3.辽宁省现代中药研究工程实验室,辽宁 大连 116600)
核桃楸皮为胡桃科植物核桃楸(JulansmandshurecaMaxim.)的枝皮或干皮,主要分布于东北、河北、山西等地。其苦,辛,性微寒。《开宝本草》中最早记载核桃楸有补肾固精、敛肺定喘、抑菌镇咳及抗癌之功效[1],主治湿热下痢、目赤肿痛、睑腺炎、迎风流目、骨结核等[2]。现代研究表明,核桃楸皮中含有醌类、黄酮类、挥发油类、苷类、鞣质、多酚、多糖等化学成分[3],具有抗菌、抗氧化、抗肿瘤等作用。目前对核桃楸皮的研究主要集中在药理作用[4-6]等方面,关于药效物质研究的文献报道相对较少。
本研究采用高效液相色谱(HPLC)法建立了核桃楸皮不同极性部位的指纹图谱;采用CCK-8法进行核桃楸皮治疗肝癌的体外药效研究;运用灰色关联度分析法和偏最小二乘回归分析法两种分析方法,将指纹图谱与体外抗肝肿瘤药效相关联,建立了核桃楸皮治疗肝癌的谱效关系,明确了核桃楸皮活性部位与抗肝癌药效之间的关联性,筛选出了核桃楸皮治疗肝癌的药效物质,初步揭示了其治疗肝癌的药效物质基础,为核桃楸皮的药物代谢及作用机制研究提供前期基础。
1 实验材料
1.1 仪器 1260 Ⅰ型快速高效液相色谱仪(美国安捷伦科技有限公司);SUNRISE酶标仪(瑞士TECAN公司);US AUTOFLOW型CO2培养箱(德国NU-AIRE公司)。
1.2 试剂与药物 核桃楸皮药材由丹东药业集团提供,经辽宁中医药大学许亮教授鉴定为胡桃科胡桃属植物核桃楸(JulansmandshurecaMaxim.)的枝皮或干皮;阿魏酸、槲皮苷、柚皮素、山柰酚(成都普菲德生物技术有限公司,批号分别为17120702、151016、17061301、130708);丁香酸、没食子酸、鞣花酸(四川维克奇生物科技有限公司,批号分别为21090106、170824、22012407);胎牛血清(美国GIBCO公司);DMEM高糖培养基(美国 GIBCO公司);胰蛋白酶(美国GIBCO公司);青霉素/链霉素溶液(Meilunbio公司);CCK-8增强型溶液细胞活性检测试剂盒(Meilunbio公司)。
1.3 细胞株 人肝癌细胞株HepG2,购自武汉普诺赛生命科技有限公司。
2 方法与结果
2.1 核桃楸皮指纹图谱研究
2.1.1 供试品溶液的制备 取核桃楸皮粉末(过3号筛)适量,分别加入10倍量的乙酸乙酯、70%乙醇溶液、正丁醇、氯仿、石油醚、水,加热回流提取2 h,放冷,抽滤,挥干,制得核桃楸皮不同极性部位提取物。
精密称取核桃楸皮不同极性部位提取物0.2 g,置于10 mL容量瓶中,甲醇溶解并稀释至刻度,0.22 μm微孔滤膜过滤,制成浓度为0.02 g·mL-1的供试品溶液。
2.1.2 对照品溶液的制备 精密称取没食子酸、丁香酸、阿魏酸、鞣花酸、槲皮苷、柚皮素、山柰酚对照品适量,置于10 mL容量瓶中,加甲醇溶解并稀释至刻度,分别制得浓度为0.159、0.118、0.154、0.192、0.155、0.115、0.884 mg·mL-1的对照品溶液。
精密称取各对照品适量,加甲醇制成含没食子酸0.034 mg·mL-1、丁香酸0.026 mg·mL-1、阿魏酸0.009 mg·mL-1、鞣花酸0.038 mg·mL-1、槲皮苷0.030 mg·mL-1、柚皮素0.022 mg·mL-1、山柰酚0.017 mg·mL-1的混合对照品溶液。
2.1.3 色谱条件 色谱柱:Agilent Poroshell SB-C18色谱柱(4.6 mm×100 mm,2.7 μm);流动相:0.1%甲酸水(A)-甲醇(B);梯度洗脱程序:(0~2 min,10%→15%B;2~4 min,15%→19%B;4~9 min,19%→36%B;9~12 min,36%→37%B;12~14 min,37%→38%B;14~30 min,38%→70%B;30~43 min,70%→87%B;43~55 min,87%→100%B);流速:0.6 mL·min-1;柱温:30 ℃;进样量:5 μL;检测波长:265 nm。
2.1.4 指纹图谱的建立 精密吸取核桃楸皮不同极性部位供试品溶液5 μL,按“2.1.3”项下色谱条件进样分析,将不同极性部位的色谱图导入到“中药色谱指纹图谱相似度评价系统”,得到核桃楸皮不同极性部位的指纹图谱(见图1)。将相同保留时间下的色谱峰记为同一峰号,若某部位在该保留时间下无峰,则将其峰面积记为0.01,得到各共有峰的保留时间和峰面积。从指纹图谱中可以看出,不同极性部位的峰面积及峰数存在明显差异,表明不同极性部位所含化学成分组成及含量有一定的差异性。
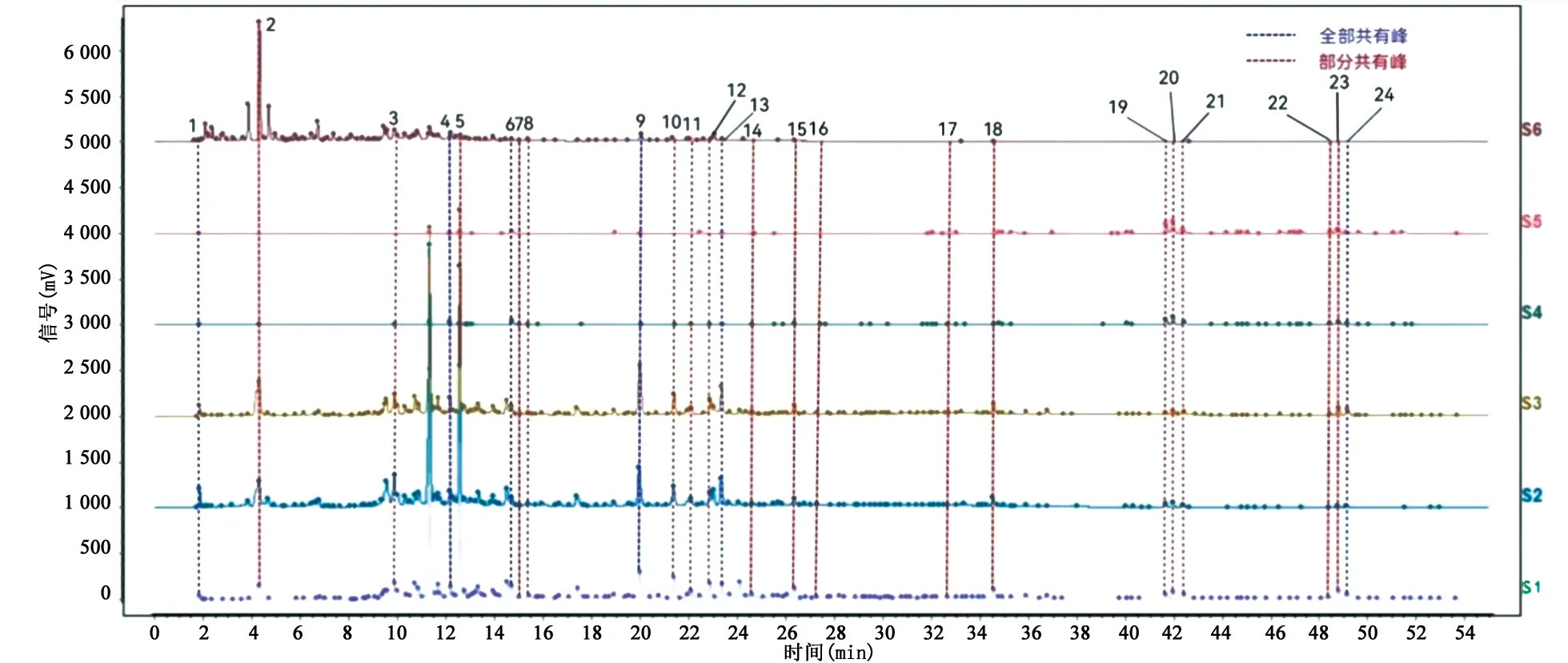
S1.乙酸乙酯提取物;S2.70%乙醇提取物;S3.正丁醇提取物;S4.氯仿提取物;S5.石油醚提取物;S6.水提取物
2.1.5 成分鉴定 按“2.1.2”项下方法制备混合对照品溶液,按“2.1.3”项下色谱条件进样分析,得到核桃楸皮混合对照品图谱(见图2)。经对照品比对,指认出2号峰为没食子酸,4号峰为丁香酸,7号峰为阿魏酸,9号峰为鞣花酸,10号峰为槲皮苷,14号峰为柚皮素,16号峰为山柰酚。

图2 混合对照品图
2.2 核桃楸皮不同极性部位体外药效研究
2.2.1 含药培养液的制备 精密称取核桃楸皮不同极性部位提取物,加DMEM完全培养基(5‰DMSO助溶)配制成浓度为0.6 mg·mL-1的溶液,0.22 μm微孔滤膜过滤,即得。
2.2.2 不同极性部位对人肝癌HepG2细胞抑制作用 取对数生长期、生长状态良好的人肝癌HepG2细胞,以1×105mL-1的密度接种于96孔板中,每孔100 μL,于37 ℃培养箱常规体外培养6~8 h,待细胞贴壁完全后,设不同极性部位给药组和空白对照组,每组设5个复孔,给药24 h后,每孔避光加入100 μL的10%CCK-8溶液,37 ℃培养箱孵育2 h后,酶标仪测定450 nm处的吸光度(OD)值,重复3次,结果见表1。与空白对照组相比,各给药组吸光度明显降低(P<0.01)。
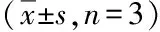
表1 核桃楸皮不同极性部位对人肝癌HepG2细胞的抑制率
2.3 谱效关系研究
2.3.1 灰色关联度分析 根据核桃楸皮不同极性部位的指纹图谱,从中筛选出分离度、对称因子较好的24个色谱峰。采用归一化法对数据进行无量纲化处理,将不同极性部位对人肝癌HepG2细胞抑制作用的药效指标作为母序列,不同极性部位的共有峰峰面积作为子序列。采用灰色关联度分析软件(Grey ModeLing_V3.0)进行分析,得出核桃楸皮不同极性部位色谱峰与体外药效学评价指标之间的关联系数(见表2)。
表2 核桃楸皮不同极性部位色谱峰峰面积及关联系数
从表中数据可知,这24个主要色谱峰代表的化学成分对肝癌抑制作用有一定的差异性,其中相关系数大于0.7的有2、4、7、8、9、10、11、13、14、15、16、17、20号共13个色谱峰。
2.3.2 偏最小二乘回归分析 为了进一步明确核桃楸皮化学成分和药效之间的相关性,将相关系数大于0.7的13个色谱峰峰面积作为自变量(X),药效数据作为因变量(Y),导入SIMCA 14.1软件进行偏最小二乘回归分析,OPLS-DA模型中R2X=0.813,模型预测参数Q2=0.913,均大于0.5,表明建立的模型有效稳定[7]。结果见图3~4。
其中,回归系数的正、负代表各成分对抗肝癌药效的正相关或负相关。由图3可知,2、4、7、8、9、10、11、13、14、15、16、17号峰与药效呈正相关,对药效贡献较大。
图3 回归系数
变量投影(variable influence on projection,VIP)可解释自变量对因变量的贡献程度,VIP值越大,说明该自变量对因变量的贡献越大,VIP>1时表示对因变量有显著贡献[8]。对13个色谱峰的VIP值进行分析,筛选出对核桃楸皮抗肝癌作用影响较大的色谱峰(以VIP>1为标准)有4、8、9、10、11、13、15、16号峰。
综合回归系数和VIP值两个指标,明确4(丁香酸)、8、9(鞣花酸)、10(槲皮苷)、11、13、15、16(山柰酚)号峰所代表的化学成分对药效贡献较大,为核桃楸皮治疗肝癌的药效物质。
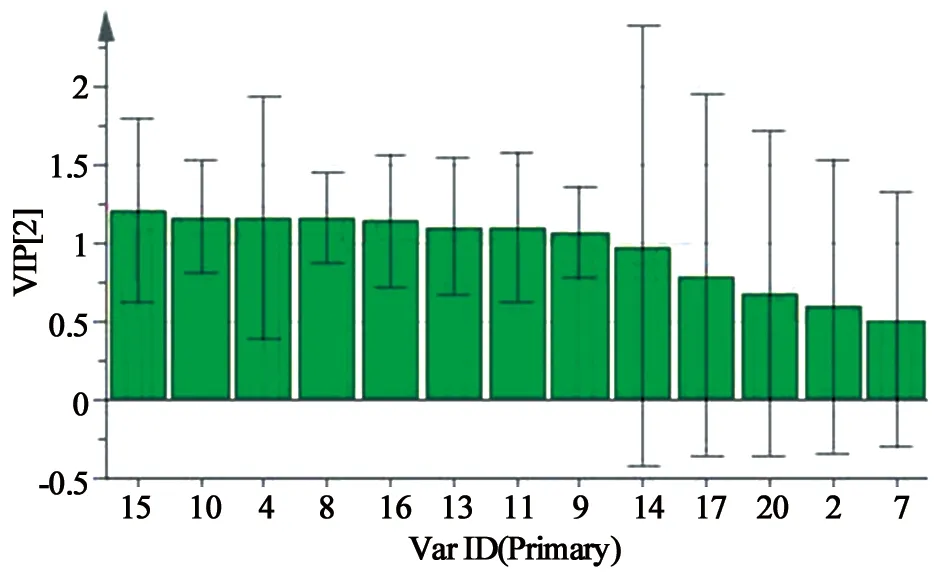
图4 VIP值
2.4 体外药效单体成分验证研究
2.4.1 供试品溶液的制备 按“2.2.1”项下方法制备浓度为0.6 mg·mL-1的乙酸乙酯部位含药培养液。
精密称取丁香酸、鞣花酸、槲皮苷、山柰酚对照品适量,分别加培养液制成浓度为0.6 mg·mL-1的单体给药溶液。
根据乙酸乙酯部位图谱数据,计算出样品中丁香酸、鞣花酸、槲皮苷、山柰酚的含量分别为2.11%、0.95%、2.08%、1.97%。按含量比例精密称取4个对照品,制成浓度为0.6 mg·mL-1的混合单体配伍给药溶液。
2.4.2 不同组分对人肝癌HepG2细胞的抑制作用 取对数生长期、生长状态良好的人肝癌HepG2细胞,以1×105mL-1密度接种于96孔板中,每孔100 μL,于37 ℃培养箱常规体外培养6~8 h,待细胞贴壁完全后,设乙酸乙酯部位给药组、单体成分给药组和空白对照组,每组设5个复孔。给药24 h后,每孔避光加入100 μL的10%CCK-8溶液,37 ℃培养箱孵育2 h后,酶标仪测定450 nm处的吸光度(OD)值,实验重复3次,结果见表3。结果表明,4种单体成分对人肝癌HepG2细胞均有一定的抑制作用。
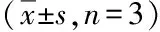
表3 不同组分对人肝癌HepG2细胞的抑制率
根据上述结果,按“2.4.1”项下方法将4种单体成分进行配伍验证,细胞抑制率为71.3%,占乙酸乙酯部位药效的76.3%。表明核桃楸皮治疗肝癌的药效是多种成分协同作用的结果,明确了这4种单体成分为核桃楸皮治疗肝癌的药效物质。
3 讨论
中药的资源丰富,从中药中筛选出具有抗肿瘤活性成分已经变成了近几年来研究者关注的热点领域[9]。核桃楸皮是满药复方木鸡颗粒中抗肝癌的重要药材之一,现代药理学研究表明,其具有明显的抗肝肿瘤活性[10-14],但其抗肝肿瘤的药效物质基础尚不明确。因此,本研究筛选出了核桃楸皮抗肝癌的药效物质,为抗肿瘤药物的临床研发提供参考。
谱效关系是中药药效物质基础的重要手段[15]。本研究采用HPLC法建立了核桃楸皮不同极性部位指纹图谱,获得24个共有峰。采用灰色关联度分析法,获得了与药效关联较大的13个色谱峰。由于灰色关联度分析法仅标识成分对药效的贡献,而不表示其正相关或是负相关[16],因此,本研究在灰色关联分析方法基础上进行偏最小二乘回归分析,获得了抗肝癌作用较强且呈正相关的8个色谱峰,确认这8个峰所代表的化学成分为核桃楸皮治疗肝癌的药效物质。经对照品比对,指认出4号峰为丁香酸、9号峰为鞣花酸、10号峰为槲皮苷、16号峰为山柰酚。丁香酸具有抗内毒素、抗白内障、抗氧化及抗肿瘤作用[17-20]。鞣花酸具有明显的抗肝损伤、抗肿瘤血管生成、抗氧化、抗衰老等作用[21-23]。槲皮苷具有抗心脑血管疾病、抗白内障、抗炎及抗肝损伤等作用[24-26]。山柰酚具有抗抑郁、抗肿瘤、抗炎、抗氧化等作用,可以增强抗癌活性,减少心脏毒性[27-29]。
本研究根据HPLC图谱数据计算出了4种单体成分含量,并按含量比例配伍,进行体外药效验证。结果显示,4种单体成分均有一定的药效,单体配伍组药效占乙酸乙酯部位药效的71.3%,明确了这4种成分为核桃楸皮治疗肝癌的药效物质,初步揭示了核桃楸皮治疗肝癌的药效物质基础。
