山药提取物对烤马友鱼中杂环胺的抑制作用
2023-02-17林松毅王睿纯王新艳张思敏
李 梦,林松毅,2,3,王睿纯,王新艳,张思敏,2,3*
(1 大连工业大学食品学院 辽宁大连 116034 2 国家海洋食品工程技术研究中心 辽宁大连 116034 3 海洋食品精深加工关键技术省部共建协同创新中心 辽宁大连 116034)
马友鱼,又称四指马鲅 (Eleutheronema tetradactylum),多分布在湛江徐闻地区。因具有较广的盐度适应范围与较快的生长速度,而使其具有较好的经济开发价值,又因其肉质鲜美而深受消费者喜爱[1]。马友鱼在鱼类中属于脂肪含量较高的一种,口感极其肥美,入口绵密、细腻,十分受食客们的欢迎。 然而,马友鱼鳃丝面积小且疏离,氧气交换能力较差,一旦被捕捞上岸便立即死亡,且难以运输,导致人们几乎吃不到鲜活的马友鱼,若将其制成烤鱼,既能品尝到马友鱼鲜美的味道,又可以让其更易保存和运输[2],然而,高蛋白、高脂肪鱼类在烤制过程中易产生一类多环芳香族化合物——杂环胺。
杂环胺是鱼、 肉制品经高温烹饪产生的一类具有致突变性、 致癌性及心肌毒性的芳香族杂环化合物。影响杂环胺形成的主要因素有温度、时间及加工方式等。 目前,从物质中分离的杂环胺有30 余种。 依据生成条件将杂环胺分为两类[3-4],分别为氨基-咪唑-氮和氨基咔啉。其中,加热温度在100~250 ℃范围内形成的杂环胺称为氨基-咪唑-氮杂芳烃类,其主体均是具有1 个主体N-甲基-氨基咪唑,氨基-咪唑-氮类又可细分为喹啉类:Trp-P-1,Aac,Trp-P-2,MeAac;喹啉类:IQ,MeIQ;喹喔啉类:IQx,MeIQx,4,8 -DiMelQx,7,8 -DiMelQx;吡啶类:PhlP;呋喃吡啶类:IFP。 而氨基咔啉类杂环胺是氨基酸经过300 ℃高温热降解后形成的非极性杂环胺,其按结构细分为α-咔啉类(AαC,MeAαC),β-咔啉类(Harman,Norharman)、γ-咔啉类(Trp-P-1 等)、δ-咔啉类。 一般来说,鱼肉制品中蛋白质、氨基酸、糖类以及它们加热后生成的葡萄糖、肌酸、肌酸酐等都是杂环胺形成的前体物质,再进一步通过自由基途径及美拉德反应等途径形成[5]。
控制杂环胺在食物中的生成,是科研人员研究的一大课题,其中添加外源抗氧化物质是一种有效的降低杂环胺的手段。国内外学者发现,通过添加植物(如越桔叶[6]、玫瑰茶[7]、绿茶[8]、马齿苋[9]、洋蓟[10]、鼠尾草[11]、山楂[12]、香辛料[13]等)提取物,使用腌制液(如冰糖、酱油、米酒[14]、啤酒、白酒[15]、红酒[16])腌制等方式可降低烤制肉饼中杂环胺的生成。 山药具有抗肿瘤,免疫调节,抗氧化,抗糖尿病,抗突变[17]等生物活性,且山药的抗氧化作用十分优异。 尚晓娅等[18]制备白色山药精制多糖粉末(CYP),以其对羟自由基清除率为指标,结果表明:当CYP 质量浓度为3 mg/mL 时,对羟自由基的清除率高达97%,可有效抑制小鼠肝匀浆的自氧化。 本试验选用山药提取物来研究其对烤马友鱼杂环胺的抑制效果。 以杂环胺前体物(肌酸、肌酐、葡萄糖、游离氨基酸)、脂质氧化和蛋白氧化为指标,研究添加山药提取物对烤马友鱼中杂环胺的抑制机理。通过挥发性风味变化,评估添加山药提取物对烤马友鱼风味的影响。 本研究旨在为烤马友鱼的合理加工提供理论参考,为其它鱼肉制品加工中杂环胺形成和抑制提供试验数据。
1 材料与方法
1.1 材料与试剂
马友鱼购于大连长兴市场,-20 ℃冷冻待用;山药提取物由河南宣新生物科技有限公司提供。
杂环胺标准品,坛墨质检:2-氨基-3 甲基咪唑并[4,5-f]喹啉(IQ)、2-氨基-3 甲基咪唑并[4,5-f]喹喔啉(IQx)、2-氨基-3,4-二甲基咪唑并[4,5-f]喹啉(MeIQ)、2-氨基-3,8-二甲基咪唑并[4,5-f]喹喔啉(8-MeIQx)、2-胺基-3,4,8-三甲基-3H-咪唑并[4,5-f]喹喔啉(4,8-DiMeIQx)、2-胺基-3,7,8-三甲基-3H-咪唑并 [4,5-f] 喹喔啉 (7,8-DiMeIQx)、3-氨基-1,4-二甲基-5H-吡啶并[4,3-b]吲哚(Trp-P-1)、3-氨基-1-甲基-5H-吡啶并[4,3-b]吲哚(Trp-P-2)、2-氨基-9H-吡啶并[2,3-b]吲哚(AaC)、2-氨基-3-甲基-9H-吡啶并[2,3-b]吲哚 (MeAaC)、2-氨基-1-甲基-6-苯基-咪唑并[4,5-b] 吡啶 (PhIP)、9H-吡啶并[3,4-b] 吲哚(Norharman)、1-甲基-9H 吡啶并 [3,4-b] 吲哚(Harman); 蛋白质羰基含量检测试剂盒,Solarbio公司;肌酐试剂盒,南京建成生物工程研究所;肌酸、肌酐、葡萄糖标准品,上海源叶;2-硫代巴比妥酸,上海麦克林生化科技有限公司;三氯乙酸、无水乙醚、氢氧化钠等试剂均为分析纯级。
1.2 仪器与设备
液相色谱质谱仪,Agilent 公司;高速冷冻离心机,Thermo 公司;LA8080 高速氨基酸分析仪,HITACHI;FlavourSpecR风味分析 仪,Gesellschaft für Analytische Sensorysteme mbH。
1.3 方法
1.3.1 马友鱼的制备 将马友鱼切成4 cm×5 cm×0.5 cm 的鱼片,分成2 组,分别为对照组与添加山药提取物组,每3 片为一组用作平行试验。腌料比例:1 勺生抽(约6.8 g),2 勺朗姆(约14.6 g),6 勺橄榄油(约31.0 g),2 勺料酒(约15.4 g),0.2 g 味精,1.0 g 糖,1.5 g 盐,用于腌制3 片鱼片。 山药提取物组中加入调料总量1%(0.5 g)的山药提取物。在240 ℃条件下烤制10 min。
1.3.2 脂肪氧化的测定(TBARS) 称取1 g 搅碎的鱼肉,加入5 mL 的TBARS 溶液(0.375%的2-硫代巴比妥酸,15%的三氯乙酸,0.25 mol/L 盐酸)沸水浴20 min,待溶液变为粉红色后流水冷却。在4 ℃条件下8 000 r/min 离心15 min,取上清液在532 nm 波长下测吸光度。 按式(1)计算脂肪氧化量:
1.3.3 蛋白氧化的测定(蛋白质羰基试剂盒) 蛋白氧化采用蛋白质羰基试剂盒测定。 测定原理为羧基与2,4-二硝基苯腙,在370 nm 波长处有特征吸收峰。
1.3.4 pH 值的测定 根据GB 5009.237-2016 规定的方法对食品中pH 进行测定[19]。取切碎的鱼肉样品2 g 于50 mL 离心管中,加入20 mL 的0.1 mol/L 氯化钾溶液后,均质2 min,利用pH 计测定(应确保待测试验温度在20±2 ℃)pH 值,待pH 计数字稳定后,读数。 平行3 次,准确至0.01。
1.3.5 前体物测定
1.3.5.1 肌酸测定 称取 (0.25±0.00)g 切碎的鱼肉放入烧杯中,加入100 mL 的30 g/L 三氯乙酸后均质5 min(8 000 r/min)取上清液,经过滤纸过滤,用于除去蛋白质沉淀。然后取20 mL 滤液置于50 mL 离心管中,之后加入10 mL 乙醚,对20 mL 的提取液进行脱脂处理,振荡均匀后静置10 min,以分离各相。取4 mL 的脱脂层即底层,加入2 mL 的丁二酮和2 mL 的1-萘酚。 再将这个混合物在40℃下超声提取5 min,最后在520 nm 波长处用酶标仪测定各个样品的吸光度。 之后用标准品做标准曲线,计算出样品的肌酸含量,单位为mg/g。
1.3.5.2 肌酐测定 将1 g 切碎的鱼肉样加入20 mL 的30 g/L 三氯乙酸,用均质机以9 000 r/min 均质5 min,取上清液用滤纸过滤,除去蛋白质沉淀。取8 mL 滤液置于离心管中,加入4 mL 乙醚,振荡摇匀,静置10 min,取底层液体作为样本。
使用肌酐试剂盒测定,在96 孔孔板中滴定,测定组加入6 μL 样本后加入试剂1(酶溶液A)取180 μL,标准组加入6 μL 试剂3(标准品)再加入180 μL 试剂1(酶溶液A),空白组6 μL 双蒸水加入180 μL 试剂1 (酶溶液A),之后37 ℃孵育5 min 后,在546 nm 波长处测定吸光度A1。 之后3种都加入60 μL 试剂2(酶溶液B),在37 ℃恒温5 min,在546 nm 波长处测定吸光度A2。 按式(3)计算样品肌酐含量:
式中,标准品浓度为442 μmol/L。
1.3.5.3 还原糖测定 取5 g 剁碎的鱼肉样品,加入30 mL 的去离子水再加入5 mL 乙酸锌溶液,最后加入5 mL 亚铁氰化钾溶液(沉淀蛋白质),置于2 个50 mL 离心管中,之后涡旋混匀,在50 ℃水浴中加热20 min,之后配平,以4 000 r/min 离心5 min。 取上清液,置于100 mL 容量瓶中。 将剩余沉淀加入20 mL 水,混匀后再以4 000 r/min 离心5 min,将此次上清液也倒入之前的100 mL 容量瓶中,定容至刻度线。 摇匀后倒入烧杯中,静置一段时间后,取1 mL 中间层清液,加入1.5 mL DNS 溶液于玻璃试管中,沸水加热5 min,之后取出流水冲凉后,加入7.5 mL 去离子水,摇匀。 之后在540 nm 波长处用酶标仪测定吸光度,之后根据标准曲线计算葡萄糖含量。
1.3.5.4 氨基酸测定 样品前处理:取3 g 样品加入到15 mL 0.02 mol/L 的盐酸中,转速为6 000 r/min,匀浆1 min。 在4 ℃,转速10 000 r/min 条件下,离心10 min。 取2 mL 上清液加入8 mL 丙酮,摇匀后静置,10 000 r/min 离心10 min。 取3 mL 上清液在60 ℃下进行旋蒸后,加入2 mL 的0.02 mol/L HCl,对样品进行复溶,最后通过0.22 μm膜过滤,采用LA8080 高速氨基酸分析仪进行测定。
1.3.6 杂环胺测定 称取2 g 左右的剁碎鱼肉样品,加入1 mL 去离子水,振荡混匀静置10 min,加入9 mL 乙腈溶液 (其中包含1%乙酸),振荡10 min,加入萃取包(4 g 无水硫酸镁和1 g 无水醋酸钠),用手振荡1 min。用离心机以6 000 r/min 离心10 min。 取上清液6 mL 加入离心管中(包含900 mg 无水硫酸镁、300 mg PSA 和300 mg C18EC),振荡1 min,用离心机以6 000 r/min 离心5 min。取1 mL 上清液用氮吹仪吹干,加入1 mL 甲醇溶液,涡旋复溶,过0.22 μm 滤膜后上机测定。进样量:5 μL,流动相A 为5 mmol/L 乙酸铵水溶液(含0.1%甲酸),流动相B 为乙腈,流速为0.3 mL/min。 流动相梯度见下表:
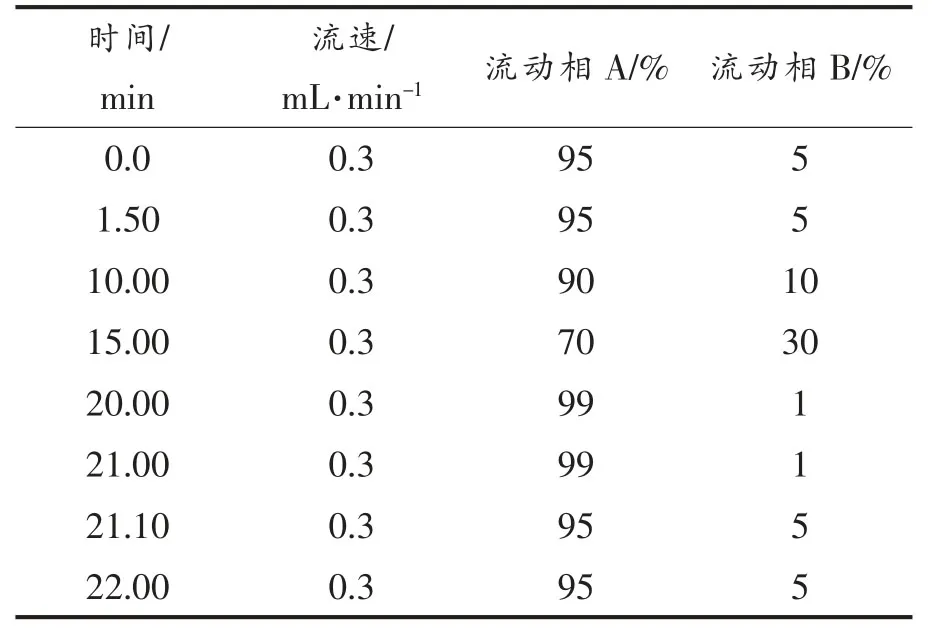
表1 杂环胺检测过程流动相梯度Table 1 Mobile phase gradient of HAs detection
1.3.7 气相色谱-离子迁移谱分析(GC-IMS) 将烤马友鱼捏碎,称取1 g 置于20 mL 顶空瓶中,80℃孵化15 min 后进样测试。 进样针温度为85 ℃,进样体积200 μL,孵化转速为500 r/min。 气相色谱条件见表2。
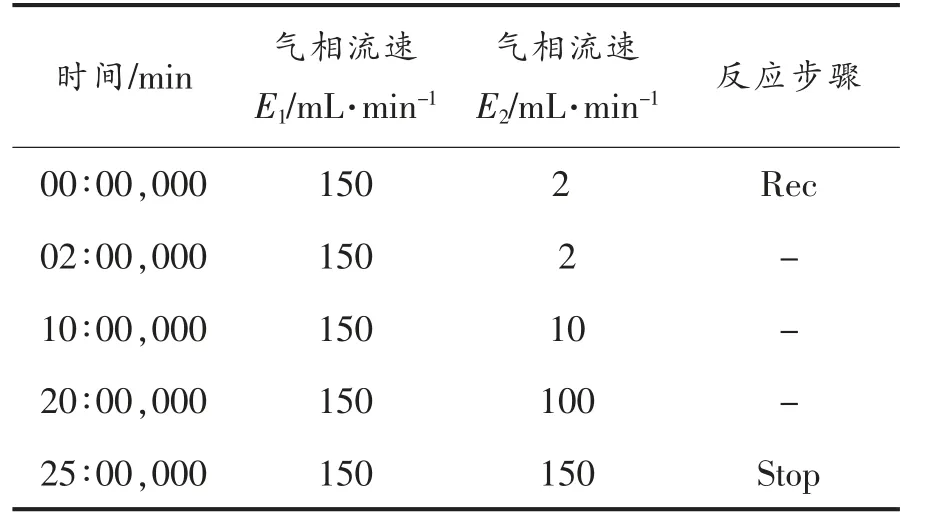
表2 气相色谱条件Table 2 GC-IMS conditions
1.4 数据统计
运用SPSS 19.0 统计软件进行显著性差异分析,P<0.05 表示差异显著。 采用Origin 8.5 软件绘图。
2 结果与分析
2.1 山药提取物对烤马友鱼杂环胺生成的影响
由表3 所示,一共检测了13 种杂环胺,对照组总共检测出4 种杂环胺,为IQ、8-MeIQx、Norharman 与Harman,这4 种杂环胺含量分别为0.294,0.754,14.967 ng/g 和15.767 ng/g。 添加了山药提取物后,杂环胺含量显著降低,IQ 与8-MeIQx 含量降低到检测线以下,Norharman 与Harman 分别降低59.08%和47.99%。 可能是由于山药提取物的自由基清除能力,在反应的不同途径上,作为杂环胺的抑制剂,从未减少杂环胺的形成。

表3 山药提取物对烤马友鱼杂环胺含量的影响(ng/g)Table 3 Effect of yam extracts on the content of HAs in roasted Eleutheronema tetradactylum (ng/g)
2.2 山药提取物对烤马友鱼理化指标的影响
烤制后失重反映其烹饪损失,是考察肉类质量的重点参数。 肌纤维柱和肌浆蛋白、多磷酸盐、盐、 脂质等可以随着高温条件下水含量的降低而减少[20]。 由表4 可知,添加了山药提取物的烤马友鱼的质量与对照组相比无明显差异,证明添加山药提取物对烤马友鱼烤制损失无影响。 对照组与生肉相比,pH 值明显降低,而添加了山药提取物组与对照组相比,pH 值显著升高(P<0.05)。

表4 山药提取物对烤制后马友鱼失重及pH 值的影响Table 4 Effects of yam extract on weight loss and pH value of roasted Eleutheronema tetradactylum
2.3 山药提取物对杂环胺前体物(肌酸、肌酐、葡萄糖、氨基酸)的影响
由表5 可知,对照组马友鱼烤制后的肌酸含量与生肉相比显著减少,肌酐含量显著增多,这可能是由于马友鱼在加工过程中,肌酸在高温下转化为肌酐,杂环胺含量增多。 由表3 可知,杂环胺主要含量集中在Norharman 及Harman 中,而IQ、8-MeIQx 和其它杂环胺含量较少,有研究表明Norharman 与Harman,其形成主要来自色氨酸等氨基酸,几乎不受肌酸和肌酐的影响[21]。 山药提取物组相比对照组,肌酸、肌酐等前体物含量均有不同程度增加,说明山药提取物的添加可能阻碍了前体物向杂环胺的转化,从而抑制了杂环胺的生成。肌肉中的糖类多以糖原的形式存在,这可能是生肉组葡萄糖含量低的主要原因。 Skog 等[22]用14C 同位素标记法证实来自于葡萄糖的碳原子与咪唑喹喔啉衍生物结合形成IQx、8-MeIQx 和4,8-DiMeIQx。本研究可能是山药提取物阻止了杂环胺前体物葡萄糖的转化,从而降低了杂环胺的含量。
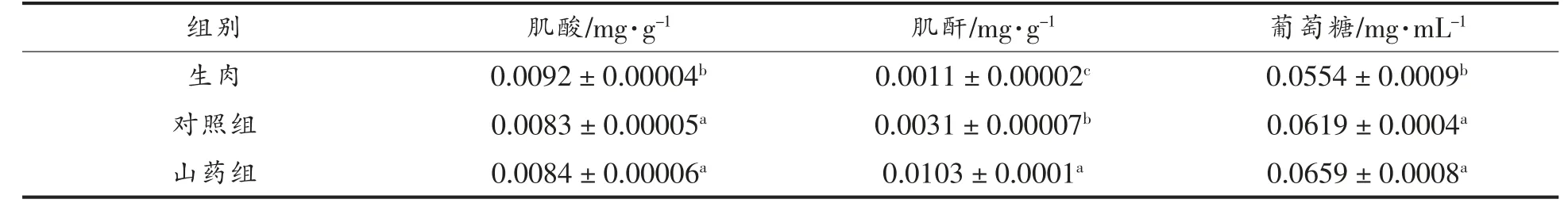
表5 马友鱼烤制后及生肉中肌酸、肌酐、葡萄糖的含量Table 5 Concentration of creatine,creatinine and glucose in roasted and raw Eleutheronema tetradactylum
添加了山药提取物后,对游离氨基酸的含量产生了影响。 有研究证明甘氨酸、苯丙氨酸、丙氨酸及苏氨酸等氨基酸是杂环胺的前体氨基酸[23-25]。生肉中的氨基酸含量显著高于烤制后的氨基酸含量,添加了山药提取物组中甘氨酸的含量高于对照组,甘氨酸已被证明是MeIQx 的前体氨基酸[26],甘氨酸含量的增加说明添加山药提取物可能阻碍了甘氨酸前体物向杂环胺的转化。 因此对MeIQx有一定的抑制作用。
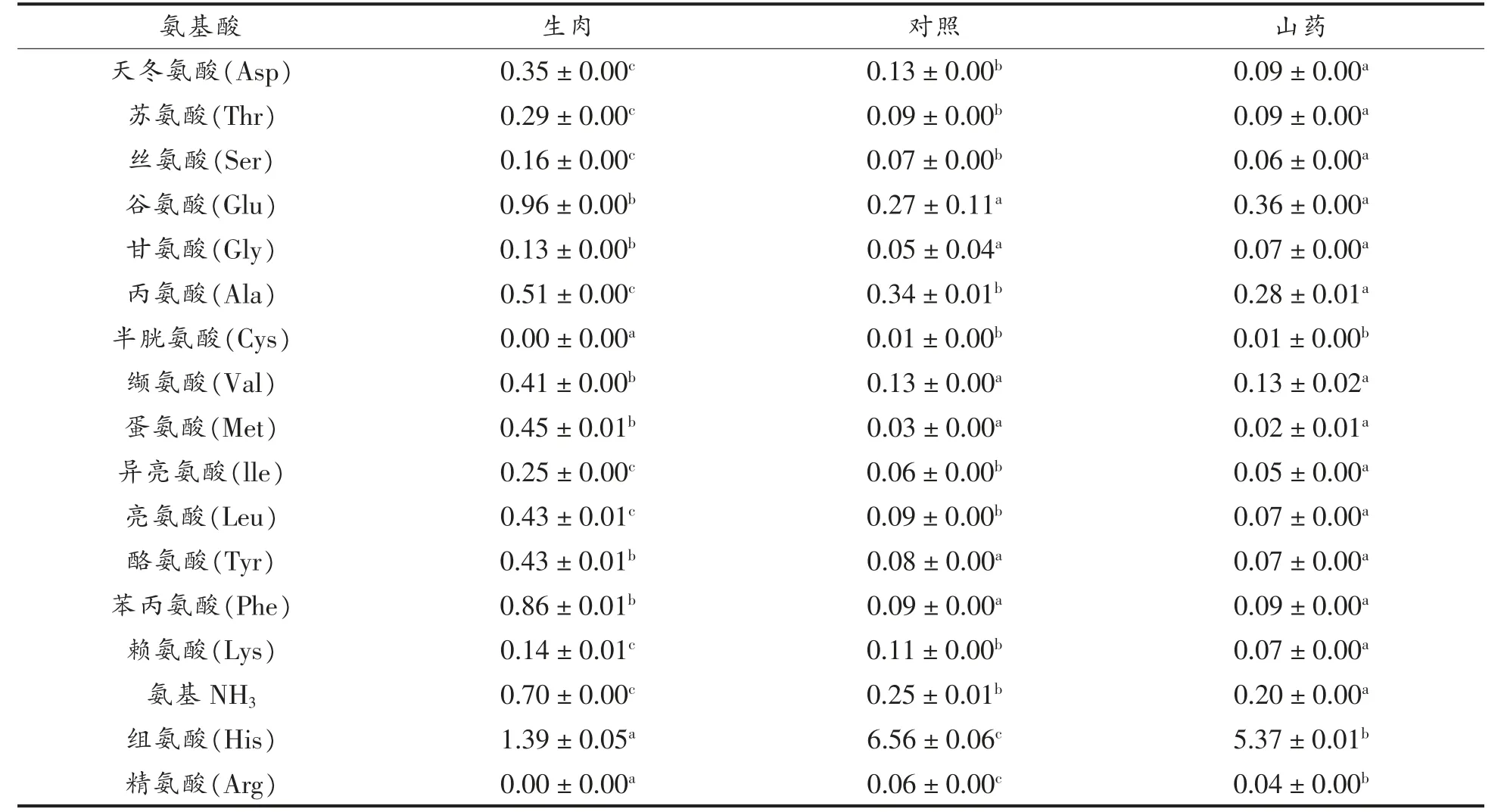
表6 马友鱼烤制后及生肉中氨基酸的含量(mg/g)Table 6 Concentration of amino acid in roasted and raw Eleutheronema tetradactylum (mg/g)
2.4 山药提取物对脂肪氧化的影响
脂质氧化是通过测量各组烤马友鱼中的TBARS 值来进行表示。 由图1 可知,其中生肉组的脂质氧化程度最低为(0.560±0.006) mg MDA/kg,对照组烤马友鱼的TBARS 值为(1.068±0.026)mg MDA/kg。 而添加了山药组烤马友鱼的TBARS值显著小于对照组。 TBARS 值的降低表示添加物对脂质氧化有较好的抑制作用,与肉类脂肪氧化程度有很强的相关性[27]。 山药中的山药多糖可以通过清除羟基自由基等途径来减少油炸鱼中脂质氧化的生成[28]。 结果表明,杂环胺含量变化与脂质氧化变化呈正相关。已有研究表明,脂质氧化对肉制品中杂环胺的形成有促进功能,可能是由于氧化产物羰基化合物与氨基酸结合,发生了Strecker降解,从而使样品中苯乙醛等的前体物质增多,从而对杂环胺的生成产生促进作用[29]。 说明通过山药提取物来降低烤马友鱼的脂质氧化是一种有效减少杂环胺的手段。
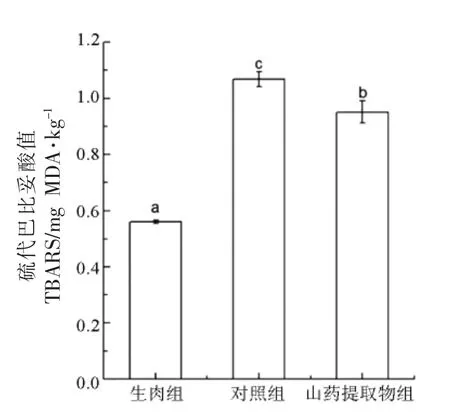
图1 烤马友鱼中硫代巴比妥酸值含量Fig.1 TBARS values in roasted Eleutheronema tetradactylum with yam extracts
2.5 山药提取物对蛋白氧化的影响
羰基化是一种非酶促不可逆的蛋白质氧化修饰,由氧化应激或其它机制诱导蛋白质的羰基形成过程,是蛋白质氧化最重要的表征模式[30]。 图2为样品蛋白质的羰基含量,由图可知,与对照组的羰基值(0.0036±0.0003) nmol/mg 相比,添加山药提取物的烤马友鱼中的蛋白质羰基含量明显降低,为(0.0027±0.0006)nmol/mg。结果表明,杂环胺含量变化与蛋白氧化变化呈正相关。 在烹饪过程中,不仅抗氧化防御系统受损,自由基也随之产生,导致蛋白质氧化[31]。 这可能是由于添加山药提取物后,使烤马友鱼中自由基含量降低,从而使蛋白质羰基值与杂环胺含量变化一致。
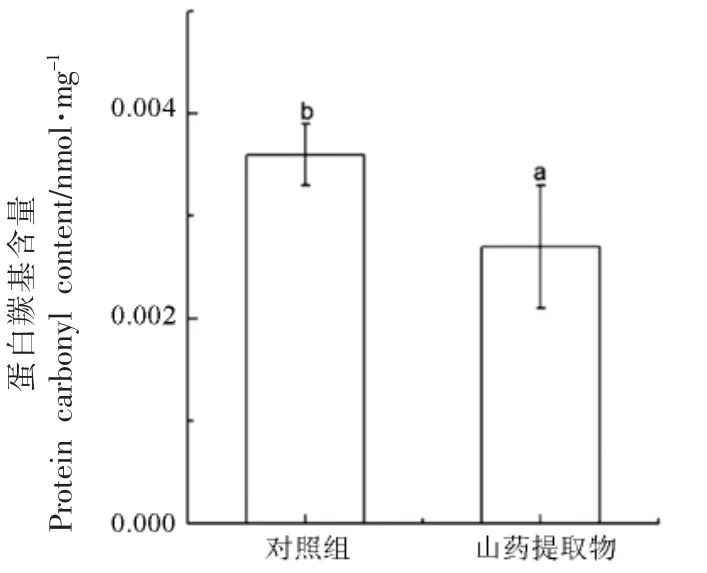
图2 烤马友鱼中蛋白质羰基含量Fig.2 Protein carbonyl values in roasted Eleutheronema tetradactylum with yam extracts
2.6 山药提取物对挥发性风味的影响
由表7 可知,烤马友鱼中的挥发性有机物主要包括醛类、吡嗪类、酮类和酯类等。 图3 可以明显看出,不同烤马友鱼中的挥发性有机物存在差异;为了明确具体哪些物质存在差异,选取所有峰进行指纹图谱(图4)对比。 图4 红框中的物质,添加了山药的烤马友鱼的含量低于对照,包括辛醛、2-丁酮、异丁醛、3-甲基丁醛、2-甲基丁醛、庚醛、己醛、壬醛和2,3-二甲基吡嗪等,多数为醛类。 结果显示添加了山药的烤马友鱼中多种醛类物质含量降低。 图5 为空白和添加了山药的马友鱼的PCA 分析图,该图可以直观的显示不同样品间的差异,样品之间距离近则代表差异小,距离远则代表差异明显。 由图5 可知,添加了山药后,烤马友鱼中的挥发性有机物变化很大。
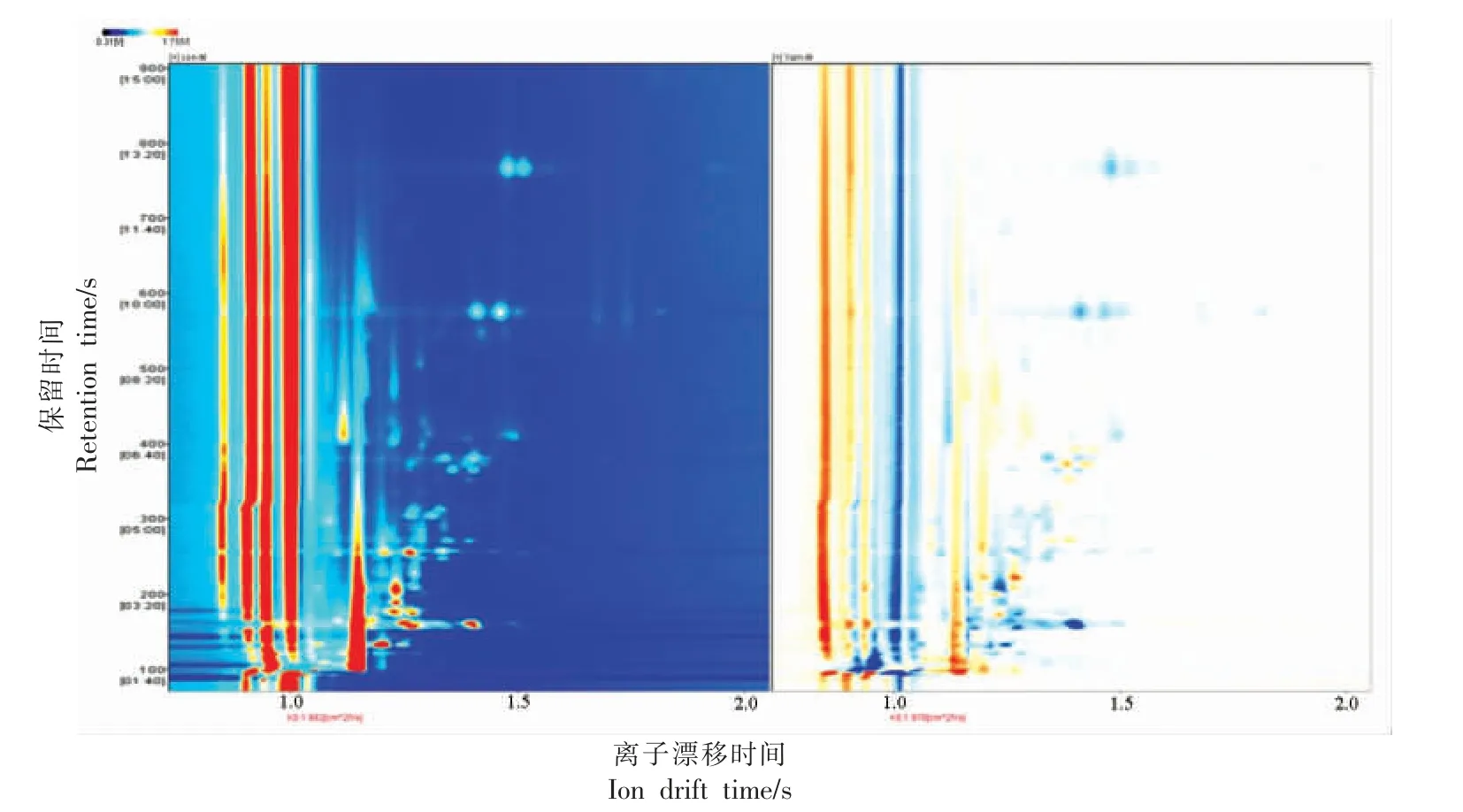
图3 对照组和山药组中挥发性有机物的GC-IMS 谱图(差异对比)Fig.3 GC-IMS spectra of volatile organic compounds in the control group and the yam group (difference comparison)

图4 对照组和山药组中挥发性有机物的指纹谱图Fig.4 Fingerprint spectra of volatile organic compounds of control group and yam extract group via GC-IMS gallery plot
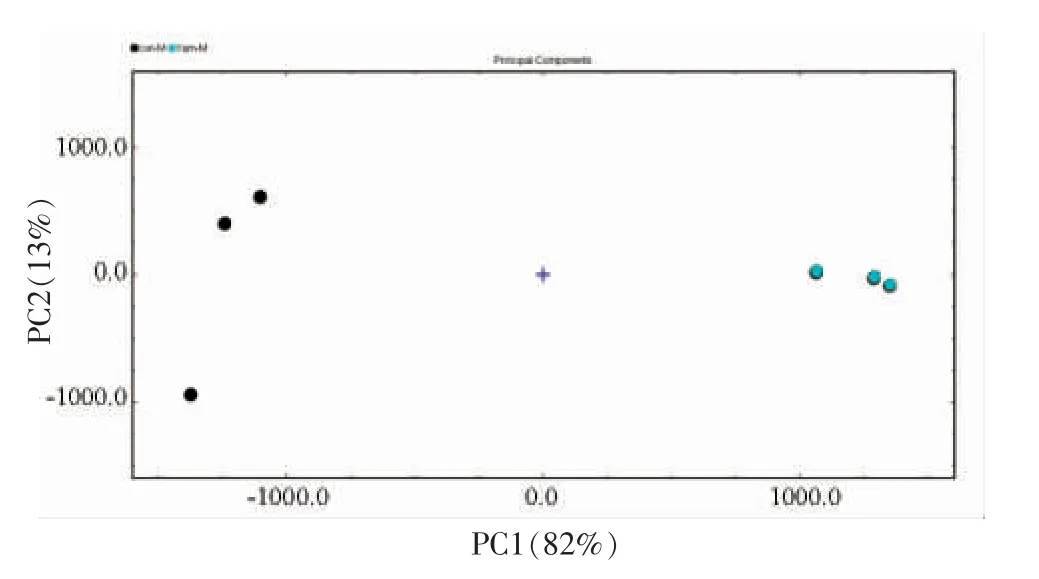
图5 对照组和山药组主成分分析图Fig.5 Principal component analysis (PCA) plot of volatile organic compounds of the control group and the yam extract group via GC-IMS

表7 化合物列表Table 7 List of inorganic compounds
3 结论
本研究选用营养价值高的马友鱼作为原料,将山药提取物添加到腌泡汁中,对将马友鱼腌泡后进行烤制,显著降低了烤马友鱼中杂环胺的含量,其中IQ 与8-MeIQx 含量降低到检测线以下,Norharman 与Harman 分别降低59.08%和47.99%。通过失重与pH 值结果可得,添加了山药提取物对其理化指标无明显影响; 通过硫代巴比妥酸值与蛋白质羰基值分析,添加山药提取物后可以显著降低烤制马友鱼过程中的脂质氧化与蛋白氧化,且与杂环胺含量呈正相关; 添加山药提取物后,肌酸、肌酐、还原糖和氨基酸含量的变化,证明了添加山药提取物抑制了前体物向杂环胺的转换,从而降低了杂环胺含量。此外添加山药提取物后,对烤马友鱼风味有一定影响,包括辛醛、2-丁酮、异丁醛、3-甲基丁醛、2-甲基丁醛、庚醛、己醛、壬醛和2,3-二甲基吡嗪等物质有一定程度的降低。 本研究为烤马友鱼的合理加工提供理论依据与参考,在防止食品高温热加工杂环胺危害,提高食品加工安全性方面具有重要意义。
