玉米糖肽对酒精诱导损伤LO2细胞的保护效应
2023-02-17王晓杰刘晓兰
王晓杰,童 玲,刘晓兰
(齐齐哈尔大学食品与生物工程学院 黑龙江省玉米深加工理论与技术重点实验室 黑龙江齐齐哈尔 161006)
据世界卫生组织(WHO)报告,饮酒与200 多种疾病和伤害有关[1]。 肝脏是酒精代谢的主要器官,90%的酒精摄入量由肝脏代谢,肝脏也是酒精毒性的主要靶器官[2]。长期大量饮酒或酗酒容易引发肝脏损伤性疾病,且不容易受到控制。酒精性肝损伤的特征是脂肪变性、炎症、坏死,最终导致纤维化和肝硬化,约有15%的酒精性肝硬化患者会发展成肝癌,其引发的健康和社会问题不容忽视[3-4]。目前,酒精性肝病的临床治疗主要采取戒酒、营养支持和对症治疗等综合疗法,目的是减轻酒精性肝损伤的临床症状,降解清除已经形成或者正在形成的纤维组织,以防止肝硬化的发生。尽管现代医学取得了长足的进步,但仍没有特效药物能使肝病患者痊愈,而且一般的抗酒精药物会导致副作用或产生新的毒性[5-8]。 研发拮抗酒精性肝损伤的天然、低毒副作用、多途径的肝保护剂,是目前医学和食品科学领域共同关注的问题。
玉米糖肽是玉米蛋白经蛋白酶水解获得低分子质量的玉米肽,然后,在转谷氨酰胺酶催化下与氨基糖共价结合的产物。与玉米肽相比,玉米糖肽的溶解性显著增加,并具有更高的抗氧化活性及乙醇脱氢酶激活活性[9-10],推测玉米糖肽具有在体内发挥促进酒精代谢和拮抗酒精性肝损伤的潜力。然而,目前鲜有关注玉米糖肽在细胞水平上拮抗酒精性肝损伤的活性研究。
本试验以细胞存活率为指标,构建LO2 细胞酒精性损伤模型,然后,用构建成功的LO2 细胞损伤模型,以GSH 为阳性对照,从LO2 细胞存活率、酒精代谢酶活力、氧化应激水平及细胞凋亡情况等角度,评价玉米糖肽对酒精诱导损伤的LO2细胞的保护效应,并分析可能的保护机制,为后续用动物模型研究玉米糖肽拮抗酒精性肝损伤的效应及作用机制奠定理论基础。
1 材料与方法
1.1 材料与试剂
LO2 细胞株,南京凯基生物技术有限公司;噻唑兰(MTT),上海生工生物技术有限公司;DMEM高糖培养基、 胎牛血清、0.25%胰蛋白酶,Gibco 公司;丙氨酸氨基转移酶(Alanine aminotransferase,ALT)、 天冬氨酸氨基转移酶 (Aspartate aminotransferase,AST)、乳酸脱氢酶(Lactate dehydrogenase,LDH)、活性氧簇(Reactive oxygen species,ROS)、谷胱甘肽过氧化物酶(Glutathione peroxidase,GSH-Px)和Annexin V-FITC/PI 双染细胞凋亡检测试剂盒,南京建成生物工程研究所;乙醇脱氢酶(Alcohol dehydrogenase,ADH)、乙醛脱氢酶(Acetaldehyde dehydrogenase,ALDH)、 超氧化物歧化酶(Superoxide dismutase,SOD)、过氧化氢酶(Catalase,CAT)、谷胱甘肽(Glutathione,GSH)和丙二醛(Malondialdehyde,MDA)检测试剂盒,上海江莱生物有限公司。
1.2 仪器与设备
NV 4750E 二氧化碳培养箱,美国纽埃尔公司;FC500 流式细胞仪,美国贝克曼库尔特公司;SX-500 高压蒸汽灭菌锅,日本TOMY 公司;En-Spire 酶标仪,美国PerkinElmer 股份有限公司;LX73 荧光倒置显微镜,日本Olympus 公司;VELOCITY14R 高速离心机,澳大利亚Dynamica 公司;NDA701 杜马斯定氮仪,意大利VELP 公司。
1.3 试验方法
1.3.1 样品的制备 参照文献[11]的方法制备玉米肽和玉米糖肽。 按蛋白基称取配制10 mL,8 mg/mL 玉米糖肽和玉米肽溶液所需的样品量,放于干净小烧杯内,于无菌条件下加入DMEM 培养基,用无菌移液器反复吸打使样品充分溶解。 用0.22 μm 的无菌过滤器对玉米糖肽和玉米肽溶液进行过滤除菌,于-20 ℃保存备用。
1.3.2 LO2 细胞的培养 将解冻的LO2 细胞悬液转移到装有5 mL DMEM 完全培养基 (含10%胎牛血清、1%青-链霉素双抗)的25 cm2细胞培养瓶中,于37 ℃,5%CO2的二氧化碳培养箱中培养。待LO2 细胞生长融合度达到80%~90%时进行传代培养。 选用20~30 代细胞进行试验。
1.3.3 玉米糖肽对LO2 细胞的毒性试验 采用细胞存活率表征玉米糖肽是否对LO2 细胞产生毒性效应,测定方法参照Li 等[12]描述的MTT 法,略有修改。 取96 孔板,每孔加入100 μL,密度为1×105cells/mL(以下试验均采用该密度)、对数生长期的LO2 细胞悬液,37 ℃培养24 h。 样品组每孔加入100 μL 待测样品溶液,使待测样品的终质量浓度分别为0.05,0.1,0.2,0.5,1,2,4,8 g/mL,对照组每孔加入100 μL DMEM 培养基,37 ℃培养6 h。培养结束后,吸弃孔内液体,加入磷酸盐缓冲液(0.01 mol/L,pH 7.2~7.4,下同)清洗细胞2 次,每孔再加入100 μL 磷酸盐缓冲液和10 μL 终质量浓度为0.5 mg/mL 的MTT 溶液,37 ℃培养4 h。 吸弃孔内液体,每孔加入150 μL 二甲基亚砜,将96孔板放在37 ℃,500 r/min 的微孔板振荡仪上振荡10 min。 用酶标仪检测样品组和对照组每孔在570 nm 波长处的吸光度值,按照公式(1)计算细胞存活率。
1.3.4 玉米糖肽对酒精诱导损伤LO2 细胞的保护作用 按1.3.3 节的方法用24 孔板培养LO2细胞。 试验分为对照组、酒精组和样品组,样品组每孔中加入1 mL 样品溶液,使样品终质量浓度为5,10,25,50 μg/mL,对照组和酒精组每孔加入1 mL DMEM 培养基,37 ℃培养6 h。吸弃孔内液体,对照组每孔加入2 mL DMEM 培养基,酒精组和样品组每孔加入2 mL 500 mmol/L 酒精溶液,37℃培养24 h。 收集LO2 培养液,用于检测AST、ALT 和LDH 活力; 用500 μL 磷酸盐缓冲液清洗细胞2 次,一部分平板按1.3.3 节的MTT 法测定酒精组和样品组的细胞存活率,一部分平板用胰酶消化细胞,将细胞悬液收集于无菌离心管中。向细胞沉淀中加入高效RIPA 裂解液,4 ℃裂解30 min,10 000 r/min 离心5 min,收集上清液于-80℃冰箱中保存备用。 取适量裂解液放置于冰水浴中,按照试剂盒说明书测定CAT、SOD、ADH、ALDH 和GSH-Px 活力以及MDA 和GSH 含量。
1.3.5 LO2 细胞内ROS 含量的测定 参考Wang和Lee 等描述的方法[13-14],略有修改。细胞培养、造模与1.3.4 节相同。培养结束后,将孔内液体弃去,每孔用100 μL 磷酸盐缓冲液清洗2 次,每孔加入100 μL 10 μmol/L 的2',7'-二氯荧光黄双乙酸盐(2,7-Dichlorodihydrofluorescein diacetate,DCFHDA)探针溶液,37 ℃孵育20 min。将孔内探针溶液弃去,用磷酸盐缓冲液清洗2 次。 取一部分96 孔板在激发波长485 nm,发射波长530 nm 的条件下,测定孔内荧光强度,并用公式(2)计算相对ROS 水平(%);另取一部分孔板用荧光倒置显微镜观察和记录细胞内绿色荧光的强度。
1.3.6 玉米糖肽对酒精诱导的LO2 细胞凋亡的拮抗作用 细胞培养、造模与1.3.4 节相同。 培养结束后,用不含EDTA 的0.25%胰酶消化细胞后,将细胞收集于无菌离心管中,用磷酸盐缓冲液清洗细胞2 次,加入500 μL 结合液,轻轻重悬细胞,随后分别加入5 μL Annexin V-FITC 和5 μL PI,轻轻混匀,室温(20~25 ℃)下用铝箔纸包上避光孵育10 min,在1 h 之内用流式细胞仪进行细胞凋亡情况的检测。
1.3.7 数据统计分析 所有数据均以“平均值±标准差” 表示。 试验数据采用Microsoft Excel 2010和SPSS 19.0 进行单因素方差分析,采用LSD 法进行组间多重比较,P<0.05 为差异显著性水平。
2 结果与分析
2.1 玉米糖肽对LO2 细胞的毒性效应
细胞毒性分析是评估功能性食品生物安全性最重要的检测方法之一。 将不同质量浓度的玉米糖肽和玉米肽分别作用LO2 细胞6 h 后,采用MTT 法测定细胞存活率,以表征玉米糖肽和玉米肽是否对LO2 细胞产生毒性效应,结果如图1 所示。
由图1 可以看出,与对照组相比,随着玉米糖肽浓度的增加,LO2 细胞存活率呈逐渐降低的变化趋势。 在0.05 mg/mL 质量浓度下,玉米糖肽组的细胞存活率极显著高于对照组(P<0.01),提示0.05 mg/mL 的玉米糖肽具有较好的促进LO2 细胞增殖的作用;在0.1~8 mg/mL 质量浓度范围内,玉米糖肽处理后的LO2 细胞存活率与对照组相比差异不显著(P>0.05),说明高质量浓度的玉米糖肽没有对LO2 细胞产生毒性效应。 在0.05~4 mg/mL 质量浓度范围内,玉米肽组的细胞存活率与对照组相比差异不显著(P>0.05),说明在此质量浓度范围内,玉米肽对LO2 细胞既无增殖作用,也无毒性效应;在8 mg/mL 时,玉米肽组的LO2 细胞存活率为96.19%,与对照组相比显著降低(P<0.05),与同质量浓度玉米糖肽相比,经糖基化修饰后,玉米肽的安全性得以改善。 一般情况下,当细胞存活率小于对照组75%的样品质量浓度被认为是有毒的[15]。 在本试验质量浓度范围内,经玉米糖肽和玉米肽处理6 h 后,LO2 细胞存活率均大于96%,说明玉米糖肽和玉米肽未对LO2 细胞产生毒副作用,是安全的生物功能因子。为了考察玉米糖肽在低质量浓度条件下对酒精诱导损伤的LO2 细胞的保护效应,在后续研究中玉米糖肽的质量浓度选择5~50 μg/mL。
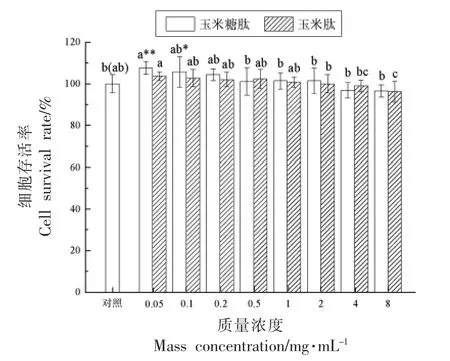
图1 不同质量浓度的玉米糖肽和玉米肽对LO2 细胞存活率的影响Fig.1 Effect of corn glycopeptide and zein peptide at different mass concentrations on viability of LO2 cells
2.2 玉米糖肽对酒精诱导损伤的LO2 细胞存活率的影响
以GSH 为对照,研究玉米糖肽和玉米肽对酒精诱导损伤的LO2 细胞存活率的影响,结果如图2 所示。
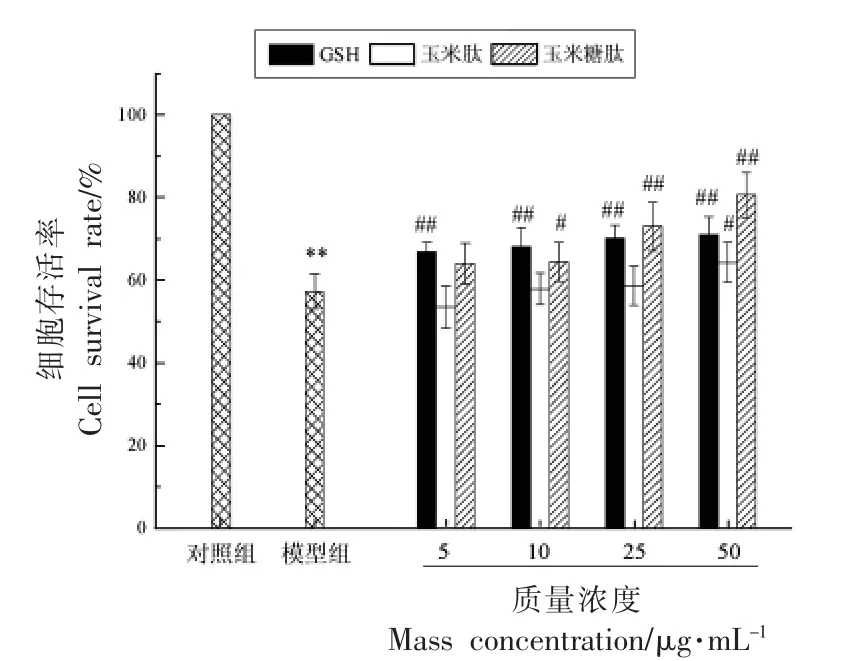
图2 玉米糖肽对酒精诱导损伤的LO2 细胞存活率的影响Fig.2 The effect of corn glycopeptide on the viability of LO2 cells induced by alcohol
由图2 可以看出,与对照组相比,模型组的细胞存活率极显著降低,降低了42.71%,说明LO2细胞损伤模型构建成功。与模型组相比,玉米糖肽以剂量依赖的方式显著抑制了酒精的细胞毒性,使LO2 细胞存活率显著提高,在质量浓度为50 μg/mL 时,玉米糖肽使LO2 细胞存活率提高23.3%,极显著高于同质量浓度的玉米肽(P<0.01),显著高于同质量浓度的GSH(P<0.05),说明玉米糖肽、玉米肽和GSH 均显示出针对酒精诱导损伤的LO2 细胞的保护作用,且玉米糖肽的保护效果更显著。
2.3 玉米糖肽对酒精诱导损伤的LO2 细胞的保护效果
2.3.1 培养液中ALT 和AST 活力 细胞未受到刺激时,肝转氨酶(AST 和ALT)只存在于细胞内,当细胞受到刺激时,细胞膜损伤,将AST 和ALT释放到胞外,使培养液中转氨酶活力升高[16]。 因此,AST 和ALT 的释放是LO2 细胞损伤的主要指标,酒精诱导的细胞毒性也可以直接通过检测培养液中的ALT 和AST 泄漏量进行评估,结果如图3 和图4 所示。
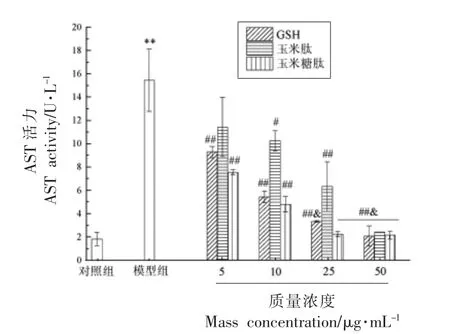
图3 玉米糖肽对酒精诱导损伤的LO2 细胞培养液中AST 活力的影响Fig.3 The effect of corn glycopeptide on the AST activity in culture medium of the LO2 cells induced by alcohol

图4 玉米糖肽对酒精诱导损伤的LO2 细胞培养液中ALT 活力的影响Fig.4 The effect of corn glycopeptide on the ALT activity in culture medium of the LO2 cells induced by alcohol
如图3 和4 所示,经酒精处理后,LO2 细胞培养液中的ALT 和AST 活力分别增加了5.09 和8.35 倍,表明LO2 细胞膜和线粒体受到了严重破坏,这一结果也进一步证实了500 mmol/L 酒精对LO2 细胞的毒性效应。
与模型组相比,玉米糖肽、玉米肽和GSH 均以剂量依赖方式抑制了培养液中ALT 和AST 活力的升高,尤其是在25 μg/mL 质量浓度下,玉米糖肽的干预使ALT 和AST 活力降低至正常水平,且ALT 的降低效果显著高于同浓度的GSH,说明玉米糖肽对LO2 细胞的酒精性损伤具有保护效果,使ALT 和AST 泄漏量降低。
2.3.2 培养液中LDH 活力 LDH 存在于所有细胞中,一旦细胞质膜受损,就会迅速释放到细胞培养液中,因此,LDH 泄漏是细胞毒性的另一个经典指标[17]。 玉米糖肽对酒精诱导损伤的LO2 细胞培养液中LDH 活力的影响如图5 所示。
如图5 所示,与对照组相比,模型组LDH 的活力极显著增加(P<0.01),说明500 mmol/L 酒精的干预使LO2 细胞膜受损而促进了LDH 的释放。在试验浓度范围内,玉米糖肽、玉米肽和GSH 的干预均可以抑制LDH 水平的升高,尤其是在50 μg/mL 时,三者均使LDH 活力恢复到正常水平,这可能与三者的自由基清除能力有关,维持了LO2 细胞膜的完整性,减少了LDH 的释放。

图5 玉米糖肽对酒精诱导损伤的LO2 细胞培养液中LDH 活力的影响Fig.5 The effect of corn glycopeptide on the LDH activity in culture medium of the LO2 cells induced by alcohol
2.3.3 细胞中MDA 含量 MDA 作为脂质过氧化的主要终产物之一,可以与磷脂酰乙醇胺和蛋白质交联,产生脂褐素沉积而破坏细胞膜结构,导致细胞肿胀坏死[18]。因此,MDA 水平可以反映脂质过氧化和细胞损伤的程度。 经玉米糖肽干预后LO2细胞中MDA 的含量如图6 所示。
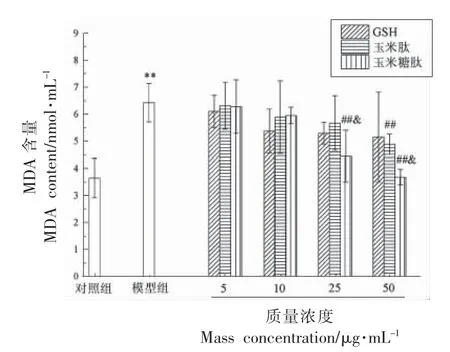
图6 玉米糖肽对酒精诱导损伤的LO2 细胞中MDA 含量的影响Fig.6 Effect of corn glycopeptide on MDA content in alcohol-induced LO2 cells
由图6 可以看出,与对照组相比,模型组细胞内的MDA 含量由3.64 nmol/mL 增加到6.43 nmol/mL,说明酒精氧化代谢产生的过量ROS 自由基使细胞膜上的不饱和脂肪酸氧化产生MDA,进而产生细胞毒性。与模型组相比,经玉米糖肽干预后,MDA 含量呈剂量依赖式降低,在蛋白质量浓度为25 μg/mL 时,MDA 含量降低30.79%,比同质量浓度的玉米肽和GSH 分别高18.97%和13.06%,说明在试验浓度范围内,玉米糖肽降低细胞内MDA 含量的效果优于玉米肽和GSH,可能与玉米糖肽具有多重生物学活性有关,可以从多角度清除ROS 自由基而减少MDA 的产生,使细胞内的毒性环境大大降低。
2.3.4 细胞中酒精代谢酶ADH 和ALDH 活力经玉米糖肽干预后测定酒精诱导损伤的LO2 细胞内的ALDH 和ADH 活力,表征玉米糖肽对LO2细胞内酒精氧化代谢能力的影响,结果如图7 和8 所示。
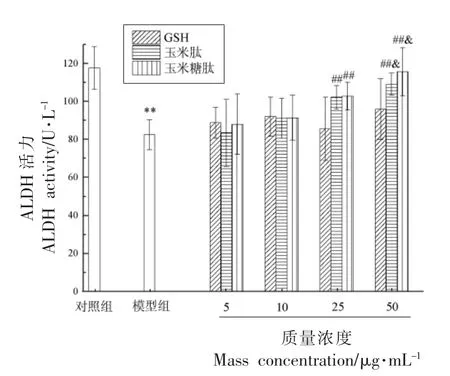
图7 玉米糖肽对酒精诱导损伤的LO2 细胞中ALDH 活力的影响Fig.7 Effect of corn glycopeptide on ALDH activity in alcohol-induced LO2 cells

图8 玉米糖肽对酒精诱导损伤的LO2 细胞中ADH 活力的影响Fig.8 Effects of corn glycopeptide on the ADH activity in alcohol-induced LO2 cells
由图7 可以看出,与对照组相比,模型组ALDH 活力极显著降低(P<0.01),降低了29.94%,说明酒精氧化代谢产物乙醛会在LO2 细胞内堆积,乙醛的增加会破坏线粒体功能而对LO2 细胞的毒性效应增强,且乙醛加合物还会诱导免疫反应以促进肝细胞凋亡[19]。 与模型组相比,在质量浓度为25 μg/mL 时,玉米糖肽和玉米肽的干预使ALDH 活力极显著增加(P<0.01),而在试验浓度范围内,GSH 对ALDH 活力没有产生显著性影响。因此,玉米糖肽可以通过提高ALDH 的活力而减轻乙醛诱导的LO2 细胞损伤。
由图8 可以看出,与对照组相比,模型组ADH 活力降低21.66%,说明500 mmol/L 酒精作用LO2 细胞后,导致LO2 细胞氧化代谢酒精的能力下降,增加了酒精对LO2 细胞的毒性效应。 与模型组相比,质量浓度为25 μg/mL 的玉米糖肽和玉米肽使ADH 活力恢复至正常水平,而在试验浓度范围内,GSH 对ADH 活力没有产生显著性影响。
综合以上分析,玉米糖肽和玉米肽通过增强LO2 细胞内的ADH 和ALDH 活力,加速了酒精氧化代谢,降低了酒精及其代谢产物对LO2 细胞的毒性效应,而同浓度GSH 没有此效果。 分析可能与玉米糖肽和玉米肽富含Glu、Leu、Ala 和Pro 有关(见参考文献[10]),这4 种氨基酸的代谢产物可以使TCA 循环和线粒体呼吸链反应增强,从NADH 到NAD+的再生速度加快,ADH 活力被上调[20-22]。 而GSH 作为天然抗氧化剂,只能从抗氧化的角度降低酒精代谢对细胞的氧化损伤,无加速酒精代谢的效果,进一步说明增加ADH 和ALDH活力是玉米糖肽保护酒精诱导损伤的LO2 细胞的主要机制之一。
2.3.5 细胞中GSH 含量和抗氧化酶活力 玉米糖肽对酒精诱导损伤的LO2 细胞内的GSH 含量以及CAT、SOD 和GSH-Px 活力的影响如表1 所示。
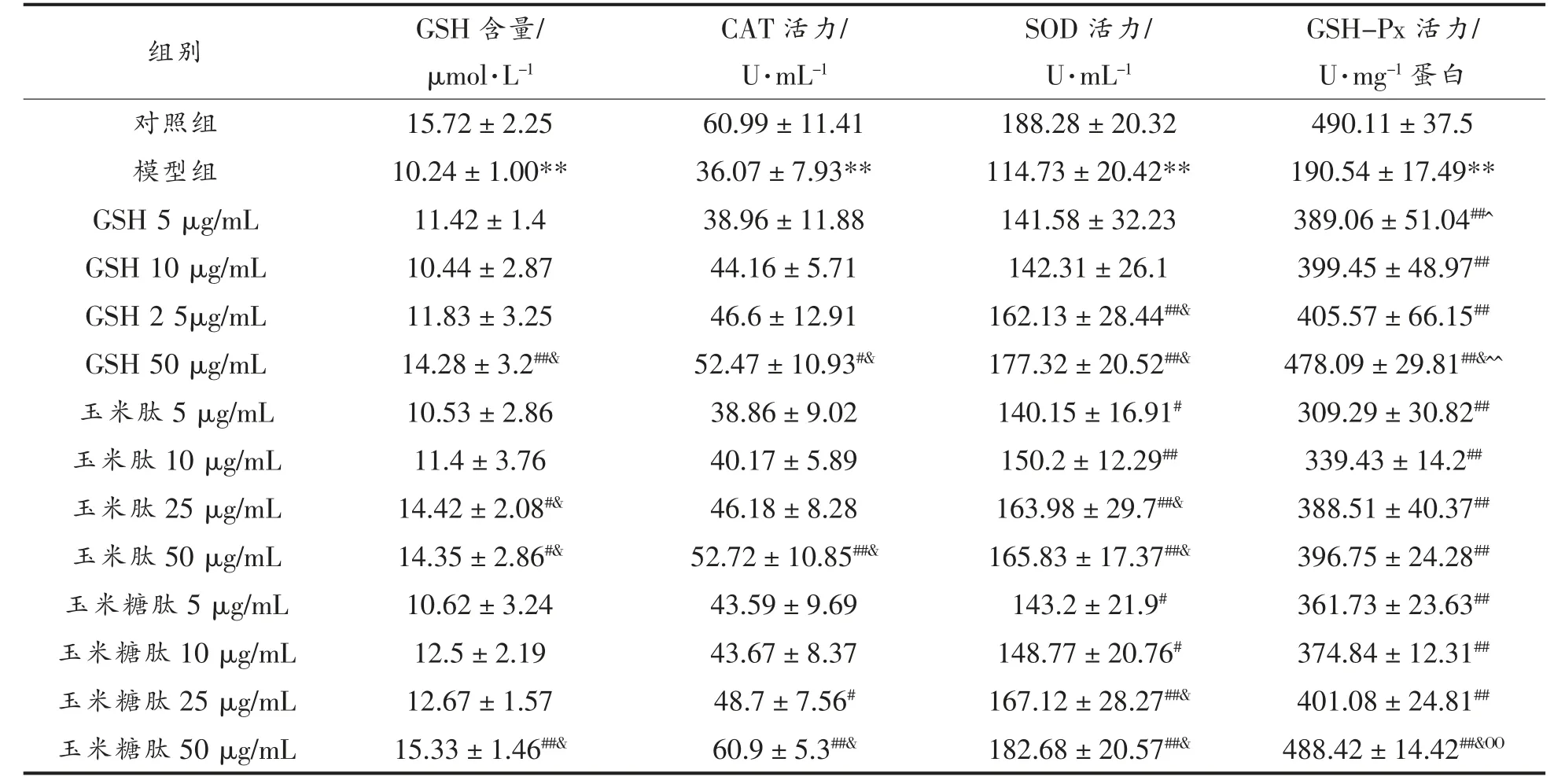
表1 玉米糖肽对损伤LO2 细胞中CAT、SOD、GSH-Px 活力和GSH 含量的影响Table 1 Effects of corn glycopeptide on CAT,SOD,GSH-Px activities and GSH content in alcohol-induced LO2 cells
由表1 可知,与对照组相比,经500 mmol/L酒精诱导后,LO2 细胞内GSH 含量以及CAT、SOD 和GSH-Px 活力均极显著降低 (P<0.01),分别降低了34.86%,40.86%,39.06%,61.12%,说明500 mmol/L 酒精诱导LO2细胞产生大量ROS,ROS 抑制了抗氧化酶的活力,消耗了GSH,使细胞处于氧化应激状态。 于亚莉等[23]利用HepG2 细胞构建酒精性损伤模型时也得到了相同的结果。
由表1 可以看出,与模型组相比,仅50 μg/mL的玉米糖肽使GSH 含量极显著增加至正常水平;在质量浓度为50 μg/mL 时,玉米糖肽使CAT 活力提高至正常水平,分别比同质量浓度的玉米肽和GSH 高22.68%和23.37%; 在质量浓度为25 μg/mL 时,玉米糖肽组的SOD 活力比酒精组高45.66%,分别比同质量浓度玉米肽和GSH 高2.73%和4.35%。
由表1 还可以看出,在试验浓度范围内,玉米糖肽、玉米肽和GSH 均可以极显著提高酒精诱导损伤的LO2 细胞内的GSH-Px 活力,且在质量浓度为50 μg/mL 时,玉米糖肽的提高效果与同质量浓度GSH 相当,极显著高于同质量浓度的玉米肽。 GSH-Px 清除H2O2时需要GSH 巯基的参与,GSH 组的外源GSH 供应充足,故GSH-Px 活力较高,而经糖基化修饰后,玉米肽提供氢和电子的能力增强,故玉米糖肽清除H2O2的能力高于玉米肽,减少了抗氧化酶系的损耗,使GSH-Px 活力提高。
综合以上分析,玉米糖肽对酒精诱导损伤的LO2 细胞内的抗氧化酶系和GSH 有积极调节作用,说明玉米糖肽可能会直接或间接参与调节细胞内与ROS 代谢及氧化应激相关信号通路的表达,如Keap1-Nrf2-ARE 信号通路等,进而有效改善酒精引起的LO2 细胞损伤。 因此,玉米糖肽对酒精诱导损伤的LO2 细胞的保护作用也与其清除由酒精代谢产生的自由基的能力有关。
2.3.6 细胞内的ROS 含量 采用DCFH-DA 探针法测定LO2 细胞内ROS 的水平,玉米糖肽预处理对酒精诱导损伤的LO2 细胞内绿色荧光强度的影响如图9 所示,通过相对荧光强度计算的ROS 相对含量如图10 所示。

图9 荧光显微镜下观察LO2 细胞内荧光强度的变化(400×)Fig.9 The changes of fluorescence intensity in LO2 cells using a fluorescence microscope (400×)

图10 玉米糖肽对酒精诱导损伤的LO2 细胞内ROS 含量的影响Fig.10 Effects of corn glycopeptide on the ROS content in alcohol-induced LO2 cells
由图9 可以看到,与对照组相比,500 mmol/L酒精处理组细胞内荧光强度明显增强,说明在酒精作用下,细胞内抗氧化酶活力降低和GSH 含量减少,脂质过氧化产生的MDA 造成线粒体膜通透性增大,线粒体内的ROS 进入细胞,LO2 细胞发生氧化应激。结合2.3.5 节的结果,经玉米糖肽、玉米肽和GSH 预处理后,LO2 细胞内抗氧化酶如SOD、CAT、GSH-Px 活力增加,ROS 含量降低,细胞内荧光强度也呈剂量依赖式减弱。
如图10 所示,与对照组相比,模型组ROS 含量显著增加(P<0.05),增加了25.95%,而与模型组相比,玉米糖肽、玉米肽和GSH 的干预使ROS 含量显著降低,尤其是在质量浓度为5 μg/mL 时,玉米糖肽处理使ROS 含量降低15.9%,效果高于同质量浓度的GSH 和玉米肽,说明玉米糖肽通过增强细胞内抗氧化酶活力和GSH 含量而加速ROS的清除,减轻细胞的氧化性损伤,达到保护LO2细胞的效果。
2.3.7 玉米糖肽对酒精诱导的LO2 细胞凋亡的影响 目前,肝损伤伴随着细胞凋亡的观点已被广泛接受,细胞凋亡在酒精性肝病进展中起关键作用[24-25]。 因此,抑制细胞凋亡可以减慢甚至逆转酒精性肝病的发展。 选择50 μg/mL 玉米糖肽预处理LO2 细胞,用500 mmol/L 酒精诱导LO2 细胞损伤,通过Annexin V-FITC/PI 双重染色后用流式细胞仪测定细胞凋亡情况,结果如图11 所示。
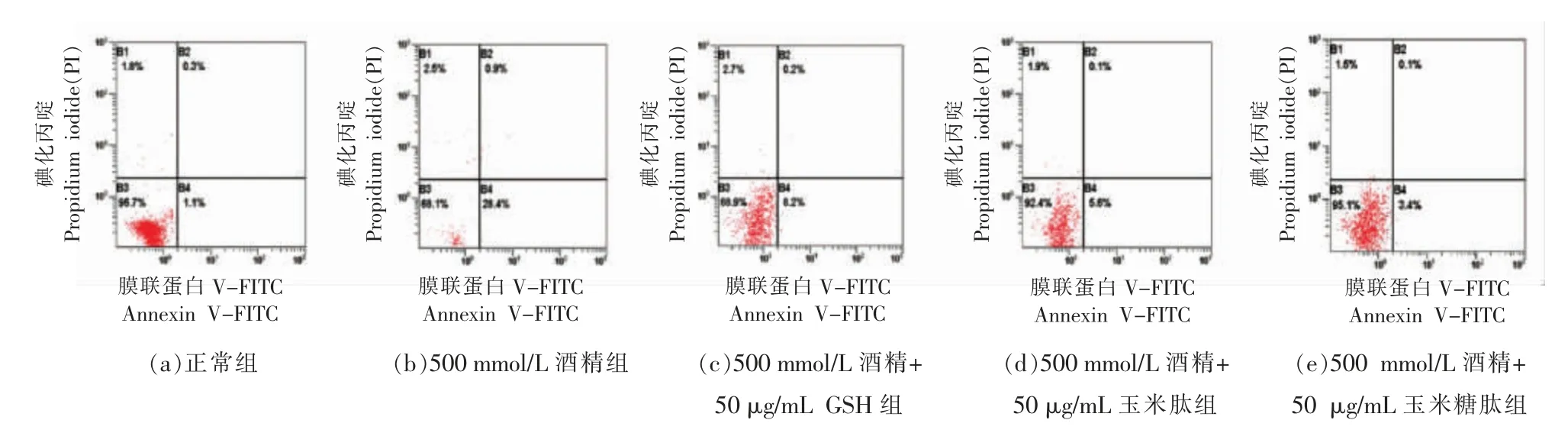
图11 玉米糖肽对酒精诱导的LO2 细胞凋亡情况的影响Fig.11 The effect of corn glycopeptide on the LO2 cells apoptosis induced by alcohol
如图11 所示,与对照组相比,添加500 mmol/L酒精导致早期凋亡细胞和死亡细胞的百分比大大增加。 研究表明,大多数形式的细胞凋亡是通过ROS 诱导线粒体膜破坏触发的[26],结合2.3.5 节的试验结果,酒精诱导的ROS 过量产生及线粒体损伤是LO2 细胞凋亡的诱发因素。 与酒精组相比,剂量为50 μg/mL 玉米糖肽、 玉米肽和GSH 的干预均能显著抑制早期细胞凋亡,且抑制效果的顺序为玉米糖肽>玉米肽>GSH,说明玉米糖肽表现出良好的抗酒精诱导细胞凋亡的效果,也说明其保护肝脏的活性与抑制肝细胞凋亡密切相关。
研究表明,玉米肽可以通过其抗氧化活性逆转与细胞凋亡相关的蛋白质表达 (如Bax、Caspase-3 等)而拮抗肝细胞的凋亡[27-29]。 D-氨基葡萄糖的共价结合改善了玉米肽的生物活性,因此,玉米糖肽也可能是通过逆转与细胞凋亡相关的蛋白质表达而拮抗LO2 细胞的凋亡。 另外,结合2.3.3节的试验结果,玉米糖肽还可以通过增加ALDH活力而减少乙醛的生成,进而抑制由乙醛介导的肝细胞凋亡途径。
综合以上分析,玉米糖肽对酒精诱导损伤的LO2 细胞的保护作用,是其促进酒精代谢、增强抗氧化活力以及抑制肝细胞凋亡的综合效果,也正是这种多途径的综合效果,使玉米糖肽的保护效果优于阳性对照GSH。
3 结论
为了研究开发拮抗酒精性肝损伤的天然、低毒副作用、 多途径的肝保护剂,本试验通过构建LO2 细胞酒精性损伤模型,在细胞水平上研究了玉米糖肽干预对损伤LO2 细胞的保护效应。 研究结果发现50 μg/mL 玉米糖肽的干预对酒精诱导损伤的LO2 细胞具有保护作用,是其促进酒精代谢、 增强抗氧化活力以及抑制肝细胞凋亡的综合效果。在此基础上,可以采用分子生物学及蛋白质组学方法深入研究玉米糖肽拮抗酒精性肝细胞损伤的分子机制。综上,玉米糖肽可能作为一种潜在的功能性食品或膳食补充剂来保护酒精性肝损伤。
