刺梨食用菌发酵液对免疫抑制小鼠免疫功能和抗氧化能力的影响
2023-02-17徐德昌胡婕伦钟亚东谢明勇
徐德昌,胡婕伦,钟亚东,谢明勇
(南昌大学食品科学与技术国家重点实验室 中加食品科学技术联合实验室(南昌) 南昌 330047)
刺梨(Rosa roxburghii Tratt)为蔷薇科蔷薇属多年生落叶丛生灌木[1],其花、果、叶、籽皆可入药。现代研究表明,刺梨含有多种营养成分,包括超氧化物歧化酶(Superoxide dismutase,SOD)、维生素、多酚、多糖、氨基酸及微量元素等[2-4]。近年来,随着对刺梨的深入研究,刺梨的药用保健价值逐渐被相关研究所证实,目前研究发现刺梨具有降血糖[5],抗衰老[6],抗肿瘤[7],增强机体免疫功能和抗应激功能等作用[8-9]。
我国食用菌资源丰富,也是最早栽培和利用食用菌的国家之一,食用菌营养丰富,同时富含多种具有生理功能的活性成分,具有很高的药用价值[10-11]。 长期食用食用菌具有促进机体新陈代谢,增强机体免疫力等益处[12]。 猴头菇(Hericium erinaceus)富含多糖、多肽等活性成分,具有增强免疫,降血糖,抗肿瘤等生理功能; 平菇(Pleurotus ostreatus)富含蛋白质、多糖、维生素等营养成分,具有抗氧化,抗菌,增强免疫等功效;香菇(Lentinula edodes)味道鲜美,含有大量蛋白质、多糖、矿物质、萜类化合物等营养物质,且能量、脂肪低,深受大众喜爱,越来越多的研究表明,香菇具有显著的抗氧化、抗肿瘤和免疫调节等功能。
益生菌发酵是改善食品品质、 延长食品存储期的常见手段之一。 采用益生菌发酵刺梨和食用菌,不仅解决了刺梨因含有单宁,果肉酸涩,食用性差的不足,还能改善食品的营养组成和风味品质[13]。 研究表明,植物发酵液具有调节肠胃,保护胃黏膜,抗氧化,提高免疫力等作用[14]。 然而,对于复配刺梨食用菌发酵液潜在的免疫调节活性基本无相关报道。本实验通过构造免疫抑制小鼠模型,探讨不同剂量刺梨食用菌发酵液对免疫功能和抗氧化功能的影响,为开发利用刺梨及食用菌资源提供数据支持,为拓展刺梨及食用菌产品的商业用途提供理论基础。
1 材料与方法
1.1 材料、试剂和仪器
刺梨食用菌发酵液样品,贵州黔之爱生物科技有限公司。
环磷酰胺、脂多糖(LPS)、刀豆蛋白(Con A),美国Sigma 公司;盐酸左旋咪唑,仁和堂药业有限公司;Cell Counting Kit-8(CCK-8),上海Dojindo Molecular Technologies 公司; 胎牛血清,以色列Bioind 公司;RPMI-1640 培养基、PBS 干粉,北京Solarbio 公司; 小鼠TNN-α、IL-4、IL-6、IL-10 酶联免疫吸附测定 (Enzyme-linked immunosorbent assay,ELISA)试剂盒,武汉博士德生物工程有限公司;超氧化物歧化酶(SOD)测定试剂盒、过氧化氢酶(CAT)测定试剂盒、丙二醛(MDA)测定试剂盒、谷胱甘肽过氧化物酶(GSH-Px)测定试剂盒,南京建成生物工程研究所; 其它试剂均为国产分析纯级。
低温高速冷冻离心机,德国Sigma 公司;多功能酶标仪,美国Thermo Scientific 公司;生化培养箱,上海森信实验仪器公司; 超净工作台,苏州AIRTECH 公司;细胞流式仪,美国Beckman 公司。
1.2 实验动物
48 只BALB/c 雌性小鼠,体质量(20±2)g,周龄6~8 周,购自湖南斯莱克景达实验动物有限公司(许可证号:SCXK(湘)2016-0002)。
1.3 动物分组及处理
饲养条件:房间温度(22±1)℃,12 h/12 h 的灯光/黑夜循环。 自由饮食、 饮水饲养适应环境1周后,将小鼠随机分为6 组,每组8 只,分别为正常对照组、模型对照组、阳性对照组及刺梨食用菌发酵液低、中、高组,具体分组情况和灌胃剂量见表1。 除正常对照组外,其余各组灌胃开始前3 d连续腹腔注射环磷酰胺80 mg/(kg·d),构建免疫抑制小鼠模型,造模后连续灌胃30 d,分别在第15 天和第23 天再次腹腔注射环磷酰胺80 mg/kg,正常对照组注射等量生理盐水。 末次给药24 h后,取相应器官备用。
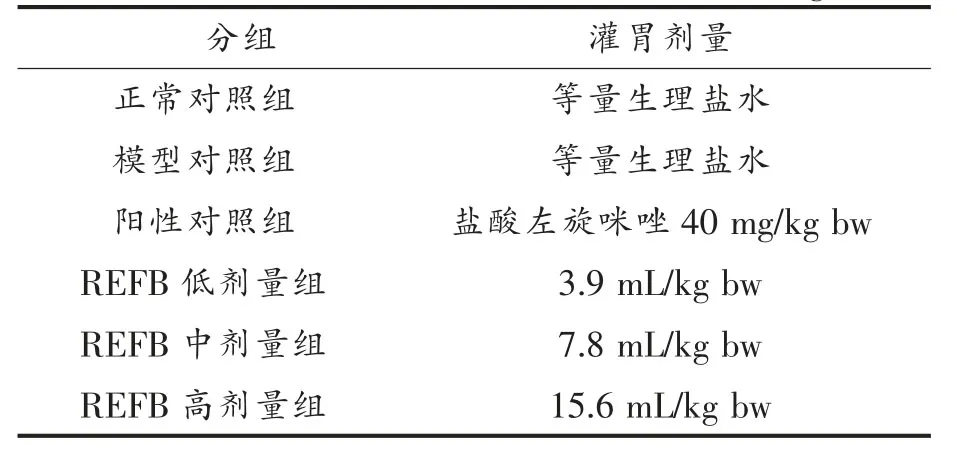
表1 实验动物分组及灌胃剂量Table 1 Grouping and administration dosage
1.4 检测指标
1.4.1 小鼠脏器指数的测定 末次给药24 h 后将小鼠脱颈致死,取脏器用生理盐水漂洗后,用滤纸吸干水分,称重,依照公式(1)计算脏器指数,包括脾脏指数、肝脏指数和胸腺指数。
1.4.2 小鼠脾淋巴细胞转化实验 无菌操作取小鼠脾脏,用PBS(0.01 mol/L,pH 7.4)润湿,研磨,过200 目细胞筛,用PBS 将细胞冲洗至平板,重复3次,无菌操作下,制备单细胞悬液。 调整细胞浓度为5×106个/mL。 加入到96 孔培养板中,每孔加入100 μL 单细胞悬液。 分别加入等体积LPS 溶液(终质量浓度10 μg/mL)或ConA 溶液(终质量浓度5 μg/mL),另设空白对照组,加入等体积培养基,每组设6 个复孔,37 ℃,5%CO2培养箱中培养48 h 后,依据CCK-8 试剂盒说明书,配制CCK-8和培养基混合液,培养板每实验孔加入100 μL CCK-8 混合液,置于培养箱中培养30 min,于540 nm 波长处测定吸光度值,并依照公式(2)计算刺激指数。
1.4.3 小鼠脾淋巴细胞分化实验 调整小鼠脾淋巴细胞浓度为5×106个/mL,取1.5 mL 单细胞悬液,加至EP 管,1 000 r/min 离心5 min,弃上清,1.0 mL PBS 清洗,1 000 r/min 离心5 min,弃上清,重复2 次,最后一次剩余大约20~50 μL PBS。 每管加入anti-CD3,anti-CD4 或者anti-CD8 抗体各0.625 μL,在4 ℃下避光孵育细胞悬液30 min。 加1.0 mL PBS 并吹均匀以终止反应。 1 000 r/min 离心5 min,弃上清,用PBS 清洗2 次,每次1.0 mL,洗去过量抗体。清洗完后,加0.5 mL PBS 混匀。用流式细胞仪对CD3,CD4+和CD8+型细胞进行计数,并以各自占T 淋巴细胞总数的百分比计量。
1.4.4 脾脏细胞因子测定 以预冷的PBS 缓冲液为匀浆液,取适量脾脏组织,在冰浴条件下制成10%组织匀浆液,4 ℃,3 000 r/min 离心10 min,收集组织上清液,按照ELISA 试剂盒操作说明,分别检测TNF-α、IL-4、IL-6 和IL-10 的含量。
1.4.5 抗氧化能力测定 取适量肝脏和胸腺,用预冷的PBS 缓冲液制成10%组织匀浆,3 000 r/min 离心10 min,收集组织上清液,分别按照SOD、CAT、MDA、GSH-Px 试剂盒操作说明,测定各抗氧化水平。
1.4.6 数据统计分析 实验测定结果以“平均值±标准差(mean±SD)”表示,采用SPSS 23.0 统计学软件进行单因素ANOVA 分析和LSD 检验。 利用Graph Pad 6.0 软件对实验结果作图分析。P<0.05时有显著性差异,P<0.01 时有极显著差异。 采用SIMCA 13.0 软件进行主成分分析(Principle component analysis,PCA),从整体考察不同给药对免疫抑制小鼠相关指标的影响。
2 结果与分析
2.1 REFB 对免疫抑制小鼠体质量的影响
由表2 可知,造模前,各组小鼠体质量均在20.0±2.0 范围内,连续造模3 d 后,各组小鼠的体质量均明显下降,与正常组相比具有极显著(P<0.01)差异,表明模型构建成功,由图1 和表2 可知,造模后,与正常组相比,各组体质量恢复缓慢;与模型组相比,REFB 中、 高剂量组的体质量要显著(P<0.05)降低,这可能是由于灌胃REFB,增加了动物的饱腹感,使得动物进食量减少,从而导致体质量增加更为缓慢。
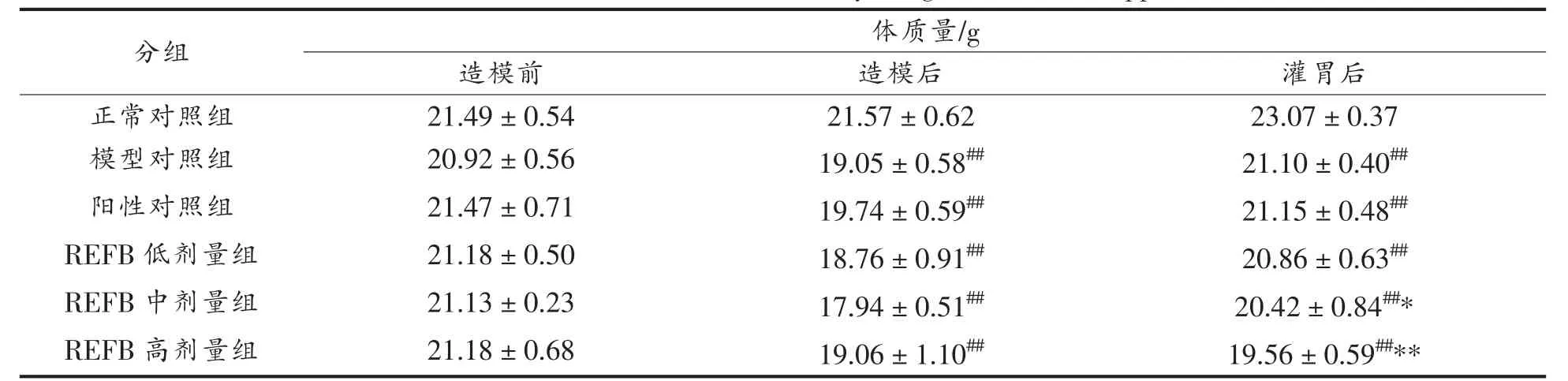
表2 REFB 给药对免疫抑制小鼠体质量的影响Table 2 Effect of REFB administration on body weight of immunosuppressed mice
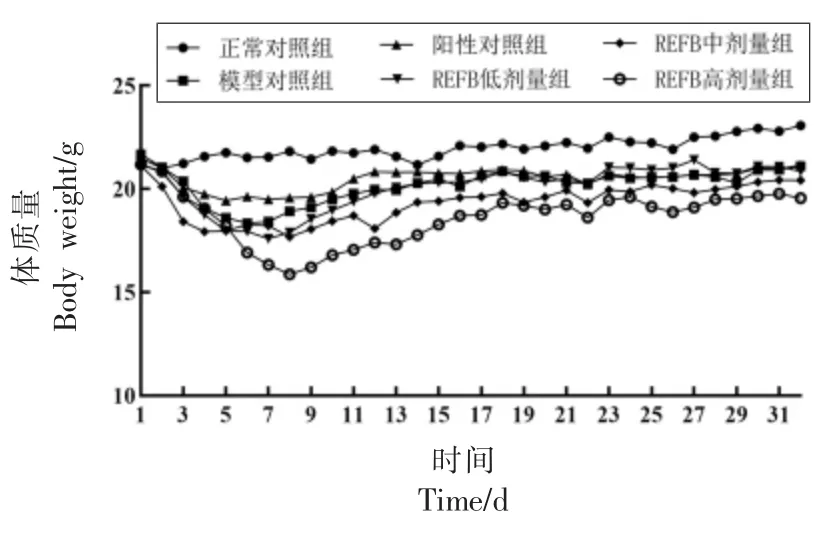
图1 小鼠体质量变化情况Fig.1 Changes in body weight of immunosuppressed mice
2.2 REFB 对免疫抑制小鼠脏器指数的影响
脾脏和胸腺是动物体内主要免疫器官,脾脏指数和胸腺指数能在一定程度上反映机体的免疫能力。 由表3 可知,模型对照组与正常对照组相比,其脾脏指数和肝脏指数极显著(P<0.01)下降,说明环磷酰胺能使小鼠免疫功能受到明显抑制,免疫抑制模型构建成功,与模型组相比,REFB 低、中、高剂量组都极显著(P<0.01)提高小鼠脾脏指数和肝脏指数。 对于胸腺指数,REFB 各剂量组均有一定效果,然而无显著性差异。 由此可见,给予REFB 对于改善免疫功能具有一定效果。
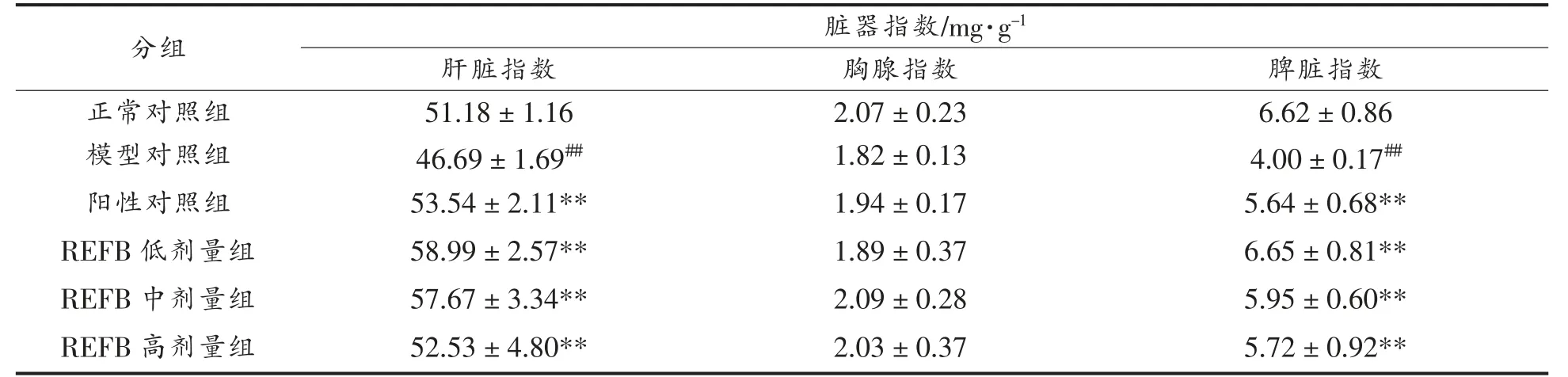
表3 REFB 给药对免疫抑制小鼠脏器指数的影响(n=8)Table 3 Effect of REFB administration on liver,thymus,and spleen index of immunosuppressed mice (n=8)
2.3 REFB 对免疫抑制小鼠脾淋巴细胞增殖的影响
由图2 可知,与正常组相比,模型对照组小鼠脾淋巴细胞的增殖能力极显著下降 (P<0.01);与模型对照组相比,REFB 各剂量组均能极显著(P<0.01) 提高ConA 诱导的T 淋巴细胞增殖; 对于LPS 诱导的B 淋巴细胞增殖能力,REFB 各剂量组较模型对照组也有所提高,而不具有显著性。
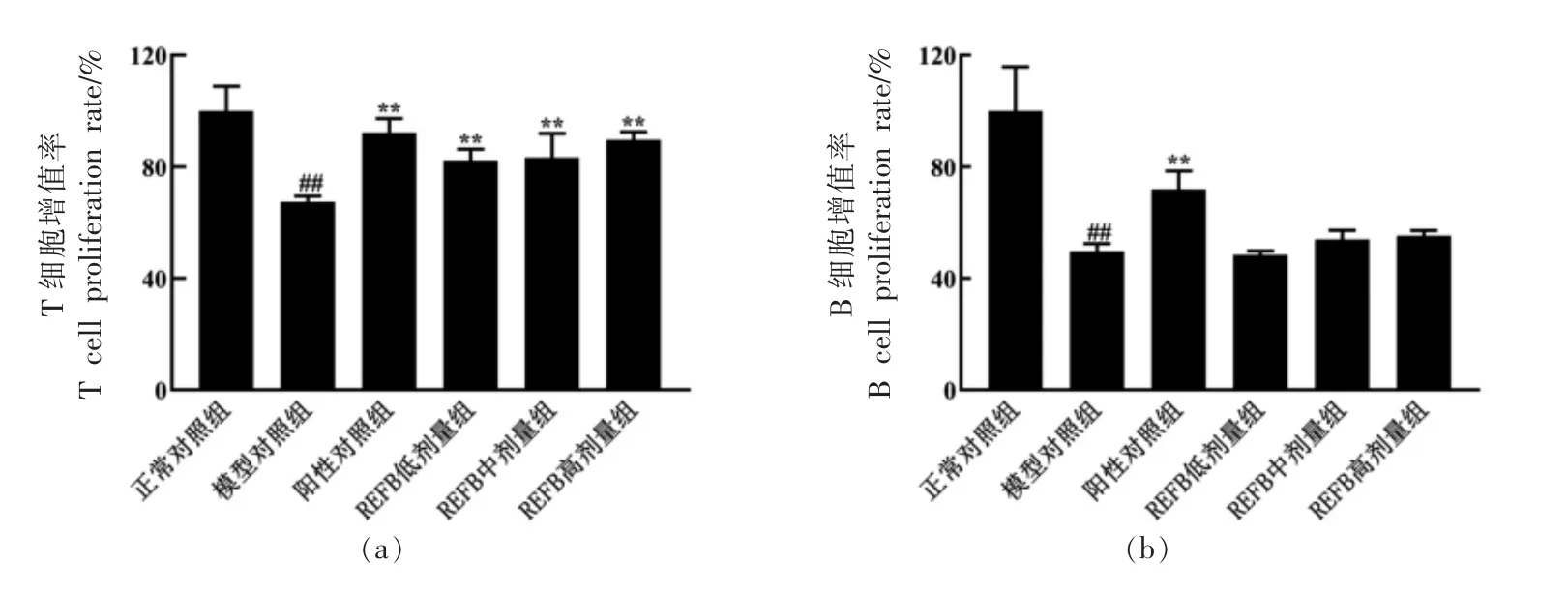
图2 REFB 给药对免疫抑制小鼠脾淋巴细胞增殖的影响Fig.2 Effect of REFB administration on spleen lymphocyte proliferation in immunosuppressed mice
2.4 REFB 对免疫抑制小鼠脾淋巴细胞分化的影响
由图3 可知,与正常对照组相比,模型对照组CD3+和CD4+细胞亚群占比极显著(P<0.01)下降,CD8+T 细胞亚群占比显著(P<0.05)下降,CD4+/CD8+的比值略有下降;与模型组相比,REFB 各剂量组CD3+、CD4+和CD8+T(低剂量除外)细胞亚群占比显著(P<0.05)增加,其中REFB 中剂量组的效果最好,REFB 各剂量组CD4+/CD8+的比值较模型对照组也显著(P<0.05)升高。
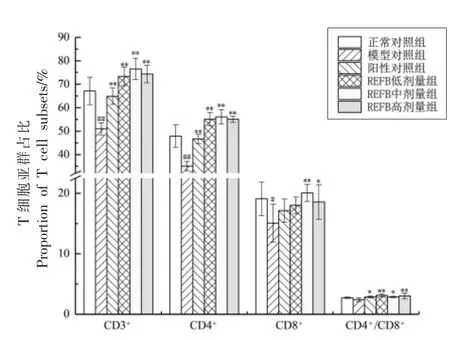
图3 REFB 给药对免疫抑制小鼠脾淋巴细胞分化的影响Fig.3 Effect of REFB administration on spleen lymphocyte differentiation in immunosuppressed mice
2.5 REFB 对免疫抑制小鼠脾脏细胞因子的影响
由图4 可知,与正常对照组相比,模型对照组极显著(P<0.01)降低了IL-4、IL-6 和TNF-α 的含量,极显著(P<0.01)增加了IL-10 的含量。 与模型组相比,REFB 各剂量组均极显著(P<0.01)降低了IL-10 的含量;REFB 高剂量组IL-4、IL-6 和TNFα 含量与模型对照组相比具有极显著(P<0.01)差异,REFB 低和中剂量组具有缓解作用,然而没有显著差异。
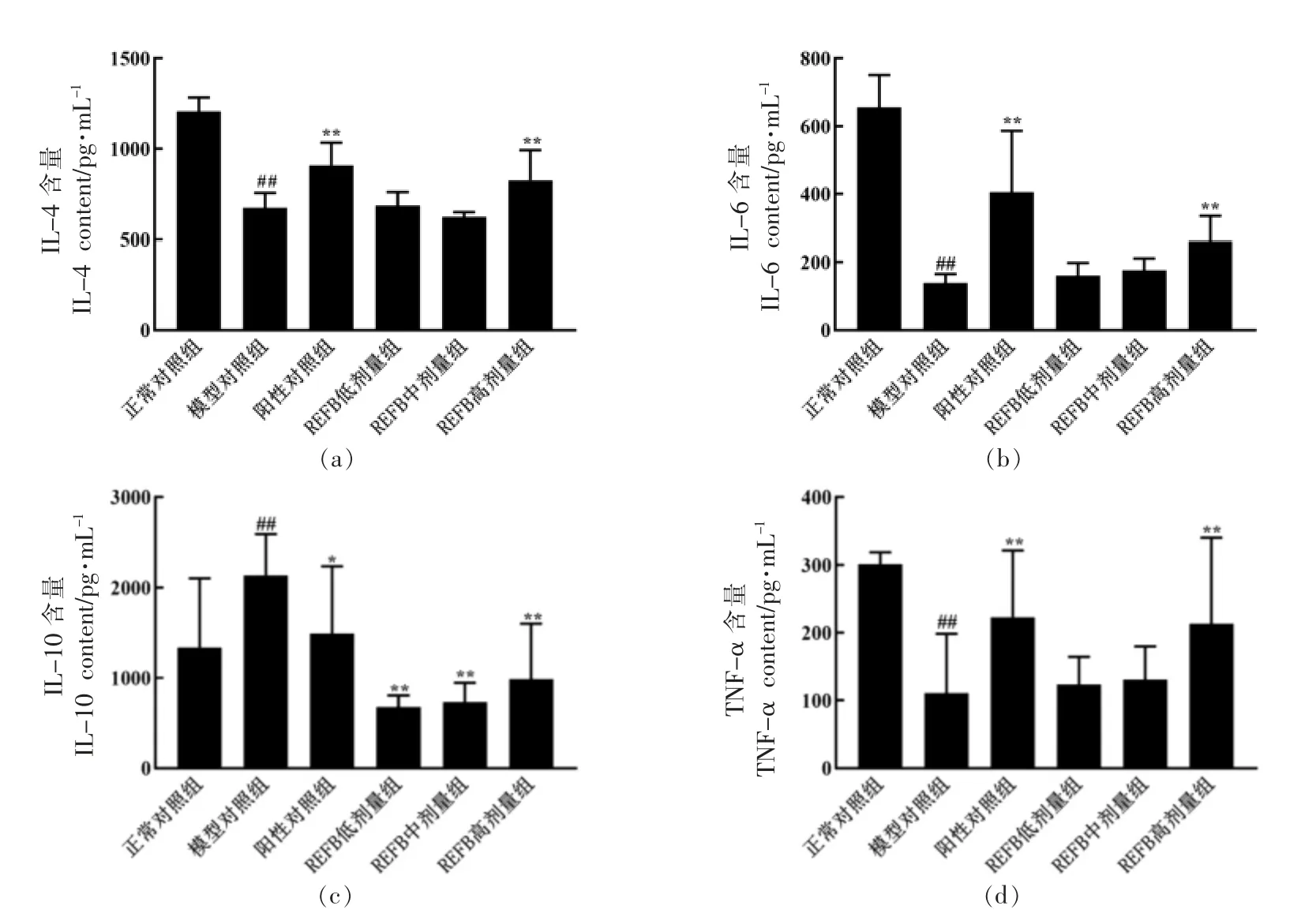
图4 REFB 给药对免疫抑制小鼠脾细胞IL-4、IL-6、IL-10、TNF-α 的影响Fig.4 Effect of REFB administration on spleen IL-4,IL-6,IL-10,and TNF-α in immunosuppressed mice
2.6 REFB 对免疫抑制小鼠肝脏及胸腺组织SOD、CAT、MDA、GSH-Px 含量的影响
由表4 可知,与正常对照组相比,模型对照组肝脏CAT、GSH-Px 和SOD 含量显著(P<0.05)降低,MDA 含量极显著(P<0.01)升高。与模型对照组相比,REFB 各剂量组CAT、GSH-Px 和SOD 含量均有所提高,MDA 含量极显著(P<0.01)降低,其中REFB 中剂量组的缓解效果最好。
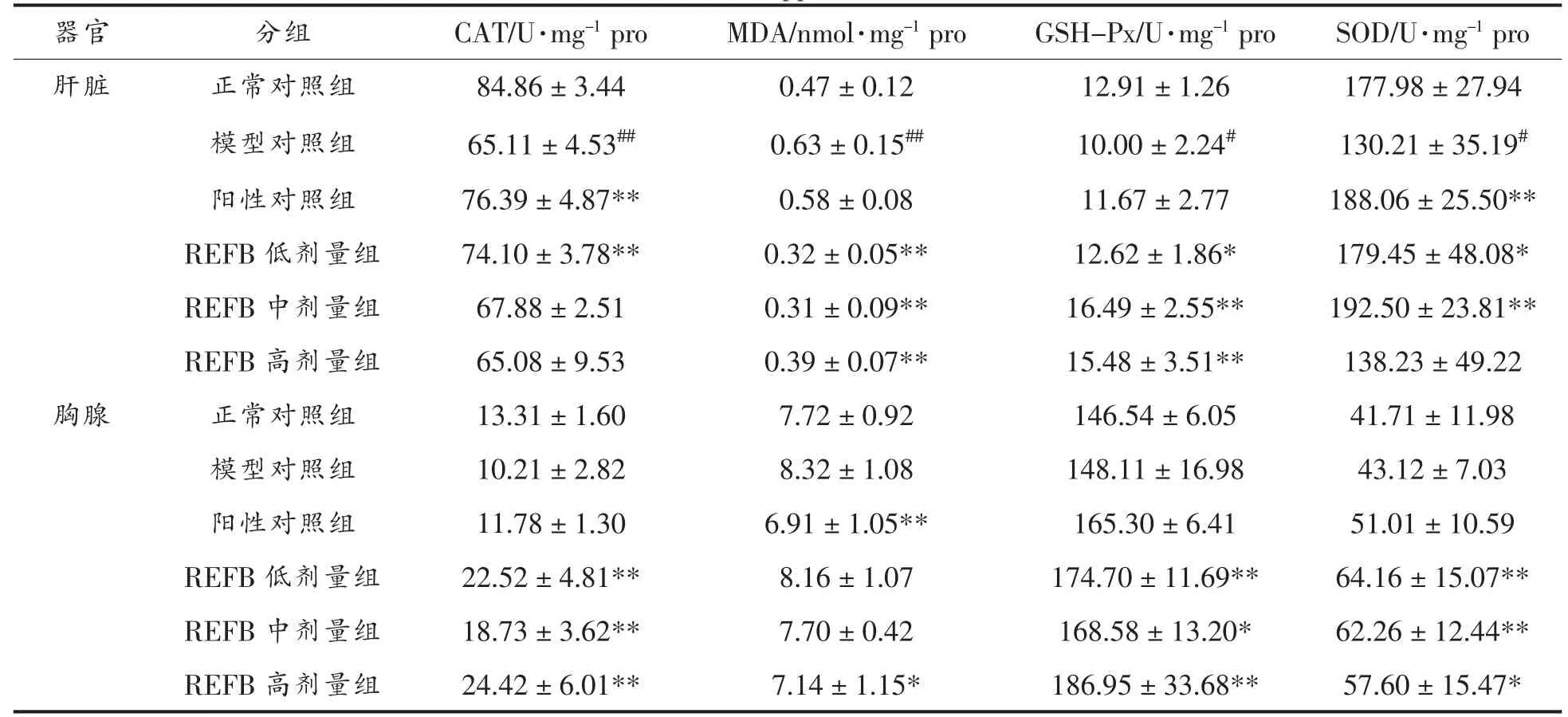
表4 REFB 给药对免疫抑制小鼠肝脏及胸腺SOD、CAT、MDA、GSH-Px 含量的影响Table 4 Effect of REFB administration on liver and thymus SOD,CAT,MDA,and GSH-Px levels in immunosuppressed mice
与正常对照组相比,模型对照组胸腺各抗氧化指标趋势同肝脏抗氧化指标,然而无显著差异。与模型组相比,REFB 各剂量组CAT、GSH-Px 和SOD 含量显著 (P<0.05) 提高,MDA 含量有所降低,综上,REFB 给药对于调节小鼠抗氧化功能具有一定效果。
2.7 基于PCA 的梨食用菌发酵液免疫及抗氧化活性分析
为进一步发掘刺梨食用菌发酵液的免疫及抗氧化活性,运用多元数据分析,采用6 种给药组的22 种免疫和抗氧化指标,进行主成分(PCA)方法分析生成中轴散点图,以可视化不同组之间的指标差异,PCA 得分图(图5a)显示不同给药组的样品分布,荷载图(图5b)显示各指标的分布,该模型的第一主成分(PC1)和第二主成分(PC2)的贡献度之和为53.4%,能够较好地反映各给药组与各指标之间的联系。 在PCA 得分图中,48 个样本分为6 组,分别为正常对照组(绿色)、模型对照组(蓝色)、阳性对照组(红色)、REFB 低剂量组(黄色)、REFB 中剂量组(浅蓝色)和REFB 高剂量组(紫色)。 从图5a 可知,模型对照组(蓝色)偏离其它给药组,位于右上角,由图5b 可知,该组IL-10以及MDA 含量较高,其它指标均要低于其它给药组。 而REFB 给药组位于中间偏左位置,相比模型组更接近正常组。 由荷载图可知该组的主要贡献者是免疫器官指数,抗氧化指标以及T 淋巴细胞增殖分化指标,此结果表明REFB 主要通过T 细胞介导的细胞免疫,发挥免疫调节作用,以及提高机体抗氧化酶活性,增强机体的抗氧化能力。基于图5a,对于REFB 低、中、高各剂量组,分别从纵向和横向进行比较,结果表明,REFB 高剂量组要更接近阳性对照组和空白对照组,表明REFB 高剂量组对于免疫抑制小鼠的免疫及抗氧化能力的调节作用整体要优于低、中剂量组。
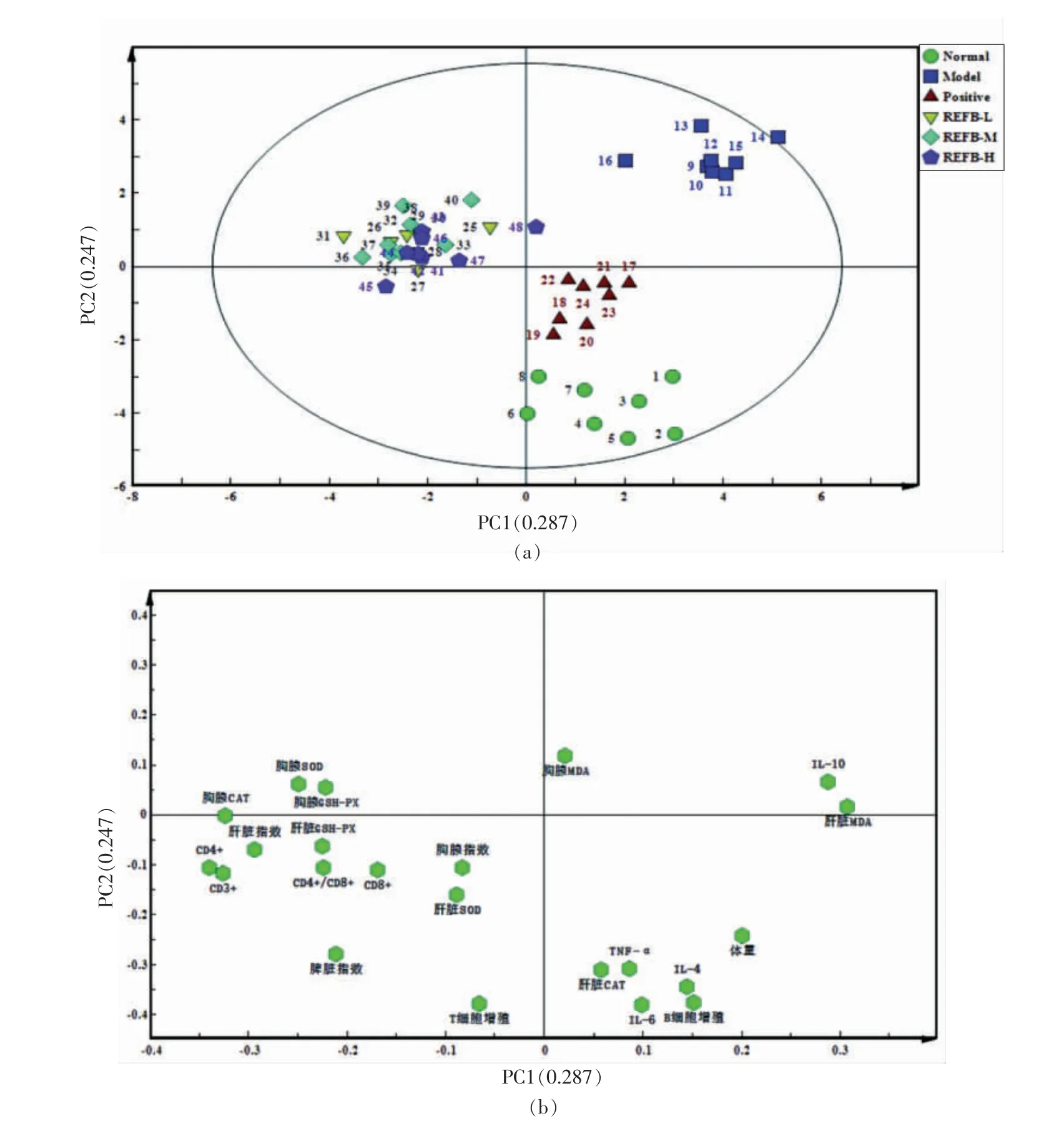
图5 不同给药对免疫抑制小鼠相关指标PCA 分析得分图(a)和荷载图(b)Fig.5 PCA analysis (PC1 versus PC2) score plot (a) and load plot (b) of different administrations on immunosuppressed mice related indicators
3 讨论
果蔬经益生菌发酵后,不仅能够延长产品的货架期,还能形成独特的风味,提高产品的营养价值以及增强产品的功能性。越来越多的研究显示,益生菌发酵能够提高食品的免疫调节活性,如益生菌发酵芦笋[15]、灵芝[16]、虫草[17]、红参[18]、菠萝汁[19]、欧李汁[20]等均能明显改善免疫抑制小鼠的免疫功能,增强免疫刺激活性。本实验通过多次腹腔注射环磷酰胺构建免疫抑制小鼠模型,探讨复配刺梨食用菌发酵液潜在的免疫调节活性。
免疫系统是机体免疫应答和免疫功能的重要系统,由免疫器官、免疫细胞和免疫分子构成[21],脾脏作为T、B 淋巴细胞聚集和参与免疫应答的器官,其可通过T 细胞介导的细胞免疫和B 细胞介导的体液免疫发挥调节免疫的功能[22]。 注射环磷酰胺是目前建立免疫抑制小鼠模型最为常见的手段,其对机体的免疫系统有较为全面的抑制。本研究发现,注射环磷酰胺后,小鼠体质量、免疫器官指数、T/B 细胞增殖分化均要明显低于正常组,说明免疫抑制小鼠模型构建成功。 灌胃刺梨食用菌发酵液(REFB)能够明显改善环磷酰胺引起的脏器萎缩,上调器官指数,尤其是脾脏等免疫器官;促进T/B 淋巴细胞的增殖分化,增强细胞免疫功能; 通过调节相关细胞因子分泌水平来发挥免疫调节功能,缓解环磷酰胺导致的免疫低下。 根据PCA 分析可知,REFB 主要影响T 淋巴细胞的增殖分化,即通过T 细胞介导的细胞免疫发挥调节免疫作用。 这可能与REFB 中所含的食用菌多糖有关,研究发现平菇多糖、猴头菇多糖、香菇多糖均能刺激免疫抑制小鼠脾淋巴细胞增殖分化,上调免疫器官指数,发挥免疫调节作用[23-24]。 而食用菌多糖经过复配后往往会表现出良好的生物活性,如给免疫抑制小鼠口服香菇多糖、茯苓多糖、银耳多糖或者三者混合物,均能够显著增加免疫抑制小鼠的脏器指数,降低IL-10 水平,改善免疫抑制小鼠的免疫能力[25]。
抗氧化系统是机体正常新陈代谢所必不可少的,通常情况下,活性氧(Reactive oxygen species,ROS) 的产生与抗氧化防御系统之间处于一种平衡状态[26],免疫系统对于这种氧化-抗氧化的内稳态特别敏感,特别是吞噬细胞的生物活性[27],如果没有足够的抗氧化剂,吞噬细胞产生的ROS 会对细胞本身造成破坏,此时补充抗氧化剂,可以帮助氧化-抗氧化内稳态平衡的恢复,有利于提高免疫力[28]。 环磷酰胺会导致机体抗氧化系统失衡,抗氧化能力下降。 而植物提取物能在一定程度上提高机体的抗氧化活性,如天然虫草多糖[29]、黑灵芝多糖[30]、铁皮石斛多糖[31]。本研究发现,注射环磷酰胺后,模型对照组的肝脏和胸腺SOD、CAT 和GSHPx 水平显著低于正常对照组,MDA 含量显著高于正常对照组,表明环磷酰胺可明显抑制机体的氧化应激功能。灌胃REFD 各剂量组后,小鼠肝脏和胸腺组织中SOD、CAT、GSH-Px 显著提高,MDA含量显著下降。 表明REFD 可以通过调节免疫抑制小鼠的抗氧化酶活性,改善由环磷酰胺引起的氧化应激。 REFB 表现出良好的抗氧化应激功能,可能与刺梨和食用菌相关成分有关,刺梨果实中富含的活性成分SOD、 黄酮和多糖等均有良好的抗氧化性能[9,32],而香菇、猴头菇、平菇提取物已被诸多研究报道出具有良好的抗氧化应激活性,特别是其中的多糖成分可以作为天然的抗氧化剂,保护机体免受氧化损伤[33-35]。而益生菌发酵会增强食品的相关活性,如基于益生菌发酵的蓝莓提取物会表现出更好的抗菌和抗氧化活性[36],其机制可能是发酵改变了食品原本的营养组成,产生更多具有抗氧化活性的物质。 如苹果汁经过乳酸菌发酵后,具有强氧化性的槲皮素等含量显著增加,提高了苹果汁的抗氧化活性[37]。 桑葚果汁经过乳酸菌发酵后,产生了更多的酚酸、黄酮醇等物质,增加了发酵果汁对自由基的清除能力[38]。 因此,益生菌发酵可能也是使刺梨食用菌发酵液(REFB)表现出良好抗氧化应激活性的重要原因之一,然而发酵对该产品的功能活性影响仍需进一步研究以验证。
综上所述,刺梨食用菌发酵液(REFB)不仅能够增加免疫器官指数,还能够促进T、B 淋巴细胞的增殖与分化,调节脾脏细胞因子的平衡,从而发挥对免疫抑制小鼠的免疫调节作用,同时还能显著改善注射环磷酰胺导致的氧化应激损伤。 本实验结果可为刺梨、 食用菌及其发酵制品开发利用提供一定的理论依据。
