南极磷虾油对脂多糖诱导RAW264.7细胞炎症反应的抑制作用
2023-02-17郑振霄戴志远
郑振霄,朱 凯,戴志远*
(1 浙江工商大学 海洋食品研究院 杭州 310012 2 浙江工商大学 浙江省水产品加工技术研究联合重点实验室 杭州310012)3 浙江工商大学 海洋食品精深加工关键技术省部共建协同创新中心 杭州 310012)
南极磷虾(Euphausia superba)是生活在南极海域的一种甲壳类浮游生物。据统计,南极磷虾的资源储存量约为3.80 亿t,并且每年的繁殖量也非常巨大,在3.42~5.36 亿t 之间。 目前,南极磷虾的捕捞量约为20 万t/年,仅为其限制性捕捞量的1/3,这表明全球南极磷虾资源开发潜力巨大[1-2]。南极磷虾主要被加工成饵料,用于水产养殖等行业,然而,因养殖量有限且养殖饵料资源丰富,故南极磷虾资源的利用率并不高[3]。 近年来,随着人们对南极磷虾营养价值的认可,南极磷虾功能食品成为开发利用其资源的重要途径。 南极磷虾中富含磷脂结合型n-3PUFA,与鱼油中的甘油酯型的n-3PUFA 相比,更容易被人体吸收,因此南极磷虾油成为南极磷虾资源高效利用的一种潜力产品[4]。
炎症,即平时所说的“发炎”,是生物组织受到某种刺激,如外伤、感染等损伤因子的刺激,所发生的一种以防御反应为主的基本病理过程。 研究表明,海洋脂质对炎症具有抑制作用[5]。付元庆[6]以脂多糖(LPS)诱导的RAW264.7 细胞为炎症的体外模型,研究了厚壳贻贝脂质提取物对炎症的抑制作用,结果表明:厚壳贻贝脂质提取物可以显著抑制一氧化氮(NO)的释放,调节促炎/抗炎因子平衡,并最终通过抑制核转录因子NF-κB 的活化,抑制炎症级联反应。孙翰[7]采用硫酸葡聚糖钠诱导的C57BL/6 小鼠为炎症模型,研究鱼油对溃疡性结肠炎小鼠体内炎症反应的抑制作用,结果表明:鱼油可以通过抑制花生四烯酸代谢通路,抑制促炎因子IL-1β 的表达,进而抑制炎症反应。 目前,对于南极磷虾油的研究主要集中在其制备工艺及抗氧化,关于南极磷虾油抗炎的研究较为少见。本文以LPS 诱导的RAW264.7 细胞为炎症模型,研究南极磷虾油的抗炎功效,并从基因水平分析南极磷虾油对炎症因子及关键酶的调控作用,初步探索南极磷虾油抗炎的作用机理,旨在为南极磷虾资源的开发与利用提供参考。
1 材料与方法
1.1 材料与试剂
巨噬细胞RAW264.7,中国科学院上海细胞库;南极磷虾油,实验室自制,制备方法参考俞喜娜等[8]的方法;胎牛血清,浙江天杭生物科技股份有限公司;DMEM 高糖培养基,海克隆生物化学制品(北京)有限公司;青霉素-链霉素溶液、胰酶、LPS,北京索莱宝科技有限公司;95%乙醇 (分析纯),杭州双林化工试剂厂;异丙醇(分析纯)、氯仿(分析纯),国药集团(上海)有限公司。
1.2 主要设备与仪器
恒温CO2细胞培养箱(E163302)、台式低温高速离心机(Micro17R),美国Thermo Fisher Scientific 公司;恒温水浴锅(DKS-12),上海森信实验仪器有限公司;净化生物超净工作台(YJ-840),苏州净化设备有限公司;倒置显微镜(AE2000),麦克奥迪实业集团中国有限公司;PCR 仪(T100)、荧光定量PCR 仪(CFX96),美国Bio-Rad 公司。
1.3 方法
1.3.1 南极磷虾油相关指标测定 采用1260Infinity 蒸发光高效液相色谱仪测定南极磷虾油中磷脂的含量[9],采用LC-20AT 紫外高效液相色谱仪[10]对磷虾油中的虾青素进行测定,磷虾油中维生素A 和生育酚含量的测定参考Plozza 等[11]的方法,胆固醇的含量参考食品安全国家标准食品中胆固醇的测定方法(GB 5009.128-2016)[12]测得,采用气相色谱法[13]测定南极磷虾油中的脂肪酸组成。
1.3.2 细胞的培养及分组 取适量胎牛血清与DMEM 高糖培养基混匀,而后加入适量青链霉素混合液,配制成细胞培养液(含10%胎牛血清,100 U/mL的青霉素和100 μg/mL 的链霉素)。RAW264.7 细胞培养在含10 mL 细胞培养液的细胞培养皿(直径为5 cm)中,并置于细胞培养箱中(37 ℃,5%CO2),每2 d 传代1 次。 取适量南极磷虾油溶解在二甲基亚砜(DMSO)中,配制成1 mg/mL 的母液,之后取适量母液,加到细胞培养液中制得含80(KO1),120(KO2),160(KO3)μg/mL 南极磷虾油的细胞培养液。
试验分组:LPS 刺激组,细胞培养在含有0.8 μg/mL LPS 的细胞培养液中24 h;空白对照组,细胞培养在细胞培养液中24 h;KO1 组,细胞培养在含有0.8 μg/mL LPS 和80 μg/mL 南极磷虾油的细胞培养液中24 h;KO2 组,细胞培养在含有0.8 μg/mL LPS 和120 μg/mL 南极磷虾油的细胞培养液中24 h;KO3 组,细胞培养在含有0.8 μg/mL LPS 和160 μg/mL 南极磷虾油的细胞培养液中24 h;LPS 和南极磷虾油的浓度由前期细胞活力试验确定。
1.3.3 炎症相关因子的测定 采用倒置显微镜(MoticAE2000)对细胞进行形态学观察(20×);细胞吞噬能力的测定: 采用中性红法检测细胞吞噬能力[14];髓过氧化物酶(MPO)活力的测定:按照MPO 试剂盒 (南京建成,A044) 的说明书进行操作;NO 的测定:按照一氧化氮(NO)测定试剂盒(南京建成,A12-1-2)的说明书进行操作;肿瘤坏死因子-α(TNF-α)分泌量的测定:按照试剂盒(碧云天,PT512)的说明书进行操作;白细胞介素-1β(IL-1β) 分泌量的测定: 按照试剂盒 (碧云天,PI301)的说明书进行操作;白细胞介素-6(IL-6)分泌量的测定:按照试剂盒(碧云天,PI326)的说明书进行操作;诱导型一氧化氮合酶(iNOS)、环氧合酶-2(COX-2)、TNF-α、IL-1β、IL-6 基因的相对表达量采用实时荧光定量PCR(qRT-PCR)的方法进行测定,序列由上海生物生工股份有限公司负责合成,序列信息如表1 所示,具体反应条件参考Zheng 等[15]的方法。
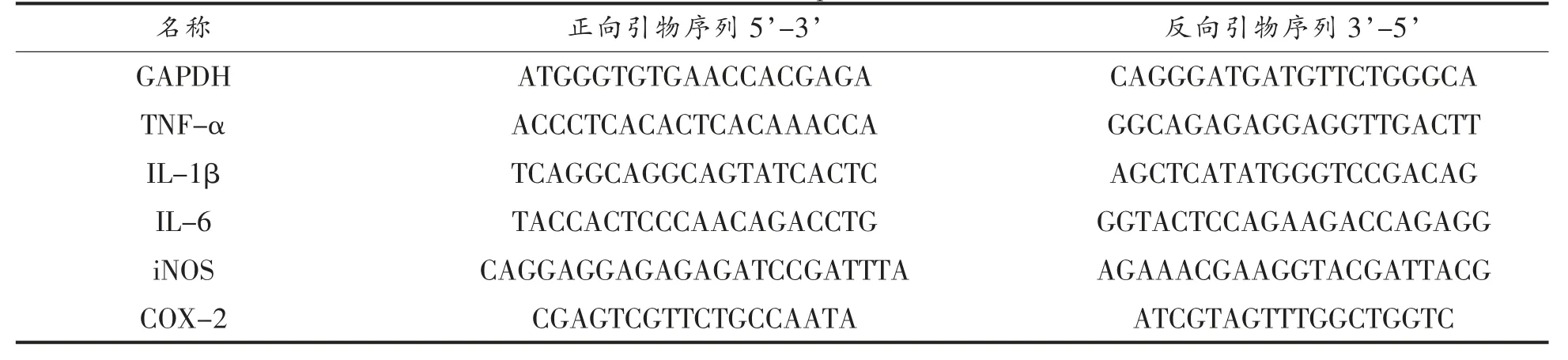
表1 引物序列详细信息Table 1 Primer sequence details
1.4 数据统计分析
数据结果采用“平均值±标准偏差”的形式,显著性分析采用SPSS21.0 分析,图片采用origin9.0和Photoshop CC2015.5 进行绘制。
2 结果与分析
2.1 南极磷虾油脂肪酸组成及微量物质的含量分析
南极磷虾油中的脂肪酸组成(>1%)及微量物质的含量分析如表1 所示。总体上看,南极磷虾油中的EPA(C20:5)占比最高为22.78%,棕榈酸(C16:0)的占比次之为21.01%,DHA(C22:6)的占比排在第3 位,为13.71%。 从分类上来看,南极磷虾油中的多不饱和脂肪酸(PUFA)的占比最高,为36.49%,饱和脂肪酸(SFA)的占比次之,为28.66%,单不饱和脂肪酸(MUFA)的占比最低,为19.15%。 对于PUFA 占比,起到较大贡献的是EPA 和DHA 这两种n-3PUFA,其它脂肪酸的贡献相对较少;对于SFA 占比,起到较大贡献的是棕榈酸(C16:0),其次是C14:0,其它脂肪酸贡献相对较少;对于MUFA 而言,起到最大贡献的是油酸(C18:1),其次为棕榈油酸(C16:1)。值得一提的是,南极磷虾油中的EPA 和DHA 的占比之和高达36.49%,这样的占比处在很高的水平,高于鳀鱼油 (15.88%)、 金枪鱼油(16.78%)和沙丁鱼油(25.58%)[16]等常见鱼油制品原料中的占比。EPA 和DHA 是两种具有多种生物活性的n-3PUFA,研究表明DHA 和EPA 在促进大脑发育,降血脂,抗炎等方面都发挥了较好的作用,且美国FDA 于2019年批准了以n-3PUFA 为主要成分的处方药,说明EPA 和DHA 在药品领域也有巨大的应用潜力[17]。 人体不能够合成EHA和DHA,人体所需的DHA 和EPA 通常是靠摄入海洋鱼类而获得,海洋鱼类中的EPA 和DHA 的源头在于海洋浮游生物,南极磷虾是以海洋浮游生物为食,相较于鱼类,南极磷虾在EPA 和DHA的传递链上更靠近源头,因此EPA 和DHA 在南极磷虾中的累积量更高[18]。
磷脂,也称磷脂类、磷脂质,是指含有磷酸的脂类,属于复合脂,是生物膜的主要成分,具有重要的生理功能,南极磷虾油中磷脂含量为52.97 g/100 g,远高于金枪鱼油(0.94 g/100 g)、金枪鱼鱼脑(10.00 g/100 g)、大黄鱼卵(12.02 g/100 g)中的磷脂含量[19-21]。虾青素是一种常见于海洋水产生物中的类胡萝卜素,由于最先是从虾中提取得到,故命名为虾青素。虾青素具有强大的抗氧化能力,可以通过清除自由基,防止脂质过氧化反应和低密度脂蛋白氧化。 南极磷虾油中虾青素的含量为8.21 mg/kg,与虹鳟中的含量(8.31 mg/kg)相似,高于大西洋鲑(7.12 mg/kg)[22]。此外,南极磷虾油中还含有一定量的生育酚、维生素A 和胆固醇,这些物质的存在也会对其功能产生一定影响。

表2 南极磷虾油组分分析Table 2 Composition analysis of Antarctic krill oil
2.2 细胞形态变化
干预结束后,将细胞从培养箱中取出,放置在倒置显微镜下,仔细观察细胞的形态变化(图1)。正常的RAW264.7 呈圆形或椭圆形,细胞之间紧密接触成簇贴壁生长,LPS 刺激后,RAW264.7 细胞出现分化,出现大面积分支,细胞的形态演变为梭状,细胞膨大且出现触角,细胞间的距离变大。南极磷虾油干预组中,细胞的分支程度明显减弱,细胞的梭变程度也明显好转,这说明南极磷虾油可以有效缓解LPS 导致细胞的炎症分化,具有抗炎作用,并且KO1 组的效果不如KO2 组和KO3组,KO2 组和KO3 组的效果相似。
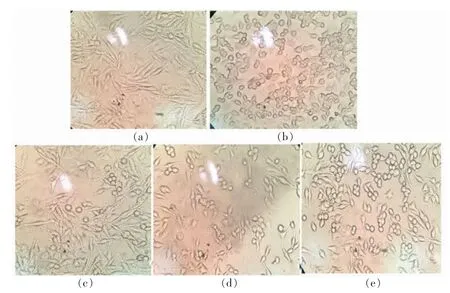
图1 细胞形态变化Fig.1 The morphologic changes of cells
2.3 细胞吞噬能力的变化
细胞吞噬作用是指生物体内的某些特定细胞识别异物并将其吞入和消灭的功能,是生物的基本防卫机制。细胞的吞噬过程可分成3 个步骤,首先吞噬细胞聚集在入侵异物周围,然后,吞噬细胞对异物的识别,最后,吞噬细胞将异物包围吞入细胞内,通过溶酶体等物质将异物消灭[23]。 因此,吞噬能力是衡量巨噬细胞内炎症反应程度的重要指标。 不同处理组细胞吞噬能力的变化如图2a 所示,空白对照组细胞的吞噬能力为0.12,LPS 刺激后,细胞的吞噬能力显著升高,达到0.49,说明LPS 刺激后细胞内发生了严重的炎症反应,迫使细胞启动吞噬作用以清除异物,南极磷虾油处理组的细胞吞噬能力出现了不同程度的下降,其中,KO1 组细胞吞噬能力为0.43,KO2 和KO3 组的细胞吞噬能力无显著差别,分别为0.25 和0.23。
2.4 MPO 的变化
MPO 是中性粒细胞中含量较高的一种酶,凡是存在中性粒细胞浸润的组织,都会伴随MPO 活性的升高,因此MPO 被用来间接反映中性粒细胞浸润,也被广泛用于衡量炎症反应的程度[24]。 不同处理组细胞中MPO 的活力如图2b 所示,空白对照组细胞中MPO 的活力最低为1.78 U/L,LPS 刺激组细胞中的MPO 活力最高为6.95 U/L,南极磷虾干预可以显著降低细胞MPO 的活力,KO1 组、KO2 组和KO3 组MPO 活力分别为5.45,2.36,2.12 U/L,可以看出南极磷虾油对细胞内MPO 活力的抑制作用随浓度升高而增强,并且当浓度超过KO2 后,抑制作用并没有出现显著增加。
2.5 NO 的变化
NO 是一种重要的气态细胞信号分子和细胞毒性因子,NO 由NO 合酶(NOS)催化L-精氨酸而产生,其中诱导型NO 合酶(iNOS)分布在与炎症相关的巨噬细胞内。 正常情况下,细胞内NO 的产量很少,当发生炎症反应时,iNOS 被激活,细胞内合成大量NO,过量的NO 会导致DNA 损伤,线粒体呼吸抑制,此外NO 还有可能与超氧阴离子结合生成氧化性很强的过氧亚硝基阴离子,引发细胞内炎症级联瀑布反应,推动炎症发展[25]。 不同处理组细胞上清液中NO 的产量如图2c 所示,空白对照组中NO 的产量最少,仅为4 μmol/L,LPS 刺激后,细胞中NO 的产量出现了显著增加,达到23 μmol/L,南极磷虾油干预可以显著抑制细胞内NO的产生,其中KO1 组的干预效果显著差于KO2 组和KO3 组,而KO2 组和KO3 组之间的差异不显著。

图2 细胞吞噬能力、MPO 活力和NO 产量的变化Fig.5 The changes of cell phagocytosis ability,MPO activity and NO production
2.6 炎症因子的变化
当炎症爆发时,大量的血液和白细胞聚集在炎症发生部位,细胞中的炎症信号通路如NF-κB、Jak/Stat 被激活并释放多种促炎细胞因子,其中TNF-α、IL-1β 和IL-6 是促炎细胞因子中的重要代表,它们的分泌水平可以反映炎症反应的程度,为进一步评价南极磷虾油的抗炎效果,进一步考察了南极磷虾油对炎症因子分泌量的影响,结果如图3a~3c 所示。 空白对照组中炎症因子的分泌量均最低,TNF-α、IL-1β 和IL-6 的分泌量分别为53,18,31 ng/L,LPS 刺激组中炎症因子的分布量最高,分别为468,165,212 ng/L。 南极磷虾油处理组中炎症因子的分泌量均有所下降,其中KO2 组和KO3 组对炎症因子分泌量的抑制作用更为显著,对于炎症因子来讲,南极磷虾油对TNF-α 的抑制作用显著强于IL-1β 和IL-6。TNF-α 是炎症反应过程中出现最早、最重要的炎性介质,能激活中性粒细胞和淋巴细胞,使血管内皮细胞通透性增加,调节其它组织代谢活性,并促使其它细胞因子的合成和释放,TNF-α 水平升高与自身免疫性疾病关系密切[26]。 不同处理组细胞中炎症因子的表达量如图3d~3f 所示,可以看出南极磷虾油抑制了LPS 引发炎症因子基因的表达量的升高,其中南极磷虾油对TNF-α 的抑制作用更为显著,这与炎症因子分泌量的结构相一致。
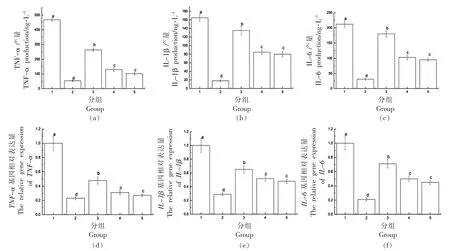
图3 炎症因子分泌量及基因表达量的变化Fig.3 The secretion and gene expression changes of inflammatory factor
2.7 关键酶(iNOS 和COX-2)基因表达量的变化
在诸多与炎症相关的疾病中,iNOS 被认为是一种关键的限速酶,在类风湿性关节炎、动脉粥样硬化等疾病的病变过程中起着举足轻重的作用。iNOS 的主要功能是诱导产生过量的NO,NO 可以直接参与与炎症相关的生理活动,促进炎症的发展。 COX-2 与iNOS 一样,在正常的组织中几乎不表达,一旦细胞受到炎症刺激时,便会大量表达,由于COX-2 可以快速应答一系列促炎介质和细胞因子,被认为是表征炎症反应的重要指标[27]。 不同处理组细胞中iNOS 和COX-2 基因的表达量如图4 所示。 LPS 刺激组细胞中iNOS 和COX-2 的表达量均为最高,空白组细胞中的表达量处于较低水平,不同浓度南极磷虾油处理后细胞中iNOS和COX-2 的表达量均显著低于LPS 组,且表达量随着南极磷虾油浓度的增加而减少,这说明,南极磷虾油可以显著抑制细胞中iNOS 和COX-2 的表达,且这种作用随着浓度的增加而增强。

图4 iNOS 和COX-2 基因表达的变化Fig.4 The gene expression changes of iNOS and COX-2
3 讨论
炎症反应作为一种基础性生理过程,是自身抵御异物入侵的保护屏障,然而当炎症反应过度时,长时间的炎症反应会损伤组织,诱发炎症性疾病,如心血管疾病、肥胖、炎症性肠炎等。 长期以来,膳食补充鱼油制品已经被用于诸多炎症疾病的管控,原因是鱼油中富含具有抗炎作用的n-3PUFA。 近年来,随着人们对南极磷虾资源认识的不断深入,南极磷虾油在抗炎方面也展现了巨大的潜力,首先,由于南极磷虾更接近n-3PUFA 传递食物链的初始端,南极磷虾油中n-3PUFA 的含量高于普通鱼油,其次,南极磷虾油中富含磷脂,磷脂型n-3PUFA 与细胞膜的融合性优于鱼油中的甘三酯型的n-3PUFA,再次,南极磷虾油中还含有虾青素、生育酚等生物活性物质,可以调节氧化应激反应。
巨噬细胞在炎症反应过程中扮演了重要的角色,当细胞受到炎症刺激时,巨噬细胞会通过细胞内信号分子传导,使自身形态发生改变,包围在刺激物周围,并通过吞噬作用将其清除,炎症反应越强烈,巨噬细胞的吞噬能力就越强,因此检测细胞的吞噬能力能反映炎症反应的强弱。 在本研究中LPS 刺激可以显著提高细胞的吞噬能力,南极磷虾油干预后细胞的吞噬能力均有所下降,而低浓度南极磷虾油干预的效果不显著,中、高浓度南极磷虾油展现了较好的干预效果。 中性粒细胞浸润是炎症反应中的另一个重要特征,表现为炎症细胞聚集在炎症灶周围,MPO 是中性粒细胞功能被激活的标志,其水平及活性变化代表嗜中性多形核白细胞功能和状态的改变,在本试验中,南极磷虾油显著抑制了LPS 导致的细胞内MPO 活性的升高,这表示南极磷虾油可以抑制中性粒细胞的炎症性浸润。
炎症因子是细胞在受到炎症刺激后产生的一系列小分子生物活性物质,常见的炎症因子主要有TNF-α、IL-1、IL-6、转化生长因子-β(TGF-β)等,这些炎症因子可以通过促进细胞的分化,诱导靶细胞程序性死亡等途径参与炎症反应[28]。 本研究的结果表明,南极磷虾油可以抑制炎症因子基因表达,减少促炎因子的分泌,抑制炎症反应的发展,并且南极磷虾油对TNF-α 的抑制作用更为显著。 iNOS 和COX-2 是炎症反应过程中的关键诱导酶,它们在炎症反应中的主要作用是合成炎症介质NO、前列腺素和白细胞三烯,这些物质都是很强的促炎介质,即使在低浓度下也会引发炎症级联反应,在本研究中,南极磷虾油对iNOS 和COX-2 的表达均起到了一定的抑制作用,并且高浓度南极磷虾油的抑制作用更为显著。
4 结论与展望
本文以LPS 诱导的RAW264.7 细胞为炎症模型,采用不同浓度的南极磷虾油对其进行干预,通过细胞的形态、 细胞吞噬能力、 髓过氧化物酶活力、促炎细胞因子(TNF-α、IL-1β 和IL-6)等指标分析了南极磷虾油的抗炎能力,并通过炎症因子及炎症关键酶(iNOS 和COX-2)基因的表达初步研究了其抗炎的机理,研究表明,南极磷虾油可以通过抑制炎症关键酶和炎症因子基因的表达,降低促炎细胞因子的分泌,发挥抗炎作用,并且当南极磷虾油的浓度高于KO2 组时,便展现了较好的抗炎效果,本研究进一步拓展了南极磷虾油的生物学效应,并为南极磷虾的资源开发提供了参考,今后的研究将会从南极磷虾油组分与其抗炎作用之间的关联展开,进一步明确南极磷虾油的抗炎机制。
