石花菜醇提物提取工艺及抗氧化、抗菌活性研究
2023-02-17王奇升但阿康罗海涛田永奇汪少芸邓尚贵
王奇升,但阿康,罗海涛,田永奇*,汪少芸,邓尚贵
(1 福州大学生物科学与工程学院 福州 350108 2 浙江海洋大学食品与药学学院 浙江舟山 316000)
活性氧(Reactive oxygen species,ROS)通过正常的代谢活动产生。 当ROS 过量时,机体氧化-还原平衡被打破,产生氧化应激反应,并且ROS过量会导致衰老,以及增加各种人类疾病的风险。因此,维持机体ROS 水平处于动态平衡至关重要[1]。在国内发生的食品安全问题中,最为严重的是由微生物污染造成的食物中毒,现有研究表明,我国约81%的食源性疾病由食用不洁食品导致细菌感染引起,细菌性食源性疾病年发病量超过9 400万例次[2]。清除和控制食品接触表面的食源性致病菌显得尤为重要。
石花菜 (Gelidium amansii) 属于石花菜科(Gelidiaceae)石花菜属(Gelidium),分布在我国福建、浙江、山东和台湾等沿海地区[3]。石花菜生长于低潮带下2~4 m 处的珊瑚礁上,是温带重要的经济性海藻[4]。 石花菜中含有丰富的蛋白质、多糖和脂肪酸等,在食品、生物技术和美容等领域都得到广泛应用[5]。石花菜可药食两用,具有清热解毒、抗肿瘤和防便秘等功效,闽南地区将其制成石花膏食用,山东地区则制成美味的凉粉[6-7]。石花菜作为全球的经济红藻之一,其研究主要集中在多糖等大分子,醇溶性小分子等成分常被当作副产物而丢弃。 其实,石花菜醇提物有很高的利用价值,其蕴含的化合物很可能作为功能食品或药品的先导物。Seo 等[8]及Lee 等[9]研究发现石花菜醇提物能有效抑制活性氧的生成。 王慧等[10]研究发现石花菜多糖对糖尿病大鼠有降血糖作用。 此外,林雄平等[11]研究发现石花菜提取物对黑曲霉有较强的抑制作用。
本研究以石花菜为原料,通过单因素实验和响应面法探究石花菜醇提物的提取工艺,比较石花菜醇提物不同萃取相清除DPPH 自由基、ABTS+自由基和羟基自由基的能力,并探究其对食源性致病菌的抑菌活性,为石花菜高值化利用提供理论参考。
1 材料与方法
1.1 材料与试剂
石花菜来自于福建福州、漳州海域;1,1-二苯基-2-三硝基苯肼 (DPPH)、2,2-联氨-双-(3-乙基苯并噻唑啉-6-磺酸)二铵盐(ABTS),上海源叶生物科技有限公司;酶标板(96 孔),上海百千生物科技有限公司;金黄色葡萄球菌(Staphylococcus aureus)CMCC (B) 26003、 副溶血性弧菌(Vibrio parahaemolyticus)CICC 21528、大肠埃希氏菌(Escherichia coli)ATCC 8739、 弗尼斯弧菌(Vibrio furnissii)ATCC 35016,保藏于福州大学生物科学与工程学院。
1.2 仪器与设备
超声清洗仪(KQ5200DE),昆山超声仪器有限公司;旋转蒸发仪(RE-52AA),上海亚荣生化仪器厂;超纯水机(QYSW-10A),宝尔水处理有限公司;电子天平(HZK-FA2105),梅特勒托利多仪器(上海)有限公司;pH 计(FE20),河南爱博特科技发展有限公司; 紫外可见光分光光度计(Genesys10s),美 国Thermo Fisher Scientific 公司;粉碎机(RS-FS1406),合肥荣事达小家电有限公司。
1.3 试验方法
1.3.1 样品制备 用清水漂洗石花菜后,置于阴凉处自然风干。 称取1 kg 石花菜,用粉碎机将其打碎,制成石花菜粉末,过100 目筛,得石花菜粗粉。称取该粗粉,按比例与不同体积分数的乙醇溶液混合,在不同温度下,超声浸提不同时间,浸提结束后,8 500 r/min 离心10 min,取上清液减压浓缩后,获得石花菜醇提物。以石花菜醇提物得率及DPPH 自由基清除率(质量浓度为2 mg/mL)为指标进行工艺优化。
1.3.2 单因素实验
1.3.2.1 乙醇体积分数的选择 称取10 g 石花菜粗粉,以1 ∶25 的料液比加入体积分数分别为40%,50%,60%,70%,80%的乙醇溶液,搅拌均匀后在超声波功率为300 W,45 ℃下,恒温搅拌提取40 min。
1.3.2.2 料液比的选择 准确称取10 g 石花菜粗粉,分别以1∶20,1∶25,1∶30,1∶5,1∶40 的料液比,加入体积分数为60%的乙醇溶液,搅拌均匀后,在超声波功率为300 W,45 ℃下,恒温搅拌提取40 min。
1.3.2.3 超声时间的选择 准确称取10 g 石花菜粗粉,以1∶35 的料液比加入体积分数为60%的乙醇溶液,45 ℃下,恒温搅拌分别处理20,40,60,80,100 min。
1.3.2.4 超声功率的选择 准确称取10 g 石花菜粗粉,以1∶35 的料液比加入体积分数为60%的乙醇溶液,45 ℃下,分别选用不同超声波功率200,250,300,350,400 W 处理60 min。
1.3.2.5 提取温度的选择 准确称取10 g 石花菜粗粉,以1∶35 的料液比加入体积分数为60%的乙醇溶液,分别在25,35,45,55,65 ℃下,选用超声波功率350 W 处理60 min。
1.3.3 响应面试验设计 参照文献[12]和[13]利用Design-Expert V8.0.6 进 行Box-Behnken 设计响应面试验,以单因素实验结果为基础,以提取时间(A)、超声波功率(B)和提取温度(C)为自变量,响应值分别选择醇提物得率(Y1)和DPPH 自由基清除率(Y2),采用3 因素3 水平星点设计-响应面分析法拟合模型,得出最佳工艺参数。响应面因素和水平取值见表1。
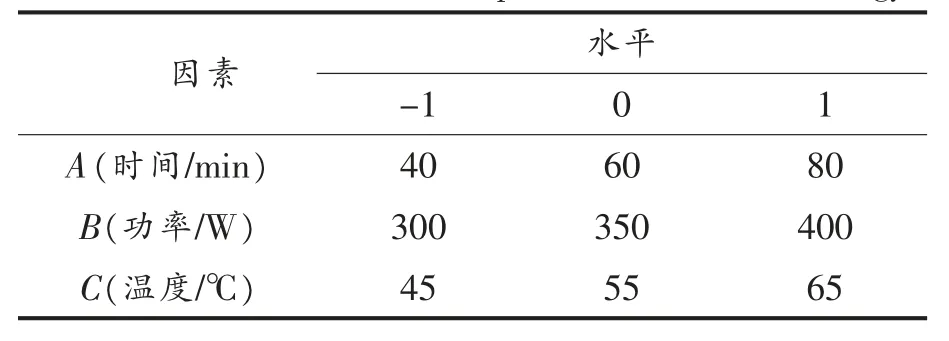
表1 响应面试验因素水平表Table 1 Factor levels of response surface methodology
1.3.4 石花菜醇提物体外抗氧化活性分析
1.3.4.1 样品溶液配制 使用DMSO 溶解样品,配制成2 mg/mL。
1.3.4.2 DPPH 自由基清除能力测定 参照文献[14]和[15]中的检测方法并做适当调整。 将DPPH用乙醇溶解并用磁力搅拌器搅拌30 min,于A517nm处调节吸光度为0.5~0.6,采用二倍稀释法,配制不同浓度的石花菜醇提物溶液。 100 μL 样品溶液中加入100 μL 的DPPH 混匀后记为A1样品组。100 μL 样品溶液中加入100 μL 乙醇记为A2参比组。100 μL 的DPPH 中加入100 μL 乙醇混匀后记为A0空白组。 25 ℃避光条件下静置孵育30 min,517 nm 波长处测定吸光值。 按公式(1)计算:
式中,A1——样品组测定吸光值;A2——样品参比组测定吸光值;A0——空白组测定吸光值。
1.3.4.3 ABTS+自由基清除率的测定 参照文献[16]中的测定方法做适当修改。 配制ABTS+自由基工作溶液。采用二倍稀释法,配制不同浓度的石花菜醇提物溶液。 100 μL 样品溶液中加入100 μL ABTS+自由基工作溶液,快速振荡混匀,25 ℃避光孵育10 min,在734 nm 波长处测定吸光值Ap。 同时用甲醇试剂代替ABTS+自由基工作液,其所测吸光值记为Ac;用甲醇试剂代替样品溶液,作为空白组对照组,其所测吸光值记为Amax。 用甲醇试剂调零。 所得结果按公式(2)计算:
式中,Ap——样品工作液组吸光度;Ac——样品工作液参比组吸光度;Amax——空白对照组吸光度。
1.3.4.4 羟自由基(·OH)清除能力测定 参照文献[17]中的检测方法并做适当调整。0.5 mL 样品与150 μL FeSO4(8 mmol/L),0.5 mL 水杨酸(3 mmol/L)和125 μL H2O2(20 mmol/L)混合,并在37 ℃下孵育30 min。 用水冷却后,添加225 μL 蒸馏水以使总体积达到1.5 mL,然后以3 000 r/min 离心10 min。在510 nm 波长处测量上清液的吸光度,并且使用甲醇代替样品作为空白对照A0。 所得结果按公式(3)计算:
式中,A0——空白组吸光度;Ai——样品组吸光度。
1.3.5 石花菜醇提物不同溶剂萃取相抗氧化活性测定
1.3.5.1 石花菜醇提物不同溶剂萃取相的制备将制备的石花菜醇提物分别加入石油醚、 乙酸乙酯和正丁醇中萃取,4 000 r/min 条件下,离心10 min,取上清液,蒸发浓缩至近干,DMSO 溶解配制成40 mg/mL 萃取相溶液,4 ℃冷藏保存备用。
1.3.5.2 DPPH 自由基清除能力的测定 参见1.3.4.2 节的方法。
1.3.5.3 ABTS+自由基清除率的测定 参见1.3.4.3节的方法。
1.3.5.4 羟自由基(·OH)清除率的测定 参见1.3.4.4 节的方法。
1.3.6 石花菜醇提物不同溶剂萃取相的抑菌活性评价
1.3.6.1 抑菌圈测定 参考文献[18]中的检测方法并做适当调整。 将石花菜醇提物不同溶剂萃取相溶于DMSO,配制样品质量浓度为10 mg/mL。分为石油醚萃取相、乙酸乙酯萃取相、正丁醇萃取相和剩余的水相。 试验中细菌培养用LB 培养基,将已灭菌好的固体培养基趁热倾注入培养皿内,在无菌条件下吸取菌液0.1 mL 滴在培养皿内摇匀。待平板凝固后用无菌打孔器(直径6 mm)在平板上打孔,用无菌镊子小心挑去培养基以做成圆孔,向孔中注入10 μL 样品,细菌放置37 ℃培养24 h。测量抑菌圈直径,每组样品重复3 次,得出抑菌圈直径平均值。
1.3.6.2 MIC 和MBC 参照文献[19]中的检测方法并做适当调整,采用二倍稀释法测定石花菜醇提物石油醚相和乙酸乙酯相对金黄色葡萄球菌和副溶血弧菌的MIC,设立只加菌液的阳性对照组,只加石花菜醇提物不同溶剂萃取相的阴性对照组,只加培养基的空白对照组,37 ℃恒温培养24 h 后,用肉眼观测,所有透明且澄清的96 孔板中,含最小的石花菜醇提物不同萃取相浓度的96 孔板所设定的浓度值,即为MIC。采用斜面滴液法测定MBC,从MIC 试验中所有澄清的试管中吸取0.05 mL 点滴到琼脂固体培养基上,37 ℃培养24 h 后观察,无菌落生长的培养基区域所对应的萃取相浓度为MBC。
1.3.6.3 抑菌成分对菌生长曲线的影响 参照文献[20]和[21]中的检测方法并做适当调整,将处于对数生长期的食源性致病菌,用LB 肉汤稀释至吸光度为0.06~0.08 之间(LB 肉汤调零)。 吸取1 mL菌液到30 mL 的LB 肉汤中,加入样品并使其终浓度为MIC。 并将LB 肉汤设置为空白组。 置于恒温摇床中37 ℃,180 r/min 培养。 每隔2 h,测定各组吸光度。
1.3.7 数据分析 所有试验重复3 次,结果表示为 “平均值±标准偏差”。 Design-Expert V8.0.6 Box-Behnken 设计原理进行响应面表格的制作,GraphPad Prism 8 绘制各影响因素间的互作图,最后利用SPSS 19.0 进行概率单位分析得出IC50,并且对全部数据进行单因素方差分析。
2 结果与分析
2.1 单因素分析
2.1.1 乙醇体积分数对醇提物得率及DPPH 自由基清除率的影响 由图1a 可知,当乙醇体积分数为60%时,石花菜醇提物得率达到最大值0.0149 g/g,DPPH 自由基清除率达到最大值57.52%。 因此,石花菜醇提物提取的最适乙醇体积分数为60%。
2.1.2 料液比对醇提物得率及DPPH 自由基清除率的影响 由图1b 可知,当料液比为1∶35 时,石花菜醇提物得率达到最大值0.0145 g/g,DPPH 自由基清除率也达到最大值56.48%。 因此,石花菜醇提物提取的最适料液比为1∶35。
2.1.3 超声波处理时间对醇提物得率及DPPH 自由基清除率的影响 由图1c 可知,当超声波处理时间为60 min 时,石花菜醇提物得率达到最大值0.0149 g/g,DPPH 自由基清除率也达到最大值56.37%。因此,石花菜醇提物提取的最适超声波处理时间为60 min。
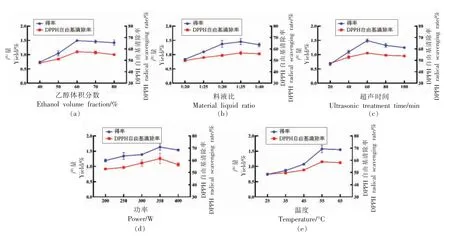
图1 不同因素对石花菜醇提物得率和DPPH 自由基清除率的影响Fig.1 Effects of different factors on the yield and DPPH radical scavenging rate of G.amansii ethanol extract
2.1.4 超声波处理功率对醇提物得率及DPPH 自由基清除率的影响 由图1d 可知,当超声波处理功率为350 W 时,石花菜醇提物得率达到最大值0.0163 g/g,DPPH 自由基清除率也达到最大值61.43%。因此,石花菜醇提物提取的最适超声波处理功率为350 W。
2.1.5 浸提温度对醇提物得率及DPPH 自由基清除率的影响 由图1e 可知,当浸提温度为55 ℃时,石花菜醇提物得率达到最大值0.0157 g/g,DPPH 自由基清除率也达到最大值58.77%。因此,石花菜醇提物提取的最适浸提温度为55 ℃。
2.2 响应面试验结果
2.2.1 试验设计与分析 利用Design Expert 8.0.6软件对表2 的数据进行多元回归拟合,得到石花菜醇提物得率(Y1)和DPPH 自由基清除率(Y2)对提取时间(A)、超声功率(B)和提取温度(C)的二次多元回归模型。
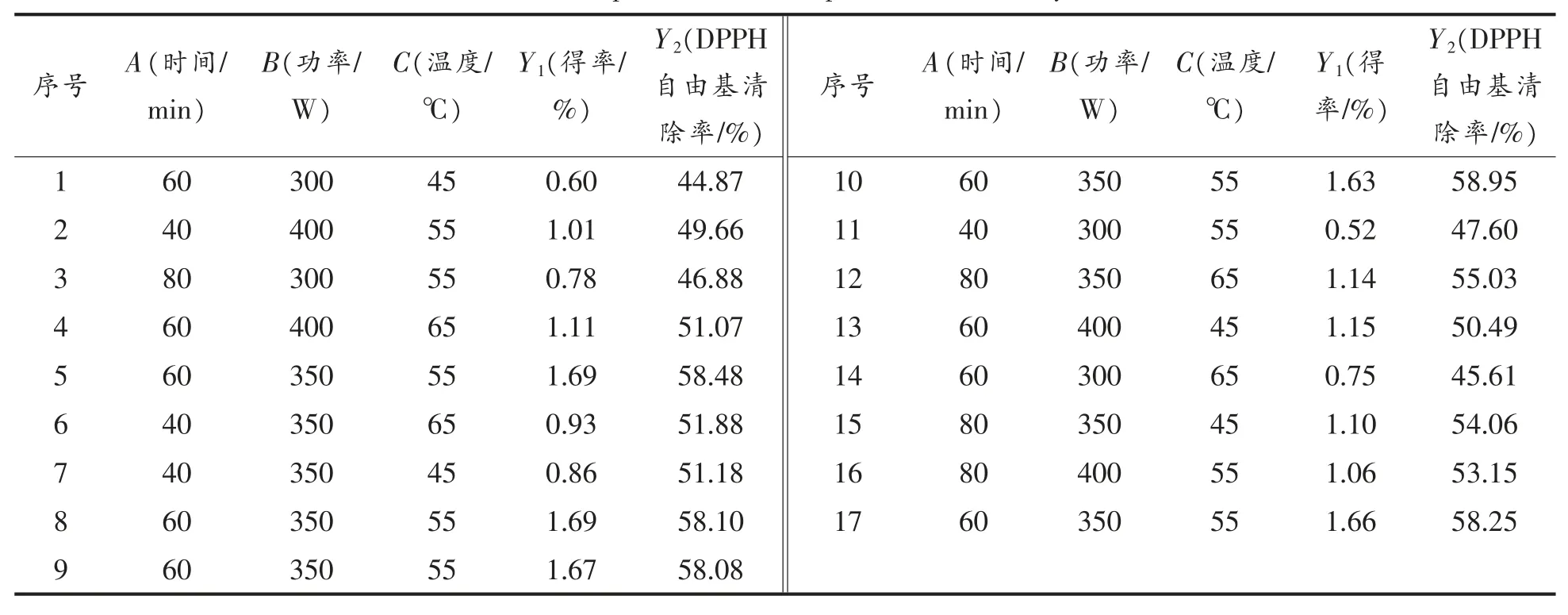
表2 响应面分析优化Table 2 Optimization of response surface analysis
Y1=1.67+0.0961A+0.2108B+0.0271C-0 .0525AB -0.0083AC -0.0475BC -0.3620A2-0.4652B2-0.2995C2,R2=0.9969。
Y2=58.37+1.10A+2.43B+0.3731C+1.05AB+0.0668AC-0.0397BC-2.01A2-7.04B2-3.32C2,R2= 0.9922。
回归模型Y1的R2和Y2的R2接近于1,说明该模型可以较好地拟合。
由表3 可知,回归模型的P<0.0001,得知模型所得方程与实际数据非常拟合,可用该模型设计试验,优化石花菜醇提物得率提取工艺。 根据Y1发现,该拟合方程F 检验极显著(P<0.0001),各种因素之间存在着一定的交互作用。 其中A、B、A2、B2和C2影响极为显著(P<0.01),AB、BC 影响显著(P<0.05)。 根据模型方差分析中可知A、B 和C 的F 值分别为65.90,316.79,5.25,在因素水平内,3个因素对石花菜醇提物得率的影响顺序为超声波功率(B)>提取时间(A)>提取温度(C)。 考虑各因素的交互作用,对石花菜醇提物得率的影响顺序为AB>BC>AC。
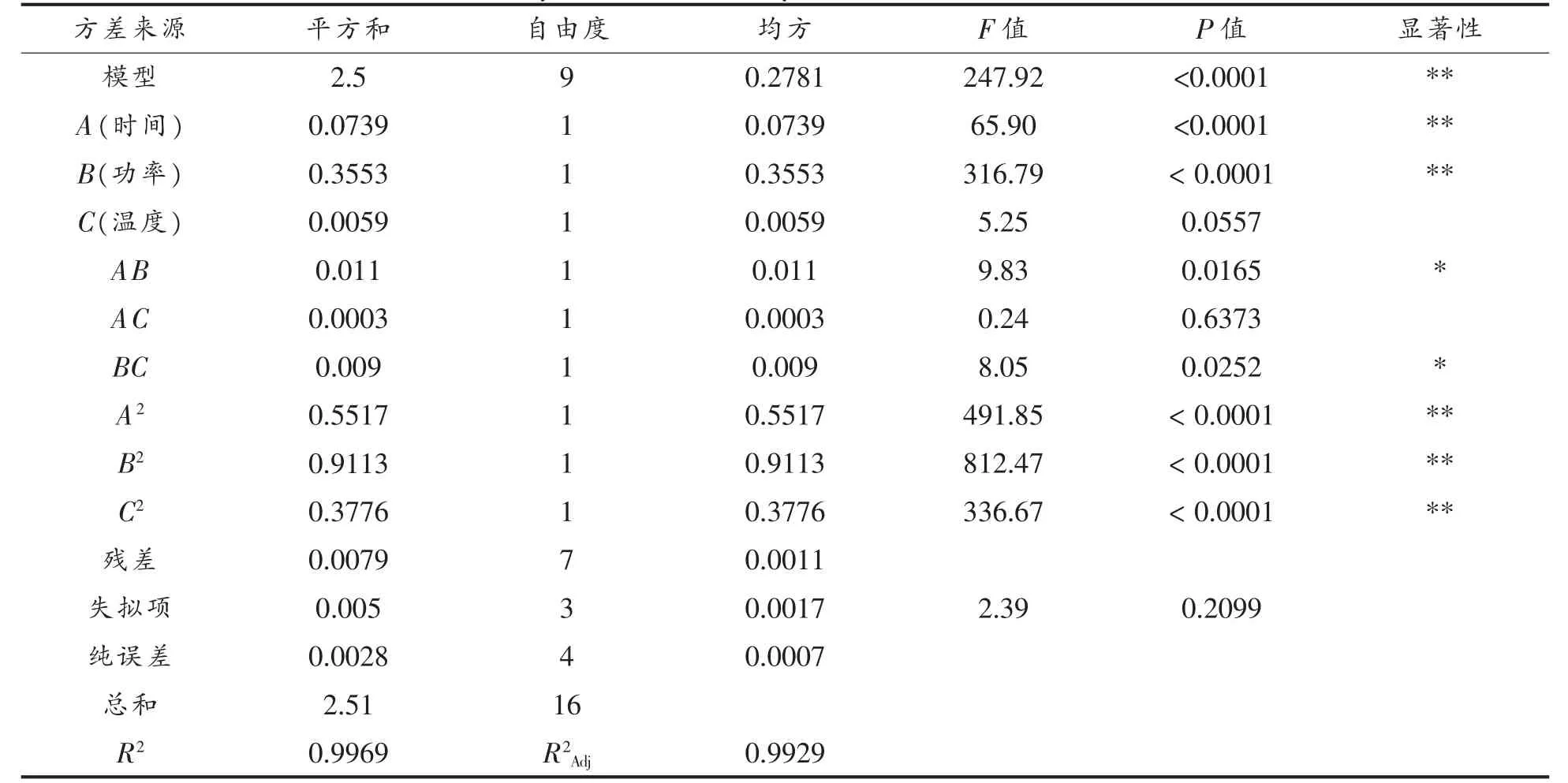
表3 石花菜醇提物得率方差分析表Table 3 Analysis of variance of yield of G.amansii ethanol extract
从表4 可知,回归模型的P<0.0001,得知模型所得方程与实际数据非常拟合,可用该模型设计试验,优化石花菜醇提物的DPPH 自由基清除率提取工艺。 3 个因素对石花菜醇提物的DPPH 自由基清除率的影响机理复杂。 根据Y2发现,该拟合方程F 检验极显著(P<0.0001),各种因素之间存在着一定的交互作用。 其中A、B、A2、B2、C2影响极为显著(P<0.01),AB 影响显著(P<0.05)。 根据模型方差分析中可知A、B、C 的F 值分别为24.19,117.52,2.78,在因素水平内,3 个因素对石花菜醇提物的DPPH 自由基清除率的影响顺序为超声波功率(B)>提取时间(A)>提取温度(C)。 考虑各因素的交互作用,对石花菜醇提物的DPPH自由基清除率的影响顺序为AB>AC>BC。
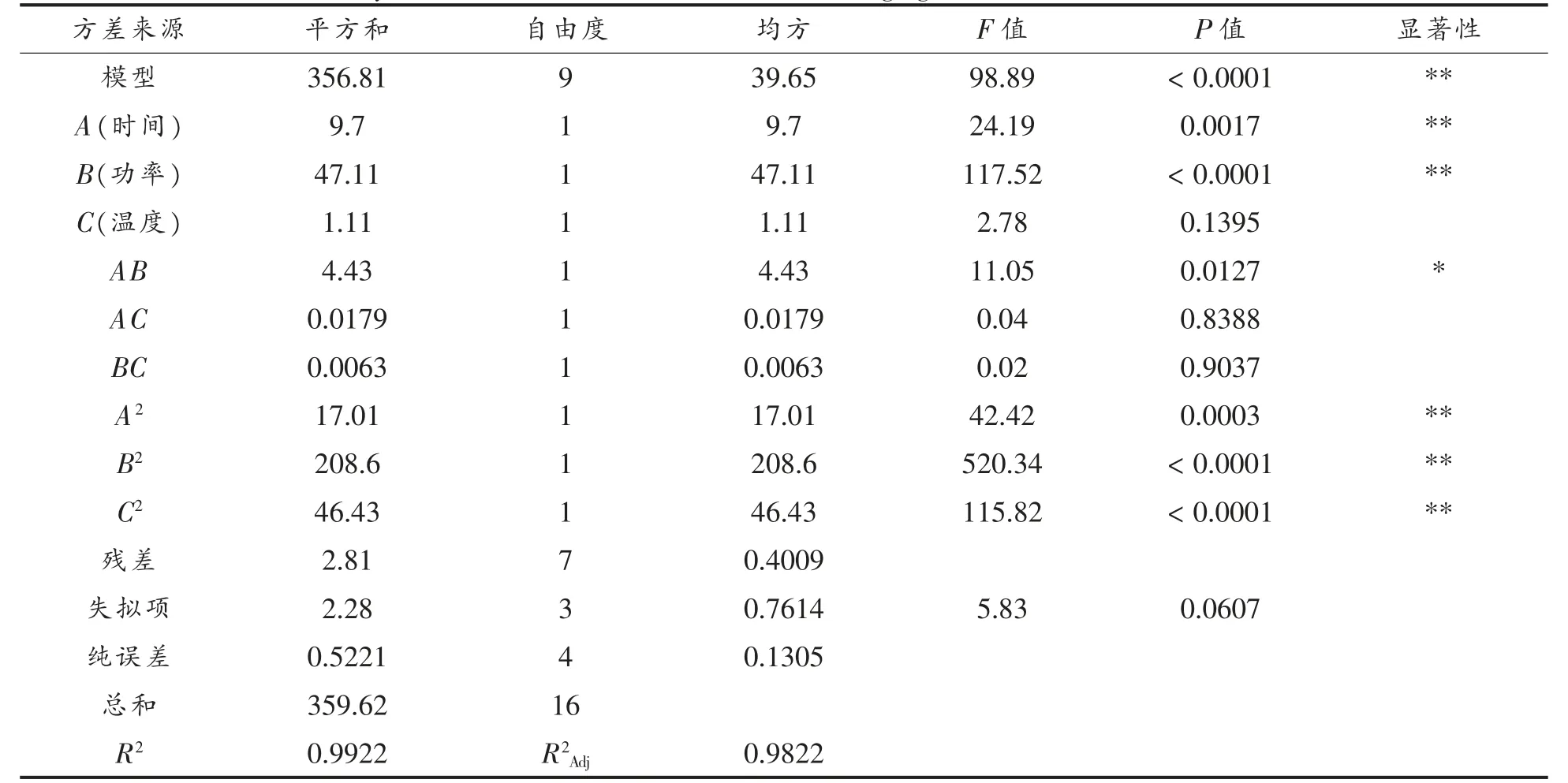
表4 石花菜醇提物DPPH 自由基清除率方差分析表Table 4 Analysis of variance on DPPH radical scavenging rate of G.amansii ethanol extract
2.2.2 因素间交互作用 3 个因素中固定其中1个因素,分析另外2 个因素,得到相应的响应曲面。 根据拟合的二次多项式模型,使用Design-Expert 8.0.6 软件绘制二维等高线图和三维效应图,根据提取时间、超声波功率和提取温度3 个因素构成的响应面图,可以直观地反映两因素交互作用对石花菜醇提物得率和DPPH 自由基清除率的影响。
2.2.2.1 提取时间(A)、超声波功率(B)和提取温度(C)对石花菜醇提物得率(Y1)的影响 根据图2 可以直观地看出各因素交互作用对石花菜醇提物得率的影响,若曲面越陡峭,表明响应值对于操作条件的改变越显著,此因素的交互作用对石花菜醇提物得率影响越大;反之曲面坡度越平缓,操作条件的改变对响应值的影响也就越小。 温度在0 水平时,超声功率在350 W 附近时,随着提取时间的延长,石花菜醇提物得率先上升后下降;超声功率在0 水平时,时间在60 min 附近时,随着温度的升高,石花菜醇提物得率先上升后下降;提取时间在0 水平时,温度在55 ℃附近时,随着超声功率的增加,石花菜醇提物得率先上升后下降。超声功率与时间交互作用对石花菜醇提物得率影响更为显著。
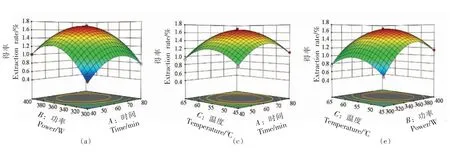
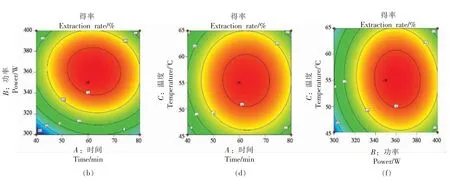
图2 等高线图和响应面图Fig.2 Contour plot and response surface plot
2.2.2.2 提取时间(A)、超声波功率(B)和提取温度(C)对石花菜醇提物DPPH 自由基清除率(Y2)的影响 根据图3 可以直观地反映出各因素交互作用对石花菜醇提物DPPH 自由基清除率的影响。 温度在0 水平时,超声功率在350 W 附近时,随着提取时间的延长,石花菜醇提物DPPH 自由基清除率先升高后降低;超声功率在0 水平时,时间在60 min 附近时,随着温度的升高,石花菜醇提物DPPH 自由基清除率先升高后降低; 提取时间在0 水平时,温度在55 ℃附近时,随着超声功率的增加,石花菜醇提物DPPH 自由基清除率先升高后降低。 超声功率与时间交互作用对石花菜醇提物DPPH 自由基清除率影响更为显著。
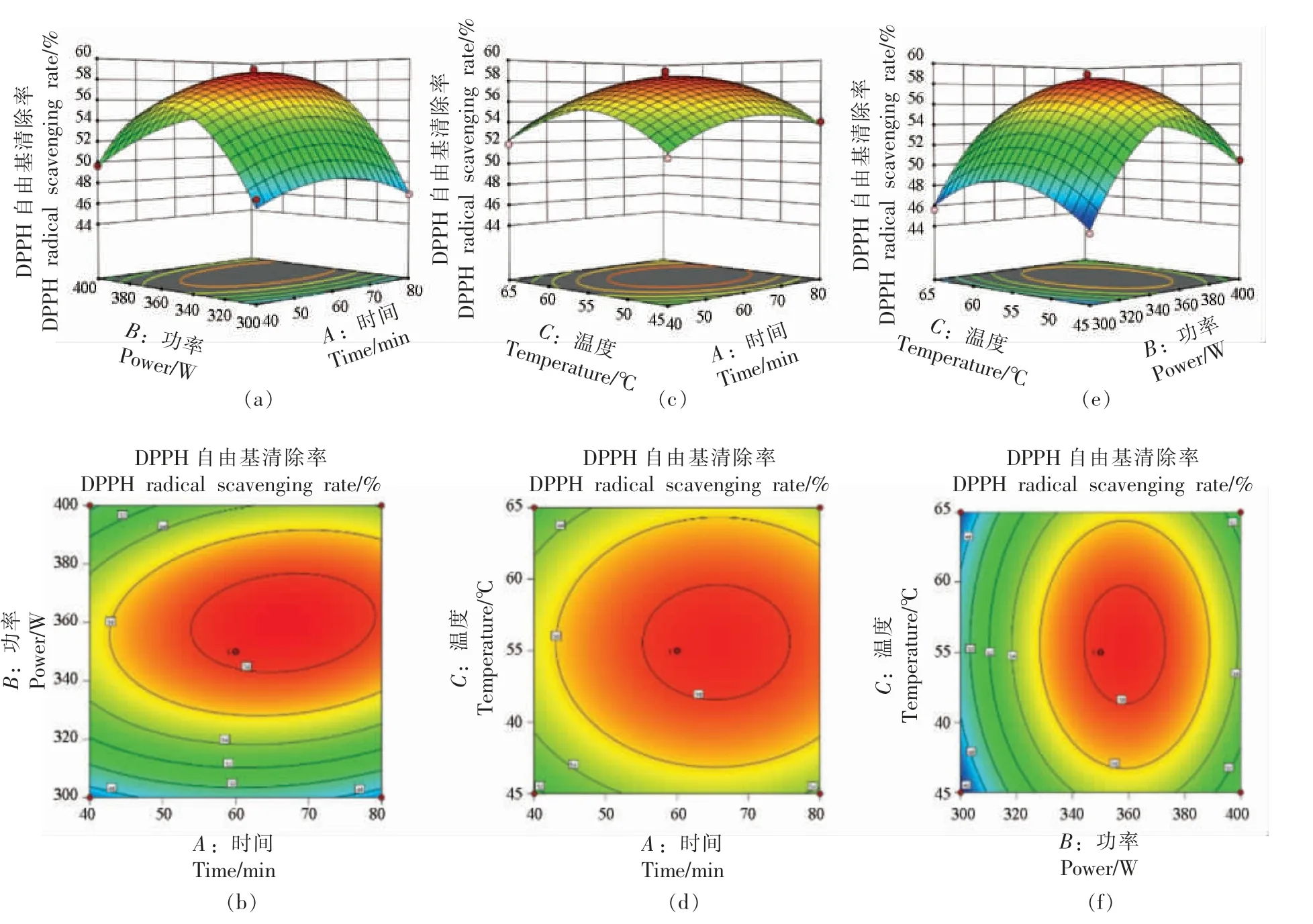
图3 等高线图和响应面图Fig.3 Contour plot and response surface plot
2.2.3 验证试验 该试验设计优化后的最佳提取工艺条件为: 提取时间63.71 min,超声功率359.89 W,提取温度55.42 ℃。 结合试验条件的可行性,将实际操作改良为提取时间64 min,超声功率350 W,提取温度55 ℃,在此条件下重复3 次试验,石花菜醇提物的得率为0.0165 g/g(n=3),石花菜醇提物DPPH 自由基清除率为58.29%(n=3)与理论得率接近,表明响应面优化得到的提取条件可用于提高石花菜醇提物得率与DPPH 自由基清除率。
2.3 石花菜醇提物不同溶剂萃取相抗氧化活性分析
2.3.1 石花菜醇提物不同溶剂萃取相对DPPH 自由基清除作用的比较 由图4a 可知,质量浓度为0~10 mg/mL 时,石花菜醇提物不同溶剂萃取相清除DPPH 自由基能力随质量浓度增大而增大。 由图4b 可知,乙酸乙酯萃取相清除DPPH 自由基的IC50最小,为672.4 μg/mL。 正丁醇萃取相、石油醚萃取相和萃取后剩余的水相,IC50分别为1 759.4,3 372.9,3 461.2 μg/mL。 综上,乙酸乙酯萃取相清除DPPH 自由基能力最好,水相清除DPPH 自由基能力最弱。

图4 不同溶剂萃取相清除DPPH 自由基能力及IC50Fig.4 DPPH radical scavenging ability and IC50 of different solvent extraction phases
2.3.2 石花菜醇提物不同溶剂萃取相对ABTS+自由基清除作用的比较 由图5a 可以看出,质量浓度为0~0.35 mg/mL 时,石花菜醇提物不同溶剂萃取相随着质量浓度增加,萃取相清除ABTS+自由基能力增强,当达到0.2 mg/mL 时,清除率均大于80%,此后,清除ABTS+自由基能力随质量浓度增加的递增趋势逐渐变缓。 由图5b 可知,不同溶剂萃取相清除ABTS+自由基的IC50大小顺序为:乙酸乙酯>正丁醇>粗提物>石油醚>水,表明乙酸乙酯萃取相清除ABTS+自由基能力最好,其IC50为14.1 μg/mL。
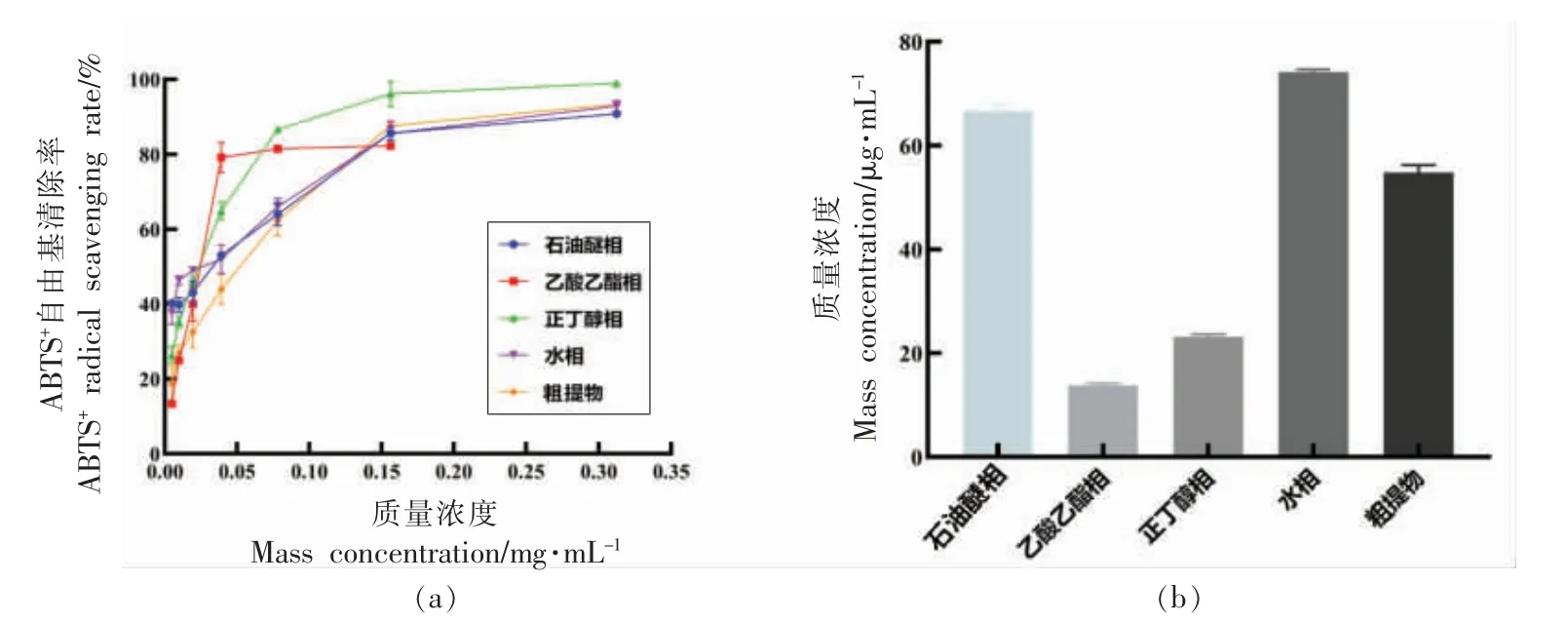
图5 不同溶剂萃取相清除ABTS+自由基能力及其IC50Fig.5 ABTS+ radical scavenging ability and IC50 of different solvent extraction phases
2.3.3 石花菜醇提物不同溶剂萃取相对羟自由基清除能力清除作用的比较 由图6a 可以看出,质量浓度为0~2 mg/mL 时,石花菜醇提物不同溶剂萃取相随着质量浓度增加,萃取相清除羟自由基(·OH)清除能力增强。 由图6b 可知,不同溶剂萃取相清除羟自由基(·OH)的IC50大小顺序为:乙酸乙酯>正丁醇>水>粗提物>石油醚,表明乙酸乙酯萃取相清除羟自由基(·OH) 能力最好,IC50为599.7 μg/mL。
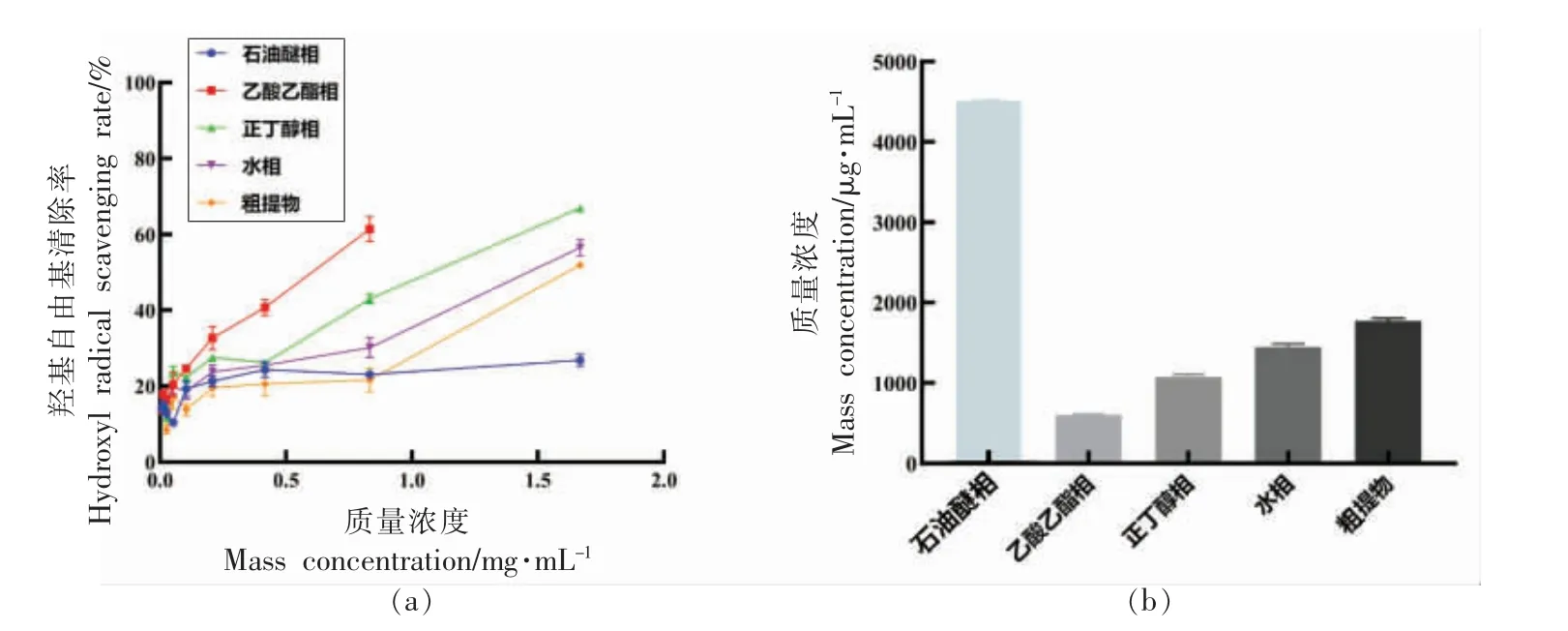
图6 不同溶剂萃取相清除羟自由基(·OH)能力及IC50Fig.6 Hydroxyl radical scavenging ability and IC50 of different solvent extraction phases
2.4 石花菜醇提物不同溶剂萃取相的抑菌作用
由图7 和表5 可知,石油醚相和乙酸乙酯相对金黄色葡萄球菌和副溶血弧菌具有一定抑制效果,而对大肠杆菌和弗尼斯弧菌无明显抑菌活性。其余萃取相对4 种菌均无明显抑制活性。 石油醚相对金黄色葡萄球菌和副溶血性弧菌的抑菌圈大小为(6.21±0.39)mm 和(7.41±0.47)mm;乙酸乙酯相对金黄色葡萄球菌和副溶血性弧菌的抑菌圈大小为(11.43±0.45)mm 和(8.92±0.61)mm。 乙酸乙酯相抑菌圈显著大于石油醚相抑菌圈,表明石花菜醇提物乙酸乙酯相抑菌活性最强,且乙酸乙酯相中含有抑制金黄色葡萄球菌和副溶血性弧菌的活性物质。

表5 不同萃取相对金黄色葡萄球菌、副溶血性弧菌、大肠杆菌和弗尼斯弧菌的抑菌效果Table 5 Antibacterial effect of different extracts of G.amansii ethanol extract on S.aureus,V.parahaemolyticus,E.coli,and V.furnissii

图7 石花菜醇提物不同萃取相对菌的抑菌圈大小Fig.7 Inhibition zone size of different extracts of G.amansii ethanol extract on bacteria
2.5 MIC 和MBC 结果
试验结果可得,石油醚相对金黄色葡萄球菌、副溶血性弧菌的MIC 为0.6250,0.1563 mg/mL。 乙酸乙酯相为0.1563,0.1563 mg/mL。 由图8 可知,石油醚相对金黄色葡萄球菌和副溶血性弧菌的MBC 分别为>0.6250 mg/mL 和0.6250 mg/mL。 乙酸乙酯相对金黄色葡萄球菌和副溶血性弧菌的MBC 分别为0.6250 mg/mL 和0.3125 mg/mL。 表明石花菜醇提物乙酸乙酯相杀菌能力最强。

图8 石花菜醇提物对食源性致病菌的最小杀菌浓度Fig.8 MBC of different extracts of G.amansii ethanol extract against bacteria
2.6 石花菜石油醚萃取相和乙酸乙酯萃取相对菌株生长的影响
由图9 可知,金黄色葡萄球菌空白组在0~8 h,快速繁殖,在8~24 h,繁殖速度减缓。 副溶血性弧菌空白组在0~4 h,快速繁殖,在4~24 h,繁殖速度减缓。 浓度为MIC 的石油醚萃取相和乙酸乙酯萃取相能明显抑制金黄色葡萄球菌和副溶血性弧菌的生长。 试验表明石油醚萃取相和乙酸乙酯萃取相能抑制金黄色葡萄球菌和副溶血性弧菌的生长,2 个萃取相中均含有抑菌活性物质,其中乙酸乙酯相中含有抑菌能力更强的活性物质,值得后续深入研究。
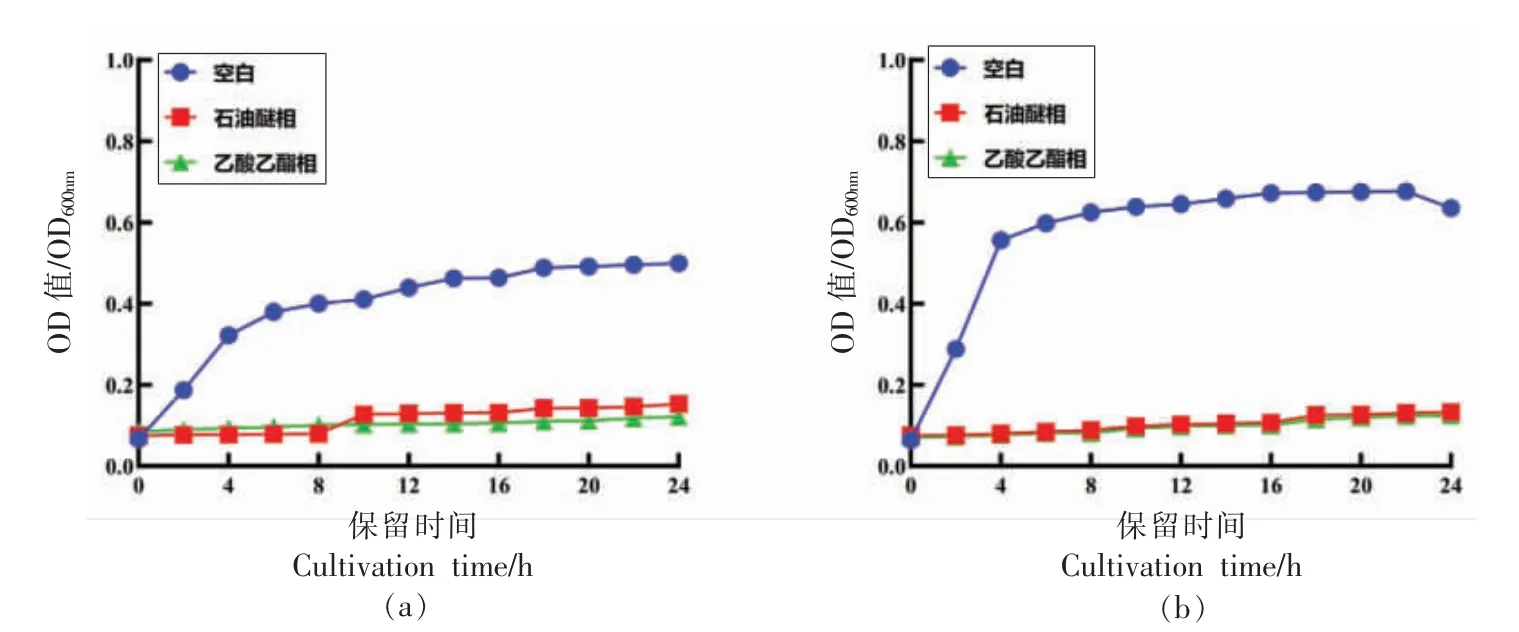
图9 不同萃取相对金黄色葡萄球菌生长曲线(a)、副溶血弧菌的生长曲线(b)的影响Fig.9 Effects of different extraction phases of G.amansii ethanol extract on the growth curve of S.aureus (a),V.parahaemolyticus (b)
3 结论与讨论
本研究通过响应面法优化石花菜醇提物的提取工艺,并研究石花菜醇提物不同萃取相的抗氧化和抑菌活性。结果显示,石花菜醇提物的最佳提取工艺为:提取时间64 min,超声功率350 W,提取温度55 ℃,60%乙醇溶液,料液比1∶35,所得石花菜醇提物得率为0.0165 g/g,DPPH 自由基清除率为58.29%(质量浓度为2 mg/mL)。 石花菜醇提物不同萃取相的抗氧化能力依次为乙酸乙酯相>正丁醇相>石油醚相。石花菜醇提物抑菌能力依次为乙酸乙酯相>石油醚相>正丁醇相。其中,乙酸乙酯相抗氧化能力和抑菌能力均为最高,值得后续深入研究。
目前,对于石花菜的研究多集中在多糖等大分子,而小分子化学成分研究较少。 试验结果表明,石花菜醇提物与石花菜多糖相比,具有更强的抗氧化活性和抑菌活性[1]。 因此,对石花菜醇提物抗氧化和抑菌活性进行更加系统深入的研究,并以此指导天然抗氧化剂、 防腐剂的开发应用具有重要意义。本试验研究对象均为粗提物,其活性成分物质并未详细明确的指出,后续研究可以通过药物化学手段详细阐明其具有活性的化学成分,并且深入到石花菜醇提物体内抗氧化活性和抗菌机制的研究。本研究表明,石花菜醇提物具有作为天然抗氧化剂和防腐剂的应用潜力,可为石花菜高值化利用提供理论参考。
