低盐苦荞黄豆酱的理化性质及风味物质分析
2023-02-15拉普莫拉子曾虹月肖迪邓雅丹杨淑苹杨康肖龙泉
拉普莫拉子,曾虹月,肖迪,邓雅丹,杨淑苹,杨康,肖龙泉,2*
(1.成都大学 食品与生物工程学院,成都 610106;2.成都大学农业农村部杂粮加工重点实验室,成都 610106)
传统豆酱大多以大豆和面粉为原料,是经发酵制成的半流动状态食品[1]。目前,豆酱原料成分单一,导致产品同质化严重,因此消费者的选择范围受限。苦荞作为传统的农作物,不仅具有普通粮食的营养价值,其中镁、钾、铁、钙等矿物质营养元素的含量丰富,是大米和小麦面粉的2~3倍,含有芦丁、蛋白质等多种活性物质,具有降血糖、保护肝脏、预防冠心病等功能[2-4]。随着人们对保健食品及其食疗作用的重视,苦荞因其丰富的活性物质和优良的保健效果深受人们的青睐[5]。本文用苦荞替代传统豆酱中的面粉,可增加苦荞特有的芦丁成分和硒等微量元素,并赋予豆酱芦丁特有的清香。苦荞的加入不仅可以增加产品的抗氧化能力,而且其保健成分芦丁与大豆中的异黄酮成分互补,大大提升了保健性能[6-7];此外,苦荞还可以赋予豆酱独特的风味。
1 材料与方法
1.1 实验材料
黄豆、面粉、苦荞:成都十陵镇好乐购超市;米曲霉沪酿3.042:山东和众康源生物科技有限公司;氢氧化钠、磷酸二氢钠、磷酸氢二钠、无水碳酸钠、邻苯二甲酸氢钾、硝酸铝、醋酸钾、三氯乙酸、盐酸、福林酚(均为分析纯)、酪氨酸(BR)、干酪素(BR)、酚酞(指示剂):成都市科隆化学品有限公司。
1.2 主要仪器与设备
HH-8型电热恒温水浴锅 北京科伟永兴仪器有限公司;101-4型恒温鼓风干燥箱、SPX-150B智能型生化培养箱 上海琅玕实验设备有限公司;FA2004型电子天平 上海佑科仪器仪表有限公司;UV-5200型紫外可见分光光度计 上海元析仪器有限公司;LD-5型离心机 江苏省金坛市荣华仪器制造有限公司;Testo 205便携式pH计 深圳德图仪表有限公司;HZ85-2型磁力搅拌器 北京中兴伟业仪器有限公司。
1.3 实验方法
1.3.1 豆酱的制曲工艺
工艺流程:泡豆→蒸煮→拌粉接种→制曲→装罐发酵。
泡豆:豆和水以1∶3(质量和体积比)的比例于25 ℃条件下浸泡12 h。
蒸煮:将黄豆隔水蒸煮约45 min,至手搓能成粉末、无夹生且豆粒完整,冷却至45 ℃备用。
拌粉接种:将苦荞用粉碎机粉碎后与米曲霉以10 000∶4的比例混合,再与上述蒸煮冷却后的黄豆按照4∶1(黄豆以干豆质量计)混合。
制曲:在拌好的大豆上面盖一层湿润的纱布,放入30 ℃恒温培养箱中培养,使霉菌获得适宜的温度和湿度。
装罐发酵:将盐水(低盐浓度为10%,高盐浓度为15%)与黄豆按质量比1∶1加入到已灭菌的玻璃罐中,于30 ℃培养箱中进行发酵。
1.3.2 水分含量的测定
按照GB 5009.3—2016《食品安全国家标准 食品中水分的测定》中的直接干燥法测定[8]。
1.3.3 蛋白酶活力的测定
按照SB/T 10317—1999《蛋白酶活力测定法》测定[9]。
1.3.4 氨基酸态氮含量的测定
按照GB 5009.235—2016《食品安全国家标准 食品中氨基酸态氮的测定》中的电位滴定法测定[10]。
1.3.5 总酸的测定
按照GB/T 12456—2008《食品中总酸的测定》中的方法进行测定[11]。
1.3.6 pH值的测定
使用便携式pH计测定,pH计使用前需进行校正。
1.3.7 挥发性风味物质的测定
采用气相色谱-质谱联用(GC-MS)的方法[12]对低盐接种米曲霉组和高盐接种米曲霉组的苦荞豆酱进行挥发性风味物质分析。
各称取约5.0 g发酵28 d的豆酱样品于20 mL顶空瓶中,分别加入1.0 g氯化钠调节离子强度,混合后密封待测。在50 ℃恒温下,用65 μm PDMS/DVB萃取头萃取样品40 min(转速为200 r/min),富集提取样品中的挥发性风味物质。萃取后将萃取头插入气质联用仪进样口解吸5 min。
气相色谱条件:HP-5MS毛细管柱(30 m×0.25 mm×0.25 μm),载气为氦气(He),流速为1.0 mL/min;进样温度为250 ℃。程序升温过程:开始以40 ℃维持3 min,随后以5 ℃/min升至100 ℃,再以6 ℃/min升至220 ℃,并保持10 min,不分流进样。质谱条件:电离方式为电子离子源(EI),能量为70 eV;离子源温度为230 ℃,四级杆温度为150 ℃;扫描模式为全扫描,扫描范围为35~400 amu。
挥发性化合物的定性:采用美国国家标准技术研究所(NIST 17.L)谱库检索进行化合物组成的分析,保留匹配度>750的化合物。
2 结果与分析
2.1 制曲过程中水分含量的变化
由图1可知,制曲过程中两组样品的水分含量都随着时间的延长逐渐降低,其主要原因是制曲过程中水分蒸发。初始值均在55%左右,自然制曲的样品比接种制曲的样品水分含量下降速度快,制曲 72 h时,自然制曲组水分含量为34.0%,接种米曲霉组水分含量为40.2%。

图1 制曲过程中水分含量的变化Fig.1 Change of moisture content during koji making
2.2 制曲过程中蛋白酶活力的变化
由图2可知,在制曲过程中,自然发酵组的蛋白酶活力呈现上升趋势,前期上升速率较慢且其蛋白酶活力低于米曲霉接种组,但在制曲60 h后,自然发酵组蛋白酶活力高于接种米曲霉组;接种组蛋白酶活力呈先上升后下降的趋势,60 h时达到最大值,为1 686 U/g干基。这可能是由于体系中葡萄糖等淀粉水解产物对霉菌产蛋白酶有阻碍作用;或蛋白质被米曲霉分解产生大量的氨基酸、多肽等,抑制了蛋白酶的产生,使蛋白酶活力下降[13]。

图2 制曲过程中蛋白酶活力的变化Fig.2 Change of protease activity during koji making
2.3 发酵过程中氨基酸态氮含量的变化
由图3可知,3组豆酱的氨基酸态氮含量都呈现上升趋势,这是由于体系中的蛋白质被微生物代谢产生的蛋白酶降解,成为小分子多肽和游离氨基酸,使得氨基酸态氮含量快速增加[14]。接种米曲霉的豆酱氨基酸态氮含量涨幅较大,且始终高于自然发酵组;低盐接种组的氨基酸态氮含量最高,在装罐发酵13 d时氨基酸态氮含量为1.35 g/100 g,而此时高盐组为1.24 g/100 g,自然发酵组为0.618 g/100 g,低盐接种米曲霉组氨基酸态氮含量接近自然发酵组的2倍。从氨基酸态氮含量来看,低盐苦荞黄豆酱的生长品质最佳,高盐接种发酵组次之,自然发酵组较差。

图3 发酵过程中氨基酸态氮含量的变化Fig.3 Change of amino acid nitrogen content during fermentation
2.4 发酵过程中总酸含量的变化
由图4可知,3组样品的总酸含量总体呈上升趋势,在发酵过程中,自然发酵组的总酸含量始终高于其他两组,且变化速度最快,这是由于在自然发酵的初期,罐内大量繁殖乳酸菌,代谢产生乳酸等导致体系中总酸含量上升;接种米曲霉组总酸含量变化速度缓慢,可能是由于该体系内总酸的生成量和参与酯化等反应的消耗量相差不大[15]。

图4 发酵过程中总酸含量的变化Fig.4 Change of total acid content during fermentation
2.5 发酵过程中pH值的变化
由图5可知,3组豆酱的pH均先下降,在13 d时稍有升高,自然发酵组的pH始终最低,变化趋势与图4总酸含量的变化呈现负相关,发酵前期乳酸菌大量繁殖,分解糖产生乳酸,导致豆酱总酸含量上升,pH下降。发酵后期pH稍有增大,是由于随着发酵的进行,体系中的微生物逐渐衰亡,代谢能力减弱;代谢产生的酸类物质几乎被酯化反应等消耗[16]。
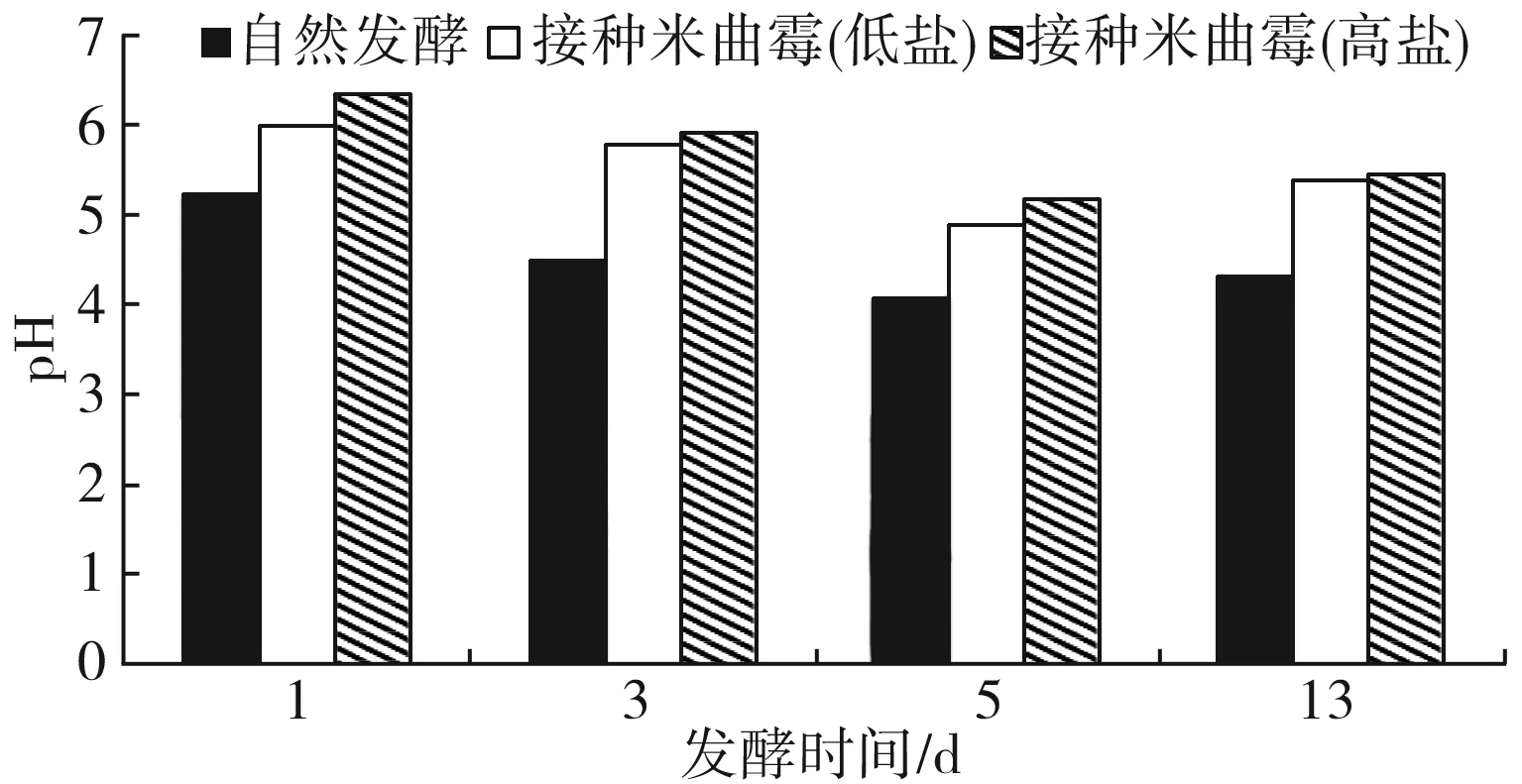
图5 发酵过程中pH值的变化Fig.5 Change of pH value during fermentation
2.6 挥发性风味化合物分析
由表1可知,从豆酱中共检出31种风味物质,其中低盐接种米曲霉组共检出28种风味物质:7种醇类物质,6种酯类物质,3种酮类物质,2种酚类物质以及10种其他化合物;高盐接种米曲霉组共检出18种风味物质:6种醇类物质,2种酯类物质,3种酮类物质,2种酚类物质以及5种其他化合物。醇类物质主要是氨基酸代谢的产物[17]。低盐接种米曲霉组中检测出了高盐组所没有的2,3-丁二醇、异戊醇,在豆酱中起呈味、助香作用,是风味物质的重要组成[18]。酯类主要由醇和酸反应形成,两组样品中酯类化合物的差异较大,低盐接种组中的酯类物质更为丰富,而高盐组只检测出2种,酯类化合物是酱香气成分的主体,使酱具有香甜浓郁的味道,增加回味感[19]。低盐豆酱中检测到的十六酸乙酯赋予了豆酱奶油香气和酯香,乙酸乙酯和异戊酸乙酯赋予了豆酱果香和花香[20]。两组样品中检测出来的酮类物质和酚类物质均相同,均为3种酮类物质,2种酚类物质。低盐豆酱中其他种类的挥发性物质种类较多,其中吡嗪类物质是脂肪氧化产物参与美拉德反应的产物,主要呈现肉香味和烤香味,是酱类的特征性风味物质[21]。

图6 低盐苦荞豆酱挥发性成分的气相色谱-质谱总离子流图Fig.6 GC-MS total ion current chromatogram of volatile components of low-salt Tartary buckwheat soybean paste

图7 高盐苦荞豆酱挥发性成分的气相色谱-质谱总离子流图Fig.7 GC-MS total ion current chromatogram of volatile components of high-salt Tartary buckwheat soybean paste

表1 不同样品的挥发性成分Table 1 Volatile components of different samples

续 表
3 结论
在制曲阶段,自然发酵组蛋白酶活力呈上升趋势,而接种米曲霉组蛋白酶活力呈现先上升后下降的趋势,在制曲前60 h内,接种米曲霉组的蛋白酶活性高于自然发酵组,接种组在制曲60 h时蛋白酶活力最高,为1 686 U/g干基;在60 h后,接种组蛋白酶活力下降,而自然发酵组酶活力依然呈上升趋势。在酱醪发酵阶段,各组氨基酸态氮和总酸含量都呈上升趋势,接种米曲霉组(低盐和高盐组)氨基酸态氮含量始终高于自然发酵组,在发酵第13 d时,低盐接种组氨基酸态氮含量最高,为1.35 g/100 g,接近自然发酵组的2倍。低盐豆酱组共鉴定出28种挥发性物质,而高盐豆酱则只检出18种挥发性物质,其中低盐豆酱中独有的2,3-丁二醇、十六酸乙酯等赋予了低盐豆酱独特的风味,综合理化特性和挥发性风味物质分析,低盐接种的苦荞豆酱的品质优于高盐接种的苦荞豆酱。
