基于模糊数学评定与响应面法优化毛霉型豆豉制曲工艺
2021-03-23邵良伟邹强张弛松张琼刘达玉
邵良伟,邹强,张弛松,张琼,刘达玉*
(1.四川轻化工大学 生物工程学院,四川 宜宾 644000;2.成都大学 药学与生物工程学院,成都 610106;3.成都市农林科学院,成都 611130)
豆豉以黄豆或黑豆为原料,通过霉菌或细菌等微生物在制曲阶段分泌的酶系物质将大豆中的大豆蛋白
分解,并经制曲到豉曲成熟,然后通过加入食用盐、酒等抑制剂来抑制各类酶的活性,再经不同程度的后发酵而制成[1-2]。通过毛霉制曲生产的毛霉型豆豉具有独特的风味及多种生理活性物质,具有较高的食用价值和一定的药用价值 ,深受广大消费者喜爱[3]。
毛霉型豆豉大多采用毛霉自然制曲工艺生产,通过毛霉菌在制曲过程中分泌大量的酶,如蛋白酶、纤维素酶等酶系物质[4-5],使得豆豉后发酵过程在多种酶系作用下将高蛋白大豆水解为小分子多肽和氨基酸等功能和风味营养物质[6]。但由于参与制曲的毛霉不耐高温,受季节制约不能常年生产,且制曲时间一般在20 d左右,后发酵所需时间少则几个月,多则长达数年之久,同时豉曲质量因受当时生产环境和温湿度情况影响而参差不齐,严重制约了企业的发展。据研究报道[7-8],豆豉产品品质在很大程度上由制曲工艺决定,因此在生产中控制制曲环节尤为重要。目前对毛霉型豆豉发酵工艺的研究较多,但对于具有地域特色的传统毛霉型豆豉的发酵工艺,特别是制曲工艺的报道较少。
豉曲中蛋白酶、纤维素酶等酶活性决定了蛋白质、粗纤维等物质的降解速率,从而影响豉曲的成熟时间,同时,还会影响豆豉的品质[9]。本研究对毛霉型豆豉传统自然制曲工艺进行了优化,在单因素试验的基础上,通过Box-Benhnken的中心组合试验设计原理,测定豉曲中总蛋白酶活力和纤维素酶活力等指标,利用模糊数学评定方法确定豉曲相关指标权重并得出综合评分,以综合评分为响应面值,对在制曲过程中影响豉曲质量的主要因素菌粉接种量、制曲温度、制曲时间、相对湿度等进行优化,并对试验结果进行了验证。
1 材料和方法
1.1 材料
黄豆:购于成都好乐购超市;毛霉菌种:通过从潼川豆豉产地采集传统自然制曲阶段分离筛选得到的毛霉菌,并制成直投式发酵菌剂。
1.2 试剂
L-酪氨酸(分析纯):国药集团化学试剂有限公司;干酪素(生物试剂):北京奥博星生物技术有限责任公司;福林酚、三氯乙酸、无水碳酸钠、盐酸、无水磷酸二氢钠、无水磷酸氢二钠、氢氧化钠、冰乙酸、三水碳酸钠、葡萄糖、羧甲基纤维素钠、3,5-二硝基水杨酸(3,5-dinitrosalicylic acid, DNS)、四水酒石酸钾钠、苯酚、无水亚硫酸钠:均为分析纯,成都市科隆化学品有限公司。
1.3 主要仪器与设备
Biotek Synergy HTX多功能酶标仪 美国伯腾仪器有限公司;SH-020恒温恒湿试验箱 上海上器集团试验设备有限公司;pH计量仪 上海仪电科学仪器股份有限公司;电子天平 上海佑科仪器仪表有限公司;XW-80A涡旋振荡器 海门市其林贝尔仪器制造有限公司;SW-CJ-2D超净工作台 苏州净化设备有限公司。
1.4 方法
1.4.1 蛋白酶活力测定[10]
配制浓度分别为0,20,40,60,80 μg/mL的酪氨酸溶液,以酪氨酸浓度为横坐标,吸光度为纵坐标,绘制酪氨酸标准曲线,回归方程为:y=0.9854x-0.014,相关系数R2=0.9991。参照SB/T 10317-1999中的Folin-酚试剂法对样液进行酸性、中性、碱性蛋白酶活力的测定。根据酪氨酸标准曲线计算出蛋白酶活力。将在40 ℃下每1 min水解酪蛋白产生1 μg酪氨酸定义为1个蛋白酶活力单位。
1.4.2 纤维素酶活力测定[11]
以乙酸-乙酸钠缓冲溶液为标准空白样,配制0.10~0.70 mg/mL葡萄糖标准溶液,以葡萄糖浓度为纵坐标,吸光度为横坐标,绘制葡萄糖标准曲线,回归方程为:y=1.8285x+0.0122,相关系数R2=0.9992。参照NY/T 912-2004中的分光光度法对豉曲样液进行纤维素酶活力的测定,根据葡萄糖标准曲线计算出纤维素酶活力。
1.4.3 单因素试验
以蛋白酶活力和纤维素酶活力为指标,采用单因素试验研究菌粉接种量、制曲温度、制曲时间以及制曲相对湿度对制曲的影响,试验水平分别选取菌粉接种量0.05%、0.1%、0.15%、0.2%、0.25%、0.3%;制曲温度13,15,17,19,21,23 ℃;制曲时间3,4,5,6,7,8 d;制曲相对湿度75%、80%、85%、90%、95%。对制曲条件进行初步优化,确定较佳因素试验参数范围,每个处理重复3 次,结果取平均值。
1.4.4 响应面优化试验
根据Box-Benhnken中心组合设计原则,在单因素试验的基础上,以菌粉接种量、制曲温度、制曲时间、相对湿度为自变量,以总蛋白酶活力和纤维素酶活力为指标,以模糊数学评定方法得到的豉曲质量综合评分为响应值,进行4因素3水平的响应面分析,试验因素水平见表1。

表1 响应面试验因素和水平Table 1 The factors and levels of response surface test
1.4.5 豉曲品质的模糊综合评价
设待评价的试验组别集为X=(x1,x2,…,x29),影响豉曲质量的因素集为U=(u1,u2),其中,u1表示总蛋白酶活力;u2表示纤维素酶活力。对于组别xi∈X,按第j个因素uj∈U进行测度,得到xi条件下关于因素uj的数据xij,从而构成模糊数学中的信息矩阵A=(xij)29×2。
由于本试验中测得的数据大于1,但应用模糊数学方法在确定权重以及进行评价时要求隶属度(试验数据)介于0~1之间。故本文对试验数据进行如下的规范化处理,给出文献的处理方法如下:
式中:xijmax表示在影响因素uj下xij(i=1,2,…,29)中最大的值;rj表示在影响因素uj下rij(i=1,2,…,29)中最大的值。
下面给出文献[12]确定权重集的方法如下:
式中:ωj(j=1,2)表示因素uj的属性权重,且Σωj=1(j=1,2),d2(rij-rj),表示各组数据与最大值的差的平方。
综上可得关于豉曲质量模糊评定综合评分[13]:
2 结果与分析
2.1 单因素试验结果
2.1.1 菌粉接种量考察结果
菌粉接种量直接影响豆豉制曲的周期。菌粉接种量若控制恰当,可在一定程度上缩短制曲周期,减少杂菌污染;菌粉接种量过大,易造成微生物种间竞争而不利于发酵产酶,同时制曲微生物的大量繁殖,将产生大量热量而使曲料温度升高,严重时会导致“烧曲”现象[14];而接种量过小,则菌体细胞生长繁殖不足,未能充分利用豉曲中的营养物质,酶活力也会降低,同时将影响豉曲品质,对后发酵及豆豉成品质量产生影响。选定制曲温度为15 ℃,制曲相对湿度为85%,制曲时间为6 d,以不同的菌粉接种量制备豉曲,考察菌粉接种量对豉曲质量的影响,结果见图1。

图1 菌粉接种量对蛋白酶活力和纤维素酶活力的影响
由图1可知,总蛋白酶活力和纤维素酶活力随着菌粉接种量的增加也随之增大,达到最大值时的菌粉接种量分别为0.20%、0.15%,相对应的酶活力分别为306.171,1.282 U/g;但随着菌粉接种量的持续增加,酶活力均呈逐渐减少趋势。这是由于接种量过大时,毛霉菌生长繁殖旺盛,有限的营养物质难以维持毛霉菌生长繁殖,会形成大量休眠孢子,从而降低酶活力[15]。因此,控制菌粉接种量为0.15%~0.20%。
2.1.2 制曲温度考察结果
制曲温度将影响制曲微生物的生长繁殖,根据相关文献报道以及潼川豆豉技艺传人经验,传统毛霉型豆豉制曲微生物毛霉菌一般最适生长温度在15 ℃左右[16]。本试验以菌粉接种量为0.20%,制曲相对湿度为85%,制曲时间为6 d,以不同的制曲温度制备豉曲,考察制曲温度对豉曲质量的影响,结果见图2。
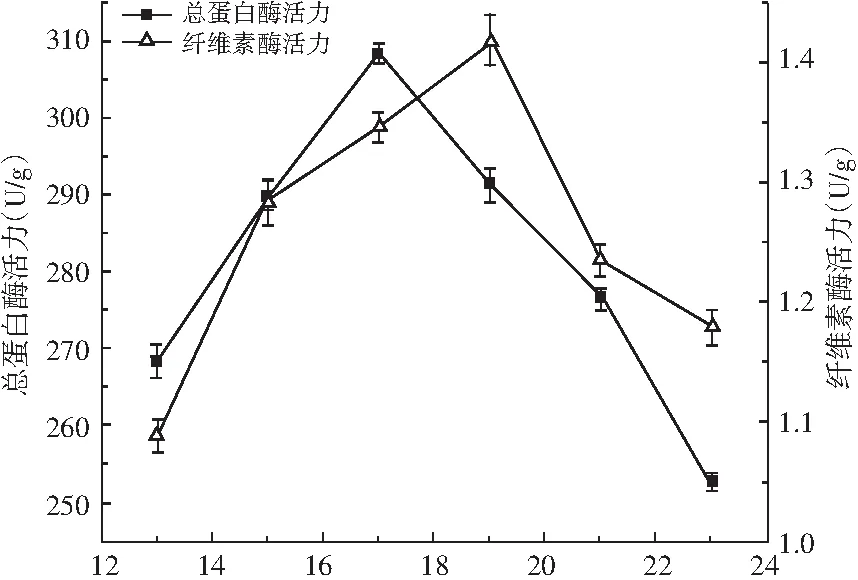
图2 制曲温度对蛋白酶活力和纤维素酶活力的影响
由图2可知,在制曲温度为13~17 ℃时,总蛋白酶活力随着制曲温度的增加而增大;制曲温度为17 ℃时,总蛋白酶活力达到最大值,之后随着制曲温度的增加,酶活力呈减小趋势。在制曲温度为13~19 ℃时,纤维素酶活力随着制曲温度的增加而增大,但制曲温度超过19 ℃后,纤维素酶活力呈降低趋势。因此,应控制制曲温度在17~19 ℃之间。
2.1.3 制曲时间考察结果
制曲时间的长短对豆豉制曲微生物的生长有极其 重要的影响。制曲时间过短,微生物对原料的分解利用率不足,导致毛霉菌分泌酶系不足、酶活力很低,同时也造成原料的浪费。而制曲时间过长,大部分菌丝老化,菌丝生长代谢减弱,使得酶活力降低[17]。本试验以菌粉接种量为0.20%,制曲温度为17 ℃,制曲相对湿度为85%,以不同的制曲时间制备豉曲,考察制曲时间对豉曲质量的影响,结果见图3。
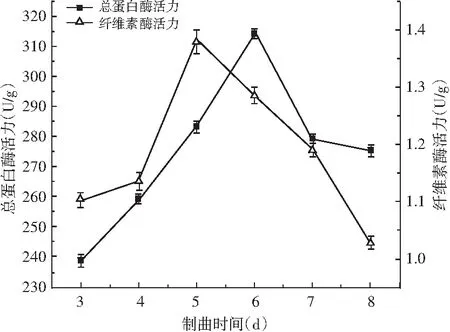
图3 制曲时间对蛋白酶活力和纤维素酶活力的影响
由图3可知,随着制曲时间的增加,总蛋白酶活力和纤维素酶活力也随之增大,达到最大值时的制曲时间分别为6,5 d,之后随着制曲时间的增加,总蛋白酶活力和纤维素酶活力呈降低趋势。因此,控制制曲时间为5~6 d。
2.1.4 制曲相对湿度考察结果
在制曲过程中,由传统毛霉型豆豉的生产工艺为通风制曲,曲料水分极易挥发[18]。因此,保持制曲环境的湿度,有利于制曲微生物的生长和酶系物质的分泌。本试验以菌粉接种量为0.20%,制曲温度为17 ℃,制曲时间为6 d,以不同的制曲相对湿度制备豉曲,考察制曲相对湿度对豉曲质量的影响,结果见图4。
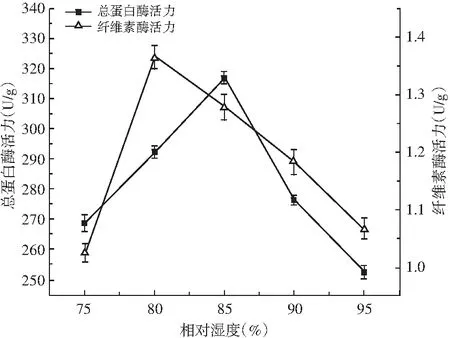
图4 相对湿度对蛋白酶活力和纤维素酶活力的影响
由图4可知,随着制曲相对湿度的增加,在相对湿度从75%增加到85%时,总蛋白酶活力增大到最大值317.212 U/g,但再增加制曲相对湿度,总蛋白酶活力逐渐减小。纤维素酶活力随着制曲相对湿度的增加,在相对湿度达到80%时即达到最大值1.386 U/g,之后再增加相对湿度,酶活力也表现出下降趋势。因此选择制曲相对湿度80%~85%用于后续试验。
2.2 响应面法优化试验设计及结果分析
在单因素试验基础上,以总蛋白酶活力和纤维素酶活力为指标,采用Design-Expert 8.0.6 软件Box-Benhnken法进行试验设计,确定豉曲制备最佳制曲工艺参数,试验设计及结果见表2。

表2 响应面试验设计及结果Table 2 The response surface experimental design and results
对表2中试验数据进行二次多项回归拟合,获得豉曲质量指标(总蛋白酶活力和纤维素酶活力)的综合评分对菌粉接种量(A)、制曲温度(B)、制曲时间(C)、相对湿度(D)的多元回归方程为:
Y=97.29+1.61A+1.48B+1.02C+2.51D+1.02AB-0.73AC+2.28AD+1.15BC+1.51BD-0.40CD-7.62A2-8.19B2-5.04C2-8.63D2。
该模型方差分析结果见表3。

表3 回归模型方差分析Table 3 Analysis of variance for the regression model
由表3可知,对豉曲质量综合评分回归模型P<0.0001,极具显著性,而失拟项P=0.2036>0.05,不显著。此外,该回归模型相关系数R2=0.9870,RAdj2=0.9739,表明该模型拟合程度良好,可用来分析响应值与因素值的关系及变化情况。试验中的菌粉接种量(A)、制曲温度(B)、制曲时间(C)、相对湿度(D)对模型的曲面影响皆为极显著(P<0.01),且由F值可知,4个因素对豉曲质量综合评分的影响次序为:相对湿度>菌粉接种量>制曲温度>制曲时间。在二次项中,A2、B2、C2、D2均为极显著(P<0.01),而在对综合评分的交互影响方面,AB、AC、CD的交互作用不显著(P>0.05),AD的交互作用极显著(P<0.01),BC、BD的交互作用显著(P<0.05)。
菌粉接种量和相对湿度、制曲温度和制曲时间、制曲温度和相对湿度这3组因素间有交互作用,对其进行响应面分析,探究它们之间的具体交互规律。对回归模型获得的响应曲面图和等高线图见图5~图7。

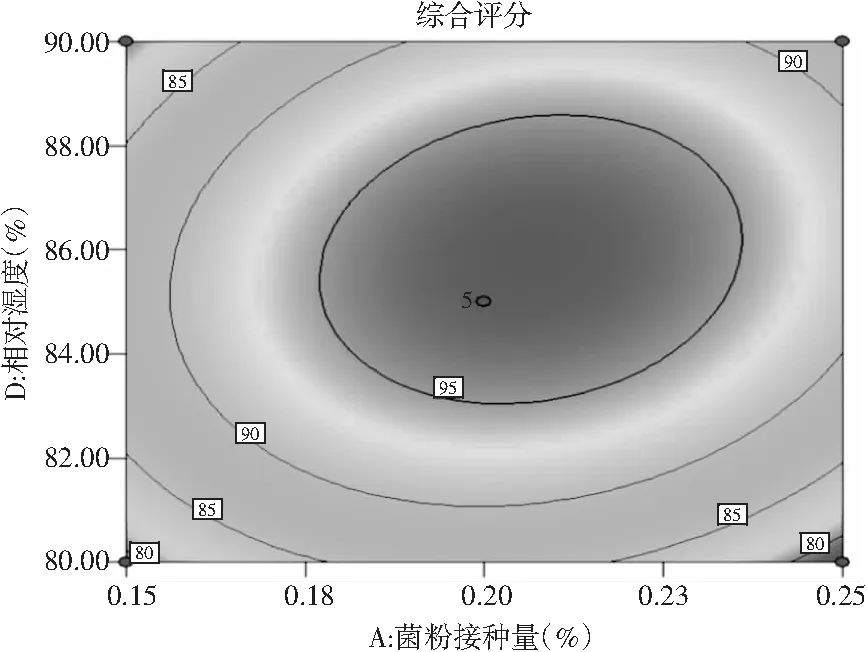
图5 菌粉接种量和相对湿度对综合评分影响的响应面及等高线Fig.5 Response surface and contour of the effects of inoculum size and relative humidity on comprehensive score

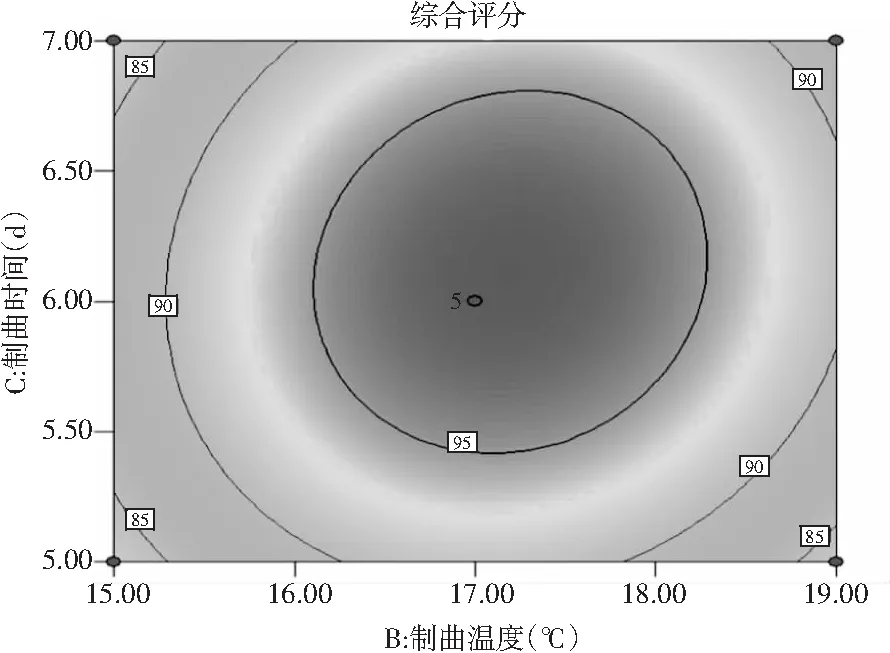
图6 制曲温度和制曲时间对综合评分影响的响应面及等高线Fig.6 Response surface and contour of the effects of koji-making temperature and time on comprehensive score


图7 制曲温度和相对湿度对综合评分影响的响应面及等高线Fig.7 Response surface and contour of the effects of koji-making temperature and relative humidity on comprehensive score
由图5~图7可知,4个响应因素在相对应的试验范围内都有响应极值,且3组因素的交互作用结果与方差分析结果一致。通过对各响应因素交互作用对综合评分影响的响应面及等高线图分析,并结合软件计算回归模型可以预测出当菌粉接种量(A)为0.21%、制曲温度(B)为17.24 ℃、制曲时间(C)为6.10 d、制曲相对湿度(D)为85.86%时,豉曲质量综合评分可达到97.753。
2.3 最佳工艺条件试验验证
为验证回归模型的预测值与试验真实值之间的拟合程度,采用豉曲质量指标综合评分最大值对响应因素进行验证。考虑试验的可操作性,将响应因素选定为菌粉接种量0.21%、制曲温度17 ℃、发酵时间6 d、制曲相对湿度86%, 其他条件不变,进行3组平行试验,按模糊数学评定方法得出豉曲质量指标综合评分平均值为97.187,此试验值与回归模型豉曲质量指标综合评分预测值(97.753)相对误差为0.57%,此时所得的蛋白酶活力和纤维素酶活力平均值分别为312.611,1.402 U/g。因此,通过模糊数学评定和响应面法优化得到的制曲最佳工艺条件的回归模型是符合实际,对今后制曲工艺参数的选择具有一定的指导意义。
3 结论
通过单因素试验并结合模糊数学评定方法对豉曲质量指标进行综合评分,以综合评分为响应值进行响应面优化试验,结果表明:菌粉接种量、制曲温度、制曲时间、相对湿度对制曲过程中毛霉菌产蛋白酶活力和纤维素酶活力均有极显著影响,且显著顺序为:相对湿度>菌粉接种量>制曲温度>制曲时间。同时,菌粉接种量和相对湿度、制曲温度和制曲时间、制曲温度和相对湿度这3组因素间交互作用显著。得出最优制曲条件:菌粉接种量为0.21%,制曲温度为17 ℃,发酵时间为6 d,制曲相对湿度为86%,在此条件下豉曲质量指标综合评分达到97.187。同时,本试验建立的回归模型是有效可行的,可以用来预测设定试验因素条件下的毛霉型豆豉制曲工艺参数的响应值。研究结果可为传统毛霉型豆豉制曲工艺的工业化应用提供参数借鉴。
