糖基化对小米醇溶蛋白结构和消化性影响
2023-02-14张玉静黄凌立郭峻
张玉静,黄凌立,郭峻
(省部共建食品营养与安全国家重点实验室,天津市食品质量与健康重点实验室,天津科技大学 食品科学与工程学院,天津 300457)
小米是世界多个国家(如印度、中国)和非洲部分地区种植食用的主食农作物,是我国最具代表性的谷物之一,已有8 000多年种植历史[1]。小米含有多种营养成分(维生素A、维生素B1和维生素B12),营养均衡,消化率高,且具有各种生理作用,如抗氧化、抗炎、抗癌和抗菌作用[2]。小米蛋白是优质植物蛋白质的重要来源,其蛋白质含量达到9.00%~13.99%[3],而且具有低敏性[4],因此适合大多数人食用。醇溶蛋白是小米蛋白的储藏蛋白,也是含量最高的一种蛋白组分,大约占46%[5],其结构类型及在不同加工条件下的变化会对小米蛋白的理化和消化特性起重要影响作用。
热加工(蒸煮、挤压、焙烤)是谷物常用的加工方式,有研究表明热加工可以影响蛋白结构。郭莲东[6]研究表明挤压使小米醇溶蛋白发生聚集和融合,三级结构发生较大变化。此外,热加工对蛋白的消化性也有影响。Gulati等[7]研究发现高压和长时间加热会导致消化率降低,但小米蛋白在蔗糖溶液和NaCl溶液中加热可有效减缓胃消化阶段消化率的降低;范冬雪等[8]研究发现小米醇溶蛋白经蒸煮及挤压处理后体外消化率比未处理的蛋白都有所降低。糖基化作为食品加工常用方式也受到广泛关注。有研究表明糖基化处理可改变蛋白的结构,且对蛋白溶解性、乳化性等功能特性有不同程度的改善。李灵诚[9]以大米蛋白为原料与木糖进行水热糖基化反应改善了大米蛋白质的溶解性。木糖和大豆分离蛋白经过美拉德反应的复合物结构松散,进而提高了大豆分离蛋白的溶解性[10]。但是,谷物蛋白糖基化的大多研究集中于结构及理化特性等方面的变化,对谷物蛋白质的消化特性以及蛋白结构与消化性的相关因素研究较少。
本文通过研究热处理糖基化对小米醇溶蛋白的Amadori产物、游离精氨酸侧链、二级结构、二硫键、内源荧光等结构特性及消化特性的变化,阐明单独热加工及糖基化修饰对小米醇溶蛋白的结构和消化性的影响,分析结构变化与消化性的相关机制,为小米制品加工条件的选择提供理论依据。
1 材料与方法
1.1 材料与试剂
小米(晋谷21号):产自山西省;胃蛋白酶(酶活力2 500 U/mg)、胰蛋白酶(酶活力 1 500 U/mg)、糜蛋白酶(酶活力40 U/mg)标准品:美国Sigma公司;二硫苏糖醇(dithiothreitol,DTT,分析纯):美国 Thermo公司;十二烷基磺酸钠(sodium dodecyl sulfate,SDS,分析纯):美国Bio-rad公司。
1.2 仪器与设备
傅里叶红外光谱仪(Tensor 27):德国布鲁克公司;荧光分光光度计(Lumina):美国赛默飞科技公司;手持匀浆机(A8):上海欧河机械设备有限公司;全功能微孔板检测酶标仪(Infinite 200PRO):奥地利TECAN有限公司。
1.3 方法
1.3.1 小米醇溶蛋白的提取
从小米中提取醇溶蛋白参考姬中伟等[11]的方法并作部分修改。将小米破碎后,过80目筛分离残渣,得到粗制小米粉。按照0.05g/mL的浓度配制小米粉-正己烷溶液,在室温下搅拌2h~3 h后,放在通风橱中挥发过夜,以去除小米粉中的脂肪。脱脂后,按照0.1g/mL的浓度制备小米粉水溶液,45℃水浴搅拌2h,于8000r/min离心20min;所得沉淀用3%氯化钠溶液稀释至0.0125g/mL,45℃水浴搅拌2 h,于8 000 r/min离心20 min;将所得沉淀用水稀释至0.1 g/mL,在室温下搅拌2 h以去除氯化钠,然后将其在8 000 r/min离心20 min;所得沉淀用70%乙醇溶液稀释至0.012 5 g/mL,并在40℃水浴搅拌2.5 h后6 000 r/min离心10 min,收集上清液。向上清液中缓慢加入4℃氯化钠溶液,使体积达到原上清液的3倍(氯化钠溶液的最终浓度为0.3 g/100 g),4℃静置1 d后,将沉淀在4℃透析2 d~3 d,将透析好的沉淀物冻干成粉末,得到小米醇溶蛋白备用。以上破碎及提取步骤均重复操作3次。
1.3.2 D-木糖与小米醇溶蛋白糖基化反应
称取100.0 mg天然小米醇溶蛋白,置于100 mL超纯水中,用手持高速匀浆机分散15 s,使小米醇溶蛋白在水中均匀地分散,形成相对稳定的悬浮液。按蛋白与糖质量比1:5向其中加入D-木糖,混匀后,将上述悬浮液分别装在12 mL的哈希管中。将哈希管置于干浴器中分别在 100、120、140、160、180 ℃ 5 种温度下反应25 min(以未经处理的天然小米醇溶蛋白作为对照)。将D-木糖修饰的小米醇溶蛋白(D-小米醇溶蛋白)和单独加热的小米醇溶蛋白(H-小米醇溶蛋白)装于透析袋中,在4℃去离子水中透析以去除没有参与反应的小分子物质,将透析后的小米醇溶蛋白及其反应产物冻干备用。
1.3.3 Amadori产物含量的测定
参照牛治燕[12]的方法稍作修改,用pH7.0磷酸钠缓冲溶液(10 mmol/L)将蛋白样品稀释至1 mg/mL,将含有0.25 mmol/L硝基四唑氮蓝(tetranitroblue tetrazolium chloride,NBT)的碳酸盐缓冲溶液(100 mmol/L,pH10.8)按1:10(蛋白质:硝基四唑氮蓝,体积比)的比例添加到试管中。二者混合均匀后在37℃反应45min,待反应完全后使用多功能酶标仪测定其在525 nm下的吸光度(A525),同时测定磷酸钠缓冲溶液的吸光度作为空白值。所有样品均重复测定3次。Amadori产物含量(nmol/mL)的计算公式如下:

1.3.4 傅里叶红外光谱分析
应用傅里叶红外光谱(Fourier transform infrared spectroscopy,FT-IR)分析样品的二级结构变化。称取1 mg样品和150 mg溴化钾颗粒同时放在研钵里研磨至贴壁,把制好的压片放入红外光谱仪中进行扫描。单独的溴化钾扫描光谱作为背景,扫描波段为4 000 cm-1~400 cm-1,分辨率为4 cm-1,背景和样品的扫描次数均为32。用OMNIC 8.0数据处理软件对采集的红外图谱进行处理,通过计算得到二级结构含量[13]。
1.3.5 游离巯基和二硫键含量测定
参考Hong等[14]的方法测定样品游离巯基(sulfhydryl,SH)和二硫键(disulfide bond,SS)含量。游离巯基的测定:用含有8mol/L尿素的Tris-甘氨酸缓冲液制备2 mg/mL的蛋白样品,室温反应1 h。再用Tris-甘氨酸缓冲溶液稀释20倍。随后取1 mL上述样品与10 μL Ellman试剂反应25 min,以不添加样品的缓冲液作为对照,在412 nm处测定吸光度。总巯基的测定:用含有8 mol/L尿素的Tris-甘氨酸缓冲液制备0.5 mg/mL的蛋白样品,用含有β-巯基乙醇的Tris-甘氨酸缓冲液将样品溶液稀释5倍,室温反应1 h。向混合物中加入10 mL 12%的三氯乙酸,静置1 h后6 000 r/min离心15 min。将离心后沉淀复溶于2 mL含有8 mol/L尿素的Tris-甘氨酸缓冲溶液中,室温反应。按上述游离巯基测定方法测定其吸光度。游离巯基和二硫键含量计算公式如下。

式中:A412为412 nm处的吸光度;C为小米醇溶蛋白浓度,mg/mL,D为稀释倍数;SHtotal为总巯基含量;SHfree为游离巯基含量。
1.3.6 内源荧光性的测定
参照Mir等[15]的方法测定样品的内源荧光性。用pH7.0的磷酸盐缓冲溶液制备1 mg/mL蛋白样品,在激发波长295 nm,发射波长320 nm~550 nm范围内记录发射光谱。将天然小米醇溶蛋白作为对照,将单独的磷酸盐缓冲溶液用来测量背景荧光。
1.3.7 表面疏水性的测定
小米醇溶蛋白的表面疏水性测定参考Alizadeh-Pasdar等[16]的方法,采用1-苯胺基-8-萘磺酸(1-anilino-naphthalene-8-sulfonate,ANS) 作为荧光探针。 用10 mmol/L,pH7.0的磷酸盐缓冲溶液制备5个浓度梯度(分别为 0.019、0.038、0.076、0.150、0.300 mg/mL)的样品溶液。取制备好的样品向其中加入20 μL 8 mmol/L的ANS溶液,混合均匀后室温避光反应15 min。使用荧光分光光光度计在激发波长和发射波长分别为390 nm和470 nm的条件下对样品进行比色,测量样品荧光强度。用线性关系良好的回归曲线的初始斜率来评价表面疏水性(H0)。
1.3.8 消化率的测定
根据Wen等[17]的方法测定蛋白样品的消化率,按10 mg小米醇溶蛋白的质量计算,以确保消化的初始底物含量一致。
模拟胃消化反应:称好的样品加入7 mL模拟胃液,混合均匀后,在振荡培养箱中37℃,100 r/min消化1 h后,向其中加入1 mol/L NaHCO3终止胃消化反应。
模拟肠消化反应:按照胃消化反应的步骤消化后,向胃消化产物中加入1 mL肠液,混合均匀后加入100 μL胰蛋白酶和胰凝乳蛋白酶的混合溶液。在振荡培养箱中继续消化2 h。消化结束后在沸水浴中加热灭活酶。将消化后的样品离心,取上清液,用于后续消化率的测定。
采用邻苯二甲醛(O-phthalaldehyae,OPA)试剂法测定游离氨基含量。将消化后的上清液用碳酸钠溶液稀释20倍,然后再按照1:1(体积比)的比例与OPA试剂(100 mmol/L四硼酸铵,1 mg/mL SDS,0.8 mg/mL邻苯二甲醛和0.05 mg/mL DTT)混合,室温下反应10 min后用多功能酶标仪测定其荧光强度(激发波长340 nm,发射波长425 nm)。在同样的波长下测定不同浓度的色氨酸(0.001、0.005、0.010、0.020、0.050、0.060 mmol/mL)的荧光强度,建立标准曲线(y=0.143 1x+0.167 4)。消化率按以下公式进行计算。

式中:hs是每克蛋白质消化后产生的游离氨基含量,mmol;htotal是当每克蛋白质被完全水解之后所产生的游离氨基的含量,8 mmol。
1.4 数据分析
本试验结果用平均值±标准差表示。采用Spss26软件中邓肯检验进行组间比较及显著性分析,采用Graph-Pad Prism 8进行皮尔逊相关性分析及图形的绘制。
2 结果与分析
2.1 热处理及D-木糖对小米醇溶蛋白结构的影响
2.1.1 热加工对Amadori产物的影响
在食品的热处理过程中,Amadori产物是在美拉德反应的早期阶段产生的初期产物,常用作指示食品热加工程度的标志性指标[18]。小米醇溶蛋白与D-木糖糖基化反应后Amadori产物的含量见表1。

表1 不同加热温度下H-小米醇溶蛋白、D-小米醇溶蛋白Amadori产物的含量变化Table 1 Content of Amadori products of H-millet gliadin and D-millet gliadin heated at different temperatures mol/L
从表1中可以发现,单独加热处理的小米醇溶蛋白无Amadori产物生成,原因是Amadori产物需要在还原糖的羰基端的参与下与蛋白质中的游离氨基发生糖基化反应生成[12];当小米醇溶蛋白与D-木糖在100℃~160℃进行糖基化反应时,Amadori产物的含量从(0.78±0.03)mol/L 显著增加到(1.14±0.07)mol/L(p<0.05)。在热处理温度为140℃~160℃时,D-木糖修饰的小米醇溶蛋白的Amadori产物含量没有显著增加(p>0.05),且在180℃时Amadori产物的含量减少,可能是因为Amadori产物是糖基化反应的一个中间产物,该产物会因为加热温度的升高转化变成其他物质[12]。随着加工温度的升高,Amadori产物含量的变化说明糖基化的反应程度增强。
2.1.2 热加工对小米醇溶蛋白及糖基化产物二级结构的影响
FT-IR光谱中的酰胺Ⅰ带(1 600 cm-1~1 700 cm-1)能够反映蛋白质二级结构的变化。热处理糖基化修饰的小米醇溶蛋白FT-IR光谱图如图1所示。

图1 天然小米醇溶蛋白、H-小米醇溶蛋白和D-小米醇溶蛋白的傅里叶红外光谱图Fig.1 FT-IR spectra of natural millet gliadin,H-millet gliadin and D-millet gliadin
由图1中不同处理组样品的吸收峰的峰型和宽度的变化可以判断出,热处理、糖基化改变了小米醇溶蛋白的二级结构。为分析小米醇溶蛋白二级结构含量的变化,对酰胺I带进行了去卷积二阶导数拟合计算,结果如表2所示。
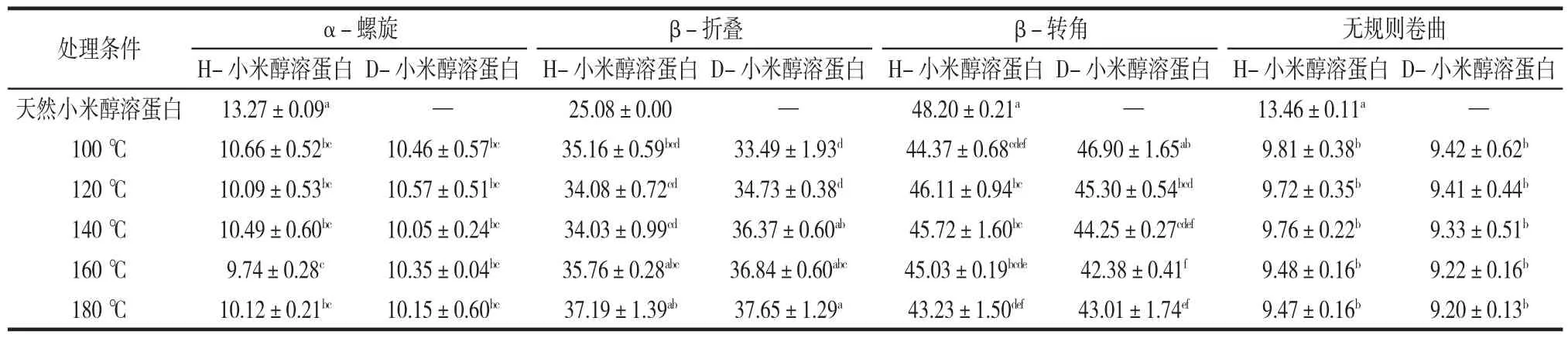
表2 不同加热温度下H-小米醇溶蛋白和D-小米醇溶蛋白二级结构含量的变化Table 2 Content of secondary structural elements in H-millet gliadin and D-millet gliadin heated at different temperatures %
由表2可知,经过单独热处理后小米醇溶蛋白α-螺旋的含量从(13.27±0.09)%降低至(10.12±0.21)%,β-折叠的含量从25.08%显著增加至(37.19±1.39)%(p<0.05),β-转角的含量从(48.20±0.21)%显著降低至(43.23±1.50)%(p<0.05),无规则卷曲从(13.46±0.11)%降低至(9.47±0.16)%。D-木糖糖基化修饰后小米醇溶蛋白 α-螺旋的含量降低至(10.15±0.60)%,β-折叠的含量显著增加至(37.65±1.29)%(p<0.05),β-转角的含量显著降低至(43.01±1.74)%(p<0.05),无规则卷曲的含量降低至(9.20±0.13)%。随热处理温度的升高,无规则卷曲和β-转角的含量降低,β-折叠增加。这意味着蛋白质刚性的增加,柔韧性降低[19]。以上结果说明,加热和D-木糖都能使小米醇溶蛋白产生紧密的二级结构。在热处理过程中,D-木糖促使小米醇溶蛋白的β-折叠含量增加,从而引起分子间发生聚集,最终形成更加有序的结构。
2.1.3 游离巯基及二硫键含量的变化
图2为天然小米醇溶蛋白、H-小米醇溶蛋白和D-小米醇溶蛋白的游离巯基和二硫键的含量。

图2 不同加热温度下H-小米醇溶蛋白和D-小米醇溶蛋白游离巯基含量和二硫键含量的变化Fig.2 Content of free sulfhydryl and disulfide bond of H-millet gliadin and D-millet gliadin heated at different temperatures
由图2可知,天然小米醇溶蛋白的游离巯基含量为(4.52±0.04)μmol/g,二硫键含量为(4.43±0.02)μmol/g。加热温度从100℃升高到180℃,H-小米醇溶蛋白的游离巯基含量从(4.27±0.02)μmol/g显著降低至(3.00±0.08)μmol/g(p<0.05),而二硫键的含量从(4.43±0.02)μmol/g显著增加至(8.78±0.04)μmol/g(p<0.05)。 这说明热处理倾向于通过形成二硫键来聚合小米醇溶蛋白。Wang等[19]发现水浴加热可以引起藜麦蛋白疏水残基的暴露,诱导蛋白质中二硫键的形成。当小米醇溶蛋白被加热到较高温度时,由于游离巯基被氧化成二硫键,小米醇溶蛋白迅速聚集形成三维网状结构,这一结果与热处理过程中丙酮醛对麦谷蛋白修饰的结果一致[20]。上述二级结构也表明加热引起小米醇溶蛋白结构更加紧密,因此,二硫键是小米醇溶蛋白进一步聚合的关键因素。
随着加热温度的升高,D-小米醇溶蛋白的游离巯基含量逐步降低,二硫键含量逐渐增加,且在同一加热温度下游离巯基含量显著低于H-小米醇溶蛋白(p<0.05),超过100℃后在相同温度下D-小米醇溶蛋白二硫键含量显著高于H-小米醇溶蛋白(p<0.05)。可能是在D-木糖存在的情况下,D-木糖与游离巯基反应以促进稳定加合物的形成[21-22]。另外,蛋白质氧化可能会引起游离巯基与二硫键之间交换反应的失衡,进一步引起游离巯基在不同氧化水平下生成不可逆产物(亚磺酸和磺酸)或可逆产物(二硫和亚磺酸)[22]。另外,再次生成的游离巯基也能够参与到氧化反应或巯基/二硫键的交换反应,进而使小米醇溶蛋白中有更多的分子间二硫键产生[20]。
2.1.4 内源荧光性的变化
蛋白质的内源荧光主要由色氨酸和酪氨酸产生,它们的荧光性质很容易受溶剂极性的影响,发射光谱受这两种氨基酸所处的微环境影响很大[23]。蛋白内源荧光性的变化可以体现蛋白结构的变化,因此,本试验对天然小米醇溶蛋白、H-小米醇溶蛋白和D-小米醇溶蛋白的内源荧光发射光谱进行测定,结果见图3。

图3 不同热处理温度下天然小米醇溶蛋白、H-小米醇溶蛋白和D-小米醇溶蛋白的内源荧光光谱Fig.3 Fluorescence intensity of natural millet gliadin,H-millet gliadin,and D-millet gliadin heated at different temperatures
图3(a)结果表明,加热至120℃后,随着加热温度的升高,H-小米醇溶蛋白样品的荧光强度降低,这一现象可能是因为加热导致小米醇溶蛋白发生一定程度的聚集,分子量变大,从而屏蔽了色氨酸残基[12]。
图3(b)结果表明,通过热处理后D-小米醇溶蛋白的荧光强度降低,这表明蛋白质的空间构象在小米醇溶蛋白和D-木糖发生糖基化反应后发生变化。糖基化导致蛋白质荧光强度降低的原因可能是糖链对色氨酸残基的屏蔽作用[24],或者是D-小米醇溶蛋白中的色氨酸残基被包埋到疏水环境中,相比于天然的小米醇溶蛋白其可能有更多的三级构象。各相同加热温度下,与D-小米醇溶蛋白的最大荧光强度比H-小米醇溶蛋白的最大荧光强度低,表明D-木糖促进了小米醇溶蛋白分子间聚集体的形成从而使结构更加紧凑,因而掩埋了更多的色氨酸残基,这与Wang等[20]的研究结果一致。
2.1.5 表面疏水性的变化
天然小米醇溶蛋白、H-小米醇溶蛋白、D-小米醇溶蛋白的表面疏水性见表3。

表3 不同热处理温度下H-小米醇溶蛋白、D-小米醇溶蛋白的表面疏水性的变化Table 3 Surface hydrophobicity of H-millet gliadin and D-millet gliadin heated at different temperatures
如表3所示,当加热温度为100℃~160℃时,H-小米醇溶蛋白的H0随温度的升高而升高。这是因为热处理使小米醇溶蛋白变性,进而暴露出起初掩埋在蛋白质核心的疏水残基,使其移动到蛋白质表面,进一步导致表面疏水性增加[25]。然而,当加热温度达到180℃时,H-小米醇溶蛋白的疏水性反而下降。这是因为温度过高,小米醇溶蛋白发生热聚集现象,掩盖了小米醇溶蛋白的疏水区,引起与ANS结合的疏水基团含量降低[20]。以上现象说明,热处理温度相对较低时,热处理使小米醇溶蛋白的结构展开,起初隐藏的疏水基团逐渐暴露于表面,在温度过高时,热处理又引发小米醇溶蛋白发生分子内或分子间聚集,最终引起其疏水性下降[20]。
由表3可以看出,温度由100℃升高到180℃,由D-木糖修饰的小米醇溶蛋白的表面疏水性显著降低(p<0.05)。这说明小米醇溶蛋白与D-木糖反应时,小米醇溶蛋白生成聚集体,进而隐藏了小米醇溶蛋白表面的疏水性残基,导致ANS对疏水残基的可及性受到抑制[26]。也可能是由于亲水性的糖在疏水蛋白表面附着,糖的—OH基团的氢键结合能力改变了表面疏水性。经热处理、糖基化的小米醇溶蛋白结构发生变化,引起疏水性的变化,从而改变蛋白酶的酶切位点,进一步使小米醇溶蛋白的消化性发生改变[21]。
2.2 D-木糖修饰小米醇溶蛋白随温度变化的消化率
随热处理温度的改变,天然小米醇溶蛋白、H-小米醇溶蛋白和D-小米醇溶蛋白的胃肠消化率的变化如图4所示。

图4 不同加热温度下H-小米醇溶蛋白和D-小米醇溶蛋白胃消化率和肠消化率的变化Fig.4 Gastric digestibility and intestinal digestibility of the H-millet gliadin and D-millet gliadin heated at different temperatures
由图4(a)可知,当温度从100℃升高到180℃时,H-小米醇溶蛋白和D-小米醇溶蛋白的胃消化率分别从(15.15±0.19)%显著下降至(7.57±0.32)%、(7.70±0.36)%,而且在140℃~160℃,D-小米醇溶蛋白的胃消化率显著低于H-小米醇溶蛋白的胃消化率(p<0.05)。由图4(b)可知,当温度从100℃升高到180℃时,H-小米醇溶蛋白和D-小米醇溶蛋白的肠消化率分别从(13.38±0.10)%显著下降到(7.48±0.04)%、(6.52±0.17)%。
随着热处理温度的升高,H-小米醇溶蛋白的消化率逐渐降低,说明热加工对小米醇溶蛋白的消化率有抑制作用,且随着热处理温度的升高抑制作用逐渐增强。在相同热处理温度下,D-小米醇溶蛋白的消化率始终低于H-小米醇溶蛋白的消化率,这可能是由于D-木糖能够引起蛋白质分子的交联,并通过空间位阻抑制胃蛋白酶和胰蛋白酶对蛋白质的水解[20]。胃蛋白酶催化谷氨酸、色氨酸和酪氨酸等肽键的断裂[27]。已有文献报道含硫氨基酸和色氨酸在还原糖的存在下很容易被消耗[28],这意味着D-木糖对小米醇溶蛋白中氨基酸的修饰改变了胃蛋白酶的切割位点,进而降低了消化率。大多数研究将蛋白质消化率的降低归因于空间组合聚集体的形成。也有研究表明,食物蛋白质的轻微的氧化损伤可能不会影响甚至提高蛋白质的消化率,而严重氧化可能会降低蛋白质对胰蛋白酶的敏感性[29]。严重的蛋白质羰基化往往涉及到剧烈的蛋白质氧化以及交联和聚集体的形成,最终导致消化率受损[28]。因此D-木糖引起的小米醇溶蛋白严重的氧化作用也可能是D-小米醇溶蛋白消化率降低的原因。在热加工中一些蛋白结构的变化是不可逆的,如蛋白质的去折叠,隐藏的疏水基团的暴露以及热诱导的聚合等,这些变化不利于人体的消化吸收,但是有利于蛋白质作为包埋壁材的开发应用,强烈的热处理甚至可能最终导致氨基酸残基的退化和降解[30]。
2.3 结构与消化性之间的相关性
H-小米醇溶蛋白和D-小米醇溶蛋白结构和消化性变化的相关性分析见图5。

图5 H-小米醇溶蛋白和D-小米醇溶蛋白结构和消化性变化的相关性分析Fig.5 Correlation between structure and digestibility of H-gliadin and D-gliadin
图5皮尔逊相关性显示,小米醇溶蛋白消化率与α-螺旋含量呈正相关,而与β-折叠含量呈负相关,这一结果与文献[31]的热处理对大豆蛋白结构与消化率的相关性结果一致,β-折叠含量的增加可能会导致小米醇溶蛋白消化率的降低。此前在不同品种的大豆分离蛋白研究中发现,β-折叠含量与大豆分离蛋白存在负线性相关系数[32]。此外,D-木糖修饰的小米醇溶蛋白的表面疏水性与消化率呈正相关,这是因为D-木糖诱导小米醇溶蛋白发生聚集和交联,屏蔽了识别和反应位点,所以疏水性下降,进而使其消化率下降,该结果在Li等[21]研究的丙二醛对米糠蛋白消化性影响的研究中得到证实。同时,小米醇溶蛋白消化率与二硫键含量呈负相关,小米醇溶蛋白中二硫键的生成会导致蛋白质的空间结构更加紧密,不利于消化酶切割位点的暴露,因此导致小米醇溶蛋白消化性能随着温度的升高而降低,此结果在Wang等[20]研究中得到证实。糖基化加剧了β-折叠、二硫键含量的增加,导致消化性进一步降低。此外,小米醇溶蛋白的消化率与荧光强度呈正相关,这与Wen等[17]结果是一致的。
3 结论
研究表明热处理、糖基化能显著影响小米醇溶蛋白的结构进而影响其消化性。随着热处理温度的升高、糖基化反应的加剧,小米醇溶蛋白β-折叠含量增加、无规则卷曲含量减少,使其二级结构向有序性转变,二硫键含量增加,使其高级结构发生构象变化,从而引起蛋白酶酶切位点的改变,最终导致小米醇溶蛋白消化性的降低。相关性分析表明,小米醇溶蛋白二级结构和二硫键是影响消化性的主要因素。因此,热处理、糖基化不利于小米醇溶蛋白的消化。研究结果为探究热处理、糖基化对小米蛋白结构和营养消化性的影响以及对小米食品的开发加工提供了理论依据。后续将在改善小米蛋白消化性、营养利用率以及糖基化修饰对小米蛋白抗氧化活性的影响方面开展进一步的深入研究。
