CHD2 基因变异相关癫痫临床特点分析
2023-01-31孙素真刘学芳
冯 帆 陈 芳 孙素真 李 鑫 刘学芳 赵 彤
河北省儿童医院神经内一科(河北石家庄 050031)
2021 年Wilson 等[1]报道了一种DNA 结合蛋白,该蛋白同时包含染色结构域和大多数哺乳动物中存在的SWI/SNF解旋酶结构域,他们将其命名为染色质结构域解旋酶DNA 结合蛋白即CHD 蛋白。哺乳动物染色体结构域解旋酶DNA 结合(CHDs)蛋白代表了在哺乳动物发育过程中参与染色质重构和转录调控的9 个蛋白家族即CHD 1-9。所有这些蛋白都有两个结构域和两个解旋酶结构域,但其他特定的功能域可以分为3 组CHDs:I(CHD 1 和CHD 2)、II(CHD 3、CHD 4 和CHD 5)和III(CHD 6、CHD7、CHD8和CHD9)[2]。在CHD蛋白家族成员中,CHD2是唯一一个在人类中被破坏时导致脑功能受限制表型的成员。这表明,CHD 2基因在人类大脑的发育和功能中起着独特的作用[3]。本文分析7 例CHD2基因变异所致癫痫患儿的临床特点及治疗方案,以提高对CHD2基因变异致癫痫的临床认识,为治疗提供参考。
1 对象与方法
1.1 研究对象
收集2018年1月至2020年1月就诊于河北省儿童医院的CHD2基因变异患儿的临床资料。纳入标准:①年龄<16 岁;②符合2014 年ILAE 提出的癫痫的诊断标准[4];③定期随访,且随访时间不少于1年;④临床资料及随访信息完整。排除标准:家长未签署知情同意书。
本研究经河北省儿童医院伦理委员会批准(No.202207),患儿父母均签署知情同意书。
1.2 方法
1.2.1 资料收集 包括患儿起病年龄、性别、发作类型、诱发因素、生长发育情况、临床表现、基因检测结果;辅助检查包括脑电图、MRI、发育测试(包括适应性、大运动、精细运动、语言、个人-社交)及孤独症测试。由患儿完成儿童期孤独症评定量表(CARS),患儿父母完成儿童孤独症家长评定量表(ABC)。CARS 总分≤29.5 分正常,30~36.5 为分轻-中度孤独症,≥37 分重度孤独症;ABC 总分≥31 分为筛查的界限分,≥58 分为诊断的参考分。所有患儿及父母进行基因检测。
1.2.2 病例随访 对患儿进行门诊复诊或通过电话进行随访。随访时间为1~2 年,最后1 次随访为2021年10月。随访内容包括患儿的病情变化;癫痫发作次数、形式、频率、有无诱因、有无持续状态;运动能力(抬头、翻身、独坐、爬行、独走、跳跃、上下楼梯)有无倒退,倒退的年龄;认知能力(逗笑、认人、语言、阅读、计算)有无倒退,倒退的年龄;有无精神行为异常及孤独症样表现;大小便情况;治疗过程;辅助检查(血常规、血生化、影像学、脑电图等)。
2 结果
2.1 一般情况
共纳入7 例CHD 2基因变异相关癫痫患儿,其中男2 例,女5 例;癫痫发作起病中位年龄为3 岁2月(范围8 月~5 岁8 月);患儿母亲孕期及出生史均无异常。7例患儿外观均无异常。患儿有发热性惊厥病史4 例(例1、4、5、6)。见表1。1 例患儿有发热性惊厥家族史(例6 患儿父亲和小姨幼年曾有发热性惊厥病史)。例4 患儿母亲及小姨有幼时抽搐史,现已无抽搐发作,未服药;舅舅及舅舅女儿有癫痫病史(目前已停药,具体不详)。

表1 7例CHD2基因变异癫痫患儿临床信息
2.2 智力、运动及语言发育情况
7例患儿都有程度不等的智力、运动或语言发育障碍,4例患儿运动、智力发育落后于同龄儿而语言发育大致正常,3例患儿语言发育水平程度不等的落后于同龄儿。1例患儿有孤独症倾向,表现为自言自语,很少与人对视,重复语言,与人交流障碍,学习能力差,刻板动作等,CARS评分36分,ABC评分79分。见表2。

表2 7例患儿发育测试结果
2.3 癫痫发作表现
7 例患儿病程中发作类型多样,其中肌阵挛-失张力发作(myoclonic atonic seizures,MAS)1例,痉挛发作(epileptic spasms,ES)1 例,肌阵挛发作(myoclonic seizures,MS)2 例,全面强直阵挛性(generalized tonic-clonic seizures,GTCS)发作5例,局灶性发作(focal seizures,FS)4 例。5 例患儿有多种发作形式(至少2种及以上)。4例患儿癫痫发作与发热相关。3例患儿出现癫痫持续状态(SE,例1、3、6),持续时间分别为 12min、10min和25min。
2.4 辅助检查
7 例患儿头颅MRI 均无特异性改变,视频脑电图均异常。4例患儿视频脑电图过程中监测到与临床发作相对应的图形,2例(例1、4)监测到全面性强直-阵挛发作(图1),2 例(例5、7)监测到肌阵挛-失张力发作(图2)。2 例监测到局灶性放电,以颞区和枕区多见。6 例监测到广泛多棘波、棘波和棘慢波,其中2例脑电图还可见多棘波短程阵发。5例在发作间期视频脑电图监测到异常放电,4例患儿的视频脑电图为背景节律慢。7例患儿在行视频脑电图监测过程中均未见与闪光刺激相关性异常波。
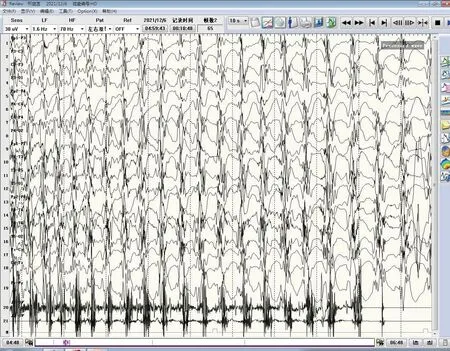
图1 全面性强直-阵挛发作视频脑电图
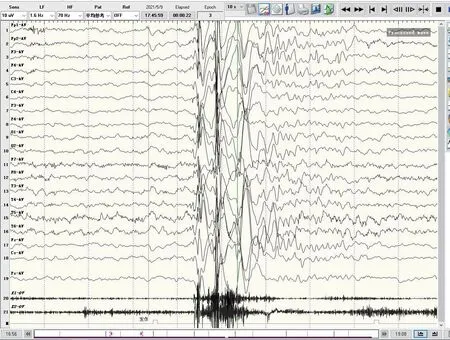
图2 肌阵挛-失张力发作视频脑电图
1 例患儿(例7)在8 月龄起病,发作次数频繁,临床表现为肌阵挛发作和痉挛发作,以痉挛发作为主,但视频脑电图未捕捉到与婴儿痉挛症相关的高峰失律图形。
2.5 基因检测结果
7 例CHD 2基因变异患儿共发现7 种变异(表1),6 种为数据库中未报道的变异,其中3 例为错义变异分别为c.2671 C>T(p.P 891 S),c.2584 T>C(p.C 862 R),c.481 G>T(P.E 161 X),经过生物信息分析软件Mutation_Taster、SIFT 和 PolyPhen 2均预测可能有害;3例为截断变异分别为c.2416dup(p.R806Kfs*20),c.1628_1653del (p.S543Ff s*2)和c.4286 dup(p.S 1429 Rfs*3);一种是已有文献报道的同义变异c.390C>T(S130S)[5]。7例患儿中有6例为新生变异,1例来源于母亲(例4)。
2.6 治疗与预后
7例患儿中2例使用2种抗癫痫药物(anti-epileptic drugs,AEDs)控制发作,4例使用2种以上AEDs治疗,1例使用1种AEDs。其中1例患儿使用丙戊酸和左乙拉西坦联合治疗(例3)有效,1 例使用左乙拉西坦治疗(例2)有效,1 例使用左乙拉西坦联合托吡酯(例5)有效。1例患儿加用4种抗癫痫药物发作未控制,最后启动生酮饮食后发作得到控制,至今半年无发作(例1)。7例患儿病程中随访年限为1至2 年不等,最后一次随访年龄为2~7 岁。3 例患儿最后一次随访时发作已控制6个月以上(例 1、2、4)。
3 讨论
近年来,CHD 2基因变异常被认为是一种罕见的发育性癫痫性脑病(developmental epileptic encephalopathy,DEE)的原因[6-11]。DEE是一组严重的儿童癫痫形式,其特征是难治性癫痫发作与持续癫痫发作活动相关的认知能力下降或退化[12]。研究表明,CHD 2基因致病性变异的DEE患儿发病年龄多为6个月至4岁,常出现肌阵挛性癫痫发作,并演变为多种难治性癫痫发作类型。临床光敏性很常见,一些患者会自我诱发癫痫发作[13-15]。目前一些组织已通过微阵列比较基因组杂交(array-CGH)方法发现单例15号染色体的新生微缺失与癫痫相关,这一观点在DECIPHER数据库中有相关报道[16]。
CHD2基因变异所致癫痫与热性惊厥可能相关。Galizia等[17]曾报告1例CHD2基因致病性变异相关癫痫有热性惊厥病史的病例,其CHD 2基因的变异位点为V 1479 M,基因软件分析该位点为可能致病性。Suls等[18]曾提到3个CHD2基因变异的患儿3个变异位点分别为c.4971G>A(p.Trp1657*)、c.1810-2A>C、c.1396C>T(p.Arg466*),均有发热敏感性癫痫发作和智力落后,以及出现明显的肌阵挛性发作。本研究中有4例患儿有相关热性惊厥病史,其中1 例患儿有热性惊厥家族史,1 例患儿表型较重,对癫痫药物不敏感,另外3名患儿表型轻,预后好。说明有热性惊厥病史的CHD2基因致病性变异相关癫痫患儿多数临床表型轻,预后相对良好。而这一观点尚未有研究证实,需要进一步扩大样本量及其并长期随访研究[19]。
有证据表明,CHD 2基因的变异可能是光敏性癫痫更常见的危险因素,光敏性是CHD 2基因变异导致癫痫发作的一个特征[20]。曾有文献报道关于CHD 2基因变异的病例中1 例30 个月左右的女孩,发育迟缓,6 月龄左右开始出现癫痫发作,并且癫痫发作具有光敏感性,该患儿携带1 个5 mb 的15q26.1-15q26.2微缺失,这一缺失包含56个基因,其中包括CHD2基因[21]。结合国内外文献报道的53例CHD2基因变异癫痫患者中,有12例癫痫发作与光刺激相关。本组病例中并未发现CHD2基因变异的患儿临床发作与光刺激有关,有待今后纳入更多CHD2基因变异患儿以评估癫痫发作与光刺激之间的联系。
据研究,CHD 2基因变异与癫痫综合征相关。Trivisano等[22]提到CHD2基因变异是导致肌阵挛-强直性癫痫发作的罕见原因,文中1例17岁男孩,基因检测为CHD2移码变异(c.4256del19),无癫痫家族史,在癫痫发作前发育正常,临床表现为肌阵挛-强直性癫痫发作,点头、肌阵挛性痉挛,发作间期脑电图显示广泛性棘波、棘慢波发放,与光阵发性反应相关的背景活动慢,智力测试提示中度智力残疾。该文中还提到CHD 2基因变异与Lennox-Gastaut、Dravet及Jeavons syndromes等癫痫综合征相关。此外有文献提到CHD 2基因致病性变异相关的癫痫综合征的电临床表现,其临床表型和视频脑电图特征与青少年肌阵挛性癫痫相一致。临床表型为肌阵挛和强直阵挛性发作,以及视频脑电图为广义的4~5Hz高振幅尖波和多尖波放电[23]。但本研究的7例患儿均无癫痫综合征的表现。
Carvill等[24]报告了1例12岁男孩出生后发育正常,直到2 岁时陆续出现失张力发作、肌阵挛-失张力发作、强直-阵挛发作和癫痫持续状态,视频脑电图异常,此后,患儿出现发育倒退,并有严重智力障碍,临床诊断为肌阵挛性失张力性癫痫。该患儿在其CHD 2基因中发现了一种移码变异,导致过早终止(Arg1644LyfsTer22),该变异是通过对候选基因进行靶向测序来鉴定的,本组患儿中无携带该位点变异者。
CHD 2基因变异相关癫痫可有多种临床表现,如全面性强直-阵挛(GTCS)、肌阵挛(MS)、痉挛发作(ES)、肌阵挛-失张力(MAS)、不典型失神(aAS)、局灶性发作(Fs)等。而本组7 例患儿病程中发作类型多样,GTCS 5例(71%),Fs 4例(57%),MS 2例(28%),ES 1例(14%),MAS 1例(14%)。查阅文献,目前未见与CHD2基因变异有关的痉挛发作的病例。本研究中,例7患儿8月龄起病,临床表现为肌阵挛发作和痉挛发作,以痉挛发作为主,视频脑电图无异常,但有智力运动发育落后。CHD2基因变异有关的痉挛发作仍需进一步研究。
CHD 2基因位于15 q 26.1 上,这是一个与各种人类发育障碍相关的区域,如智力残疾、发育畸形、面容异常、言语障碍、自闭症谱系障碍和其他行为障碍。CHD 2 参与了基因激活和抑制、DNA 重组和修复、细胞周期调控、发育和细胞分化等过程。因此,这些蛋白的失调与各种人类发育障碍有关[25]。文献报道5例CHD2基因变异患儿携带相同变异位点(Q 1392 TfsX 17),这5 例患儿均有不同类型的癫痫发作,程度不等的智力、运动及语言发育落后,其中4例患儿还有孤独症样表现,表现均较重,预后不理想[26-27]。Lebrun等[28]曾报道1例患儿6岁时出现失神发作和强直-阵挛性癫痫发作,而后发现该患儿有孤独症行为,基因检测发现CHD2基因变异,变异位点为c.1934 C>T,p.(Thr 645 Met)。本文7 例患儿外貌特征均未见异常,7例患儿都有程度不等运动、智力、语言发育落后,1例患儿有孤独症倾向。
Trivisano 等[21]报道的1 例17 岁男孩由CHD 2变异所导致的肌阵挛-强直性癫痫发作,使用丙戊酸、拉莫三嗪可控制其发作。Verhoeven等[29]曾报道1 例CHD 2基因变异所致癫痫患儿临床表现为失神发作,病程中使用丙戊酸即可控制发作。有报道18例CHD2变异所致癫痫患儿中左乙拉西坦和丙戊酸控制癫痫的有效率分别为35.3%、29.4%[18]。丙戊酸是治疗全面性癫痫的有效药物之一,其通过抑制组蛋白脱乙酰酶活性、改变染色质结构来发挥抗癫痫作用[30-31],丙戊酸通常作为治疗CHD2基因变异所致癫痫发作的首选药物[13]。本研究中有4例患儿加用丙戊酸治疗有效,4例是丙戊酸联合左乙拉西坦治疗有效,有部分患儿加用拉莫三嗪或托吡酯有效,但因样本量少,需扩大样本量,延长随访时间来进一步研究。
综上所述,CHD 2基因致病性变异相关癫痫患儿的起病年龄早,病程中临床表现多样,全面强直-阵挛发作最常见。该病患儿的脑电图多为异常,背景活动多减慢,可见多棘波短程阵发,还可监测到临床发作,未见与闪光刺激相关的异常波。患儿多伴有智力发育低下,语言,运动发育迟缓、孤独症倾向。多为难治性癫痫,症状控制困难,预后较差,应尽早进行治疗干预。丙戊酸和左乙拉西坦对CHD2基因变异相关癫痫有效。
