新生儿先天性乳糜胸的临床及预后影响因素分析
2023-01-31华敏敏霍婉莹张彦华徐发林
华敏敏 夏 磊 霍婉莹 张彦华 徐发林
郑州大学第三附属医院新生儿科(河南郑州 450052)
先天性乳糜胸(congenital chylothorax,CC)是一种导致新生儿呼吸困难的罕见疾病,发病率约为1/24000[1],男多于女,系淋巴系统先天性发育结构异常,由于胸导管或胸腔内大淋巴管破裂、梗阻致使乳糜液积聚在胸膜腔[2]。乳糜液主要由脂肪、胆固醇、糖、电解质、蛋白质(包括较多的免疫球蛋白、白蛋白)和丰富的淋巴细胞组成,持续的乳糜液丢失在产前可导致胎儿水肿、羊水过多和胎儿死亡,出生早期可引起严重的窒息和呼吸窘迫,而治疗策略通常是支持性的,病死率高[3]。因发病率低,目前文献多以案例报道为主,缺乏针对该病临床特点及预后影响因素的研究,因此本研究目的是通过对本院收治的60例CC新生儿的临床病例资料进行回顾性分析,总结其临床特点,确定早期死亡的危险因素,随访存活患儿,探讨保守治疗的远期预后,旨在为CC新生儿的诊治提供参考。
1 对象与方法
1.1 研究对象
回顾性分析2012年1月至2022年5月在郑州大学第三附属医院新生儿重症监护室收治的CC患儿的临床资料。纳入标准:①确诊为CC[4]的患儿;②症状开始时日龄<28 d;③入院年龄<2个月。排除标准:①发病前有脐静脉置管、深静脉置管、经外周中心静脉置管、手术及外伤史的患儿;②临床资料不完整。
本研究获医院医学伦理委员会审核批准[(2022)医伦审第153号]。
按胎龄分为早产儿组和足月儿组,比较其临床特点;按结局分为存活组和死亡组,确定CC患儿早期死亡的危险因素,分析存活患儿的治疗方式和远期结局。
1.2 方法
临床资料收集通过电子病案管理系统查阅病历,记录母孕期及新生儿情况,包括性别、胎龄、出生体重、分娩方式、母亲年龄、是否产前使用类固醇激素、是否产前诊断胸腔积液、产前诊断胎龄、产前胸腔积液部位、是否宫内治疗、出生时有无窒息、是否在产房插管、是否在复苏时胸穿、生后胸腔积液部位、有无胎儿水肿、胸水白细胞计数、白蛋白水平、治疗方式(保守治疗或手术治疗)、住院结局等,并电话随访存活患儿的情况。
1.3 统计学分析
采用SPSS 25.0 统计软件进行分析。计量资料符合正态分布的数据以均数±标准差表示,两组间比较采用两独立样本t检验;非正态分布的以M(P25~P75)表示,组间比较采用秩和检验。计数资料以例数(百分比)表示,组间比较采用χ2检验或Fisher精确概率法检验。采用二元logistic回归分析CC新生儿患者早期死亡的危险因素。以P<0.05为差异有统计学意义。
2 结果
2.1 一般情况
研究期间共收治乳糜胸患儿71例,符合排除标准11 例,其中经外周中心静脉置管术后2 例,脐静脉置管术后1例,深静脉置管术后1例,动脉导管结扎术后2例,左膈疝术后1例,食管狭窄球囊扩张术后1 例,临床资料不完整3 例,最终纳入分析60 例。男36例、女24例,胎龄36.7(34.7~38.8)周,出生体重3 160.0(2 755.0~3 645.0)g,早产儿31例,足月儿29例。产前诊断胸腔积液52例,产前诊断胎龄(32.8±4.4)周,其中进行胎儿胸膜腔穿刺术和/或胎儿胸膜腔-羊膜腔分流术13 例,初次宫内治疗胎龄(32.7±2.3)周。出生时窒息31例,在产房插管27例,复苏时胸腔穿刺8例,双侧胸腔积液30例,胎儿水肿19例,低蛋白血症29例,合并先天性乳糜腹14例,合并先心病/染色体异常12例。
本组病例均采取了保守的治疗措施,死亡11例,均于生后1 周内死于呼吸衰竭,存活49 例,电话随访存活患儿,因家属电话无应答导致失访3例,截至2022年9月,1例复发,其于3岁4个月、3岁6个月各复发1次,予以保守治疗后痊愈,现9岁5个月,体健,其余45例无复发,中位年龄2.9(1.4~4.5)岁,均情况良好。
2.2 早产儿组和足月儿组临床特点比较
与足月儿组相比,早产儿组男性比例较低,出生体重较轻,宫内治疗、胎儿水肿、窒息、在产房插管、机械通气、双侧胸腔积液、白蛋白< 30 g/L、合并先天性乳糜腹以及死亡比例均较高,差异有统计学意义(P<0.05)。见表1。
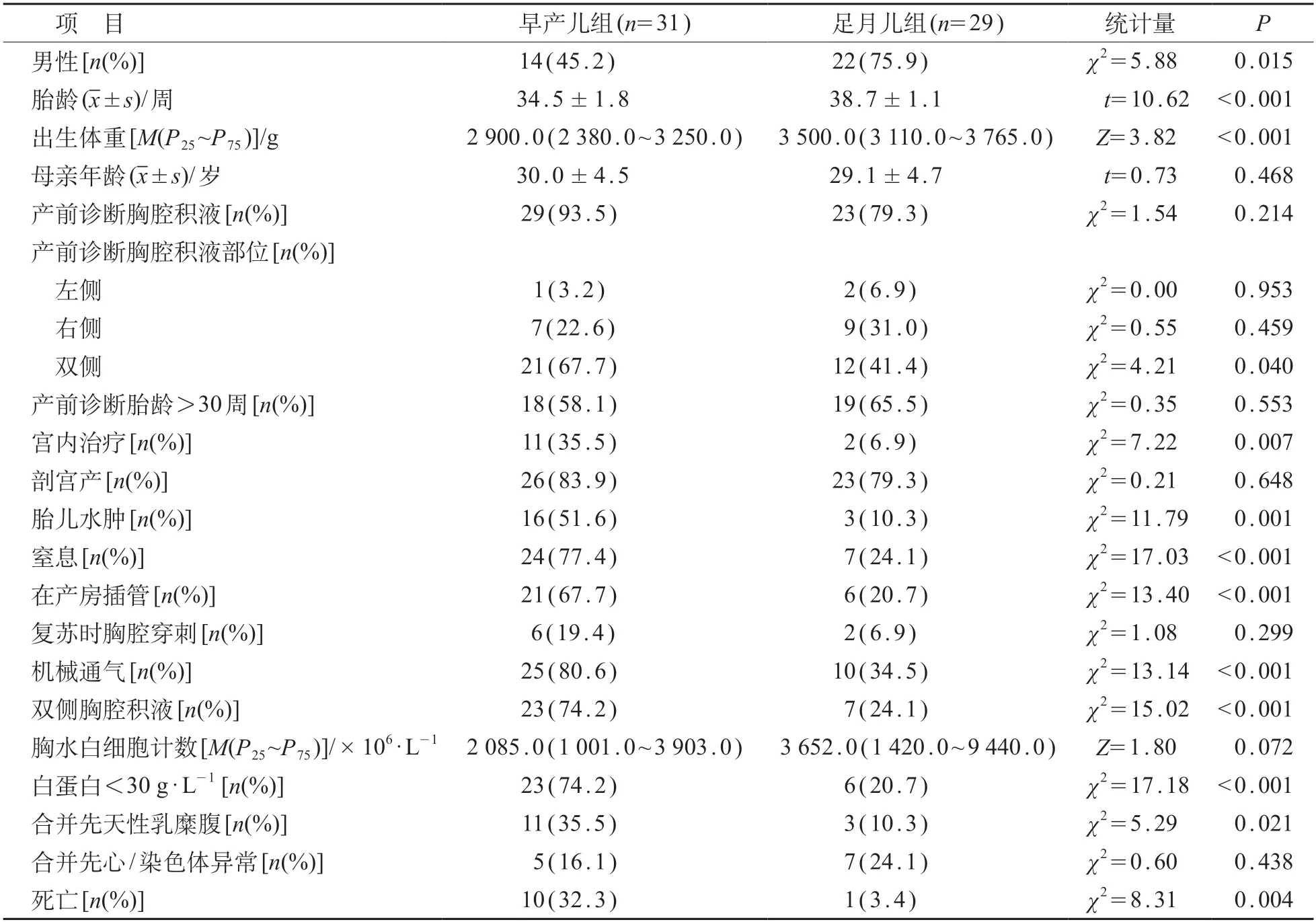
表1 早产儿组和足月儿组临床特点比较
2.3 先天性乳糜胸新生儿早期死亡的危险因素分析
与存活组相比,死亡组胎龄<37 周、白蛋白<30 g/L、胎儿水肿的比例较高,差异有统计学意义(P<0.05)。见表2。
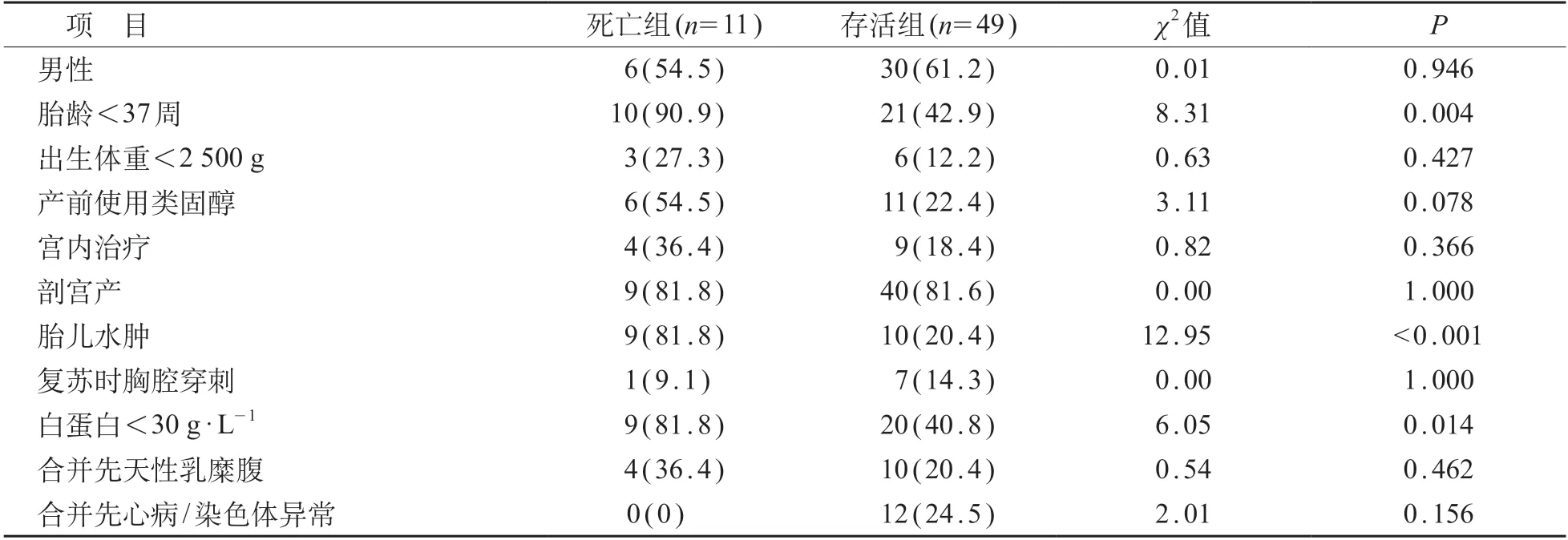
表2 死亡组与存活组间CC新生儿临床特点比较[n (%)]
二元多因素logistic回归分析发现,胎儿水肿是CC新生儿早期死亡的独立危险因素(P<0.05)。见表3。
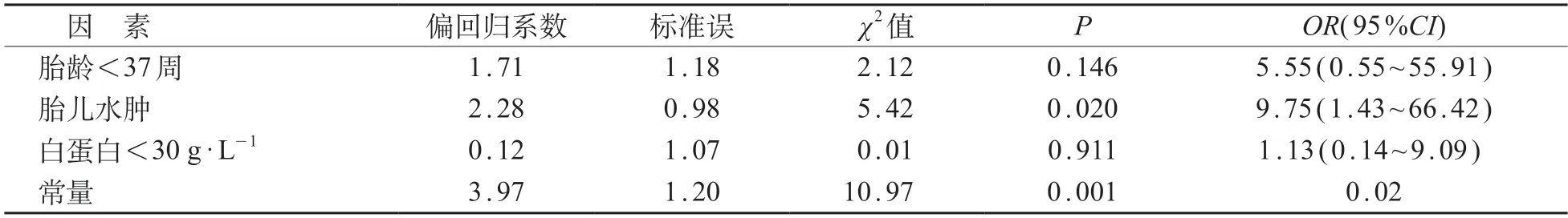
表3 CC新生儿早期死亡危险因素的logistic回归分析
3 讨论
先天性乳糜胸是新生儿胸腔积液的最常见原因[5],多数发生在胎儿期,亦是原发性胎儿胸腔积液(fetal hydrothorax,FHT)最常见的原因[6],多在妊娠中晚期发生,大多在产前可经超声检查发现胸腔积液,胸腔积液积累到一定程度可严重影响胎儿的发育,甚至致死。目前重度原发性FHT(胸腔内液体量超过胸腔体积的50.0%)可进行宫内胸膜腔穿刺术和/或胸腔-羊膜腔分流术来减少胸腔积液量,促进胎肺扩张,缓解对胎心的压迫,进而改善预后[7-8]。本研究中13例CC患儿因重度原发性FHT进行了宫内干预,3例经历了多次宫内胸膜腔穿刺术,考虑与乳糜液在胸穿后重新积聚有关,2 例因大量腹腔积液同时进行了宫内腹腔穿刺术,抽出的腹水经化验均证实为先天性乳糜腹。先天性乳糜腹较CC 发病率低,两者同时出现的情况更为罕见,本研究中合并先天性乳糜腹14 例,早产儿比例较高,原因有待进一步研究,多数保守治疗可痊愈[9],少数需手术治疗。
国外的一项综述显示,79.0%的CC新生儿的胸腔积液为双侧,这可能与胸导管的破裂位置有关,胸导管起源于腹膜后的乳糜池,经过主动脉裂孔进入胸腔后转至中线右侧,通常在4~5 胸椎水平由右胸跨至左胸,这段胸导管的破裂会导致乳糜液漏至两侧胸膜腔[10]。本研究显示早产儿双侧胸腔积液的比例较足月儿高,与相关研究报道一致[11],窒息及在产房插管复苏的概率亦较高,考虑与早产儿肺本身发育不成熟,双侧胸腔积液导致肺不张的程度较重有关。故CC 新生儿分娩时,尤其是早产儿,需做好充分的窒息复苏准备,及早行胸腔穿刺术抽取胸腔积液促肺复张[12],必要时可在产房插管、正压通气来改善氧合,以减少窒息对重要脏器的损伤。
CC 患儿病死率介于20.0%~50.0%[3],本组患儿在积极治疗的情况下死亡11 例,病死率18.3%,均于生后早期死于呼吸衰竭。单因素分析显示早产、白蛋白< 30 g/L、胎儿水肿均为CC新生儿早期死亡的危险因素,出生体重并不影响CC 新生儿的生存结局,二分类logistic 回归分析表明胎儿水肿是CC新生儿早期死亡唯一的独立危险因素,与相关研究结果不一致[13-14]。胎儿水肿是指胎儿软组织及体腔积液,超声表现为≥2处的胎儿体腔异常体液,包括胸腔积液、腹腔积液、心包积液及皮肤水肿(皮肤厚度>5 mm);按照病因分为免疫性水肿和非免疫性水肿(nonimmune hydrops fetalis,NIFH),NIFH占胎儿水肿的90.0%以上,是各种病因引起疾病的晚期表现,预后不良[15-16]。CC是NIFH的原因之一,NIFH患儿易发生出生窒息且复苏困难[17],合并NIFH 的CC 患儿死亡率高达60.0%~98.0%[18]。有研究主张合并NIFH 的CC 患儿应接受宫内干预,有助于提高Apgar 评分、缩短机械通气时间及并发症[19]。而也有研究报道NIFH 并不影响CC 新生儿整体的存活率,但CC 新生儿需要在产房引流胸水及新生儿初期进行积极的机械通气[20]。本研究中CC 早产儿NIFH 的比例较高,原因考虑如下:①CC 患儿由于蛋白质大量丢失到胸膜腔而引发全身性低蛋白血症,早产儿更严重,血管内渗透压降低更明显;②早产儿双侧胸腔积液的比例高,CC患儿胸腔积液为双侧时,胎儿水肿的可能性有增加的趋势[20],可能与双侧胸腔积液压迫纵膈阻碍静脉回流的占位效应更明显有关。
针对CC尚没有诊治共识或管理指南,研究报道新生儿乳糜胸保守治疗成功率为20.0%~80.0%[2,18],但保守治疗多久定义为失败尚不明确,本组病例均行保守治疗,即禁食、全肠外营养、胸腔闭式引流、富含中链三酰甘油的配方奶、呼吸支持、免疫支持等,治愈率81.7%,绝大多数存活患儿乳糜胸未复发,远期预后良好,这与相关研究结果一致[21-22],提示胸导管愈合或淋巴侧支循环一旦形成,不易出现病情反复发作。
综上所述,CC 早产儿更容易出现窒息、胎儿水肿、低蛋白血症、双侧胸腔积液、先天性乳糜腹,在产房插管、机械通气及死亡的比例亦高于足月儿;胎儿水肿是CC 患儿早期死亡的独立危险因素;保守治疗的远期预后良好。当然,限于本研究为单中心,且样本量小,研究结果的意义主要是为以后更广泛、深入研究提供思路,需大样本量的多中心研究才能得出更准确的结论。
