小切口脓肿切开联合超声辅助定位VSD技术治疗乳腺脓肿的效果
2023-01-31郑孝广
郑孝广
(商丘市睢阳区中心医院普外科,河南 商丘 476100)
乳腺脓肿为哺乳期多发疾病,发病率约为9.12%,尤其具有急性乳腺炎史的女性发病率明显更高[1]。乳腺脓肿初期具有乳房胀痛症状,一般是由于乳汁淤积、感染源入侵乳房等造成乳腺管感染,导致乳腺组织化脓[2]。脓肿切开引流是乳腺脓肿的主要治疗方法,但常规手术换药次数较多,术后疼痛明显,且存在乳房变形风险,具有一定局限性。脓肿切开引流的关键在于引流方法,若引流不彻底可诱发并发症,且需多次引流。本研究探讨小切口脓肿切开联合超声辅助定位负压封闭引流(VSD)的临床价值。
1 资料与方法
1.1 一般资料
选取商丘市睢阳区中心医院2018年9月至2020年8月97例乳腺脓肿患者,根据手术方案不同分为对照组48例和观察组49例。对照组年龄24~52岁,平均(37.86±6.24)岁;脓腔直径37~71 mm,平均(53.92±7.56)mm;病程1.5~10.5个月,平均(5.98±2.03)个月;单侧脓肿33例,双侧脓肿15例;哺乳期13例。观察组年龄23~54岁,平均(39.11±6.40)岁;脓腔直径36~73 mm,平均(55.28±7.72)mm;病程1.0~11.5个月,平均(6.07±2.09)个月;单侧脓肿32例,双侧脓肿17例;哺乳期14例。2组基线资料比较差异无统计学意义(P>0.05),具有可比性。
1.2 病例选择标准
1)纳入标准:经病理及超声检查确诊;临床资料完善;脓腔直径3~10 cm。2)排除标准:存在乳腺结核、慢性复发性乳腺炎、乳腺癌;凝血功能异常;脓肿表面皮肤破溃;既往有胸部手术史;胸部假体植入;存在心内科严重疾病。
1.3 治疗方法
1)对照组行传统脓肿切开引流术。超声明确脓肿位置并选择麻醉方式。局部浸润麻醉:脓肿直径小、位置前;全身麻醉:脓肿直径大、位置深;根据脓肿位置做放射状或弧形切口,排出脓液,钝性剥离脓肿多房间隔,切除坏死组织,用庆大霉素、双氧水及氯化钠溶液反复冲洗脓腔,止血后以凡士林纱布填塞,加压包扎。
2)观察组行小切口脓肿切开联合超声辅助定位VSD技术。术前超声明确脓肿位置、深度、大小,局部浸润麻醉,靠近乳晕边缘做2.0~2.5 cm弧形切口,放射状切开腺体,引出脓肿脓液,钝性分离纤维分隔,以氯化钠溶液冲洗脓腔至清亮液体流出;软硅胶管插入脓腔引流,缝合,生物膜封闭,加压包扎;连接引流管、一次性负压引流球囊,术后3~5 d更换敷料,并观察引流液情况,若转换为淡黄色、连续3 d引流量<5 mL,则可拔管。
2组术后常规预防感染用药。
1.4 观察指标及检测方法
1)统计2组手术相关指标:包括创口愈合时间(术毕至缝线拆除)、换药次数、术中失血量、手术时间、瘢痕长度。
2)比较2组术后1、3、5 d患者疼痛程度:采用带有0—10刻度标尺,以视觉模拟评分法(VAS)评估,其中0刻度代表无痛、10刻度代表重度疼痛难以忍受,指导患者选择可代表自身疼痛的刻度值,以刻度值为相应分值,即0~10分,分值越低表明疼痛越轻微。
3)比较2组术前、术后5 d炎症因子[肿瘤坏死因子-α(TNF-α)、黏附因子-1(ICAM-1)、白介素-1β(IL-1β)]水平:分别于术前、术后5 d采集5 mL上臂静脉血,12 000 r·min-1离心10 min,分离血清,采用双抗体夹心酶联免疫吸附法检测各指标水平,分别在空白孔、标准孔、待测样品孔中加样,酶标板覆膜,37 ℃孵育1.5 h,每孔加100 μL生物素化抗体工作液,覆膜,37 ℃温育60 min;每孔加100 μL酶结合物工作液,覆膜,37 ℃温育0.5 h,每孔加90 μL显色剂(TMB),酶标板加上覆膜37 ℃避光孵育15 min,并加入终止液,用酶标仪测量各孔450 nm的吸光度值。
4)术后乳房变形情况:是否可见明显凹陷。
5)2组术后并发症情况:包括乳瘘、切口感染、脓肿引流不尽。
6)术后6个月复发情况。判定标准:超声检查发现乳腺脓肿,且穿刺可抽出脓液。
1.5 统计学方法
2 结果
2.1 手术相关指标
与对照组相比,观察组术中失血量、换药次数更少,瘢痕长度和创口愈合时间更短(均P<0.05)。2组手术时间比较差异无统计学意义(P>0.05)。见表1。

表1 2组手术相关指标比较
2.2 疼痛程度
观察组术后1、3、5 d VAS评分均低于对照组(均P<0.05)。见表2。
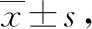
表2 2组疼痛程度比较 分
2.3 炎症因子
2组术前TNF-α、ICAM-1、IL-1β水平比较差异无统计学意义(P>0.05)。与术前比较,2组术后5 d TNF-α、ICAM-1、IL-1β水平均降低,差异有统计学意义(P<0.05);观察组术后5 d TNF-α、ICAM-1、IL-1β水平均低于对照组,差异有统计学意义(P<0.05)。见表3。
2.4 乳房变形情况
观察组术后乳房变形发生率为0.00%(0/49),低于对照组[20.83%(10/48)](χ2=11.382,P=0.001)。
2.5 术后并发症发生情况
术后观察组发生乳瘘1例、切口感染1例;对照组发生切口感染2例、脓肿引流不尽5例、乳瘘2例。观察组术后并发症发生率[4.08%(2/49)]低于对照组[18.75%(9/48)](χ2=5.189,P=0.023)。

表3 2组炎症因子水平比较
2.6 复发率
术后6个月,对照组有2例复发,均再次行脓肿切开引流术。观察组复发率[0.00%(0/49)]与对照组[4.17%(2/48)]比较差异无统计学意义(χ2=0.532,P=0.466)。
3 讨论
乳腺脓肿是产褥期、哺乳期多发妇科疾病,由于乳头擦伤或皲裂、输乳管阻塞、乳房受挤等因素诱发乳腺炎,最终形成乳腺脓肿[3]。手术治疗乳腺脓肿有确切效果,脓肿切开引流术可有效引流,减少脓腔残留,具有明显效果[4-5]。但传统引流术于脓腔周围做切口,以纱布填塞方式进行引流,由于部分患者为哺乳期,乳汁分泌量较大,且创口易出现脓肿渗液,增加换药次数,既加重患者痛苦,又延缓术后恢复。为提高手术效果及安全性,临床提出微创旋切术、超声引导下反复穿刺冲洗、单纯乳房切除术、区段切除术等方案,但均有其局限性,探究安全且普遍适用的手术治疗方案对预后改善有积极意义。
引流是否充分是乳腺脓肿治疗的关键,脓肿切开引流术优势在于术中视野清晰,可直视下进行脓腔间隔分离,提高引流充分性,从而减少复发。随着医疗水平的不断提高,小切口脓肿切开术可进一步降低手术创伤,逐渐成为乳腺脓肿常用方案。小切口脓肿切开手术具有微创优势,安全性高、操作简单,可有效清除坏死组织排出体外,减少伤口瘀血,对减少术后换药有积极作用[6-7]。VSD技术可通过封闭生物膜、负压引流管产生负压,从而营造自溶性清创环境。VSD技术一方面可阻止外部细菌入侵,进一步增强分泌物及坏死组织清除能力,促进窗口纤维蛋白溶解,加快创口愈合;另一方面发挥负压调控作用,促进蛋白合成,对促使肉芽生长有积极作用[8-9]。此外,超声波定位有利于明确包括小脓肿在内的病灶实际部位及大小;同时,通过预先设计的切口,通过负压封闭引流作用,合理给予引流敷料贴附,结合脓腔高负压吸引技术,达到微创、合理引流的效果。本研究观察组在术中失血量、创口愈合时间、换药次数方面较对照组均具有明显优势,说明小切口脓肿切开联合超声辅助定位VSD技术可加快创口愈合,缩短康复进程,减少换药次数。小切口脓肿切开为微创手术,手术切口较小,既能降低瘢痕对美观度的影响,又能降低术后疼痛程度,本研究观察组术后1、3、5 d VAS评分均较对照组低,证实小切口脓肿切开联合超声辅助定位VSD技术在缓解术后疼痛程度方面具有一定优势。
有研究[10]发现,乳腺脓肿患者存在明显的炎症反应。TNF-α、ICAM-1、IL-1β均为炎症因子,在乳腺脓肿患者中表达水平明显升高,其中TNF-α可介导白细胞活化、聚集,增强内皮细胞与白细胞黏附效应;ICAM-1来源于淋巴细胞、单核细胞等,与炎性渗出密切相关;IL-1β是一种重要的炎症介质,具有放大炎症反应作用,三者高表达提示炎症反应状态活跃,且三者水平越高,患者炎症反应越明显[11-12]。本研究发现,2组术后5 d TNF-α、ICAM-1、IL-1β水平均降低,且观察组低于对照组,提示小切口脓肿切开联合超声辅助定位VSD技术在改善炎症反应方面具有优势。尹剑桥等[13]报道,超声引导下VSD可降低TNF-α、ICAM-1、IL-1β水平,本研究结果与之相似。
乳房变形是影响患者术后满意度的重要因素,同时是常规脓肿切开术后的常见症状,对患者身心造成一定影响。小切口脓肿切开联合超声辅助定位VSD技术由于切口较小,对乳腺损伤较小,且在靠近乳晕处做弧形切口,最大程度降低对乳房外观的损害,满足患者乳房美观度的要求。本研究观察组术后乳房变形发生率、并发症发生率、术后6个月复发率均低于对照组,说明小切口脓肿切开联合超声辅助定位VSD技术对保持乳房美观度效果好,可减少术后并发症并有助于预防术后复发。
综上所述,小切口脓肿切开联合超声辅助定位VSD技术治疗乳腺脓肿患者,可加快创口愈合,缩短康复进程,缓解术后疼痛,改善炎症反应,避免乳房变形,降低术后并发症发生率,预防复发,是治疗乳腺脓肿的理想术式。
