1株新型鸭呼肠孤病毒(SL株)的全基因组测定分析及其致病性
2023-01-31杨晓伟王凯民庄鸿琨田宇森李俊锋朱盈名张立武赵光伟
杨晓伟,陆 婧,王凯民,庄鸿琨,田宇森,李俊锋,朱盈名,刘 霞,张立武,赵光伟, *
(1.西南大学 动物医学院,重庆 荣昌 402460;2.南京海关动植物与食品检测中心,江苏 南京,210095;3 贵州省动物疫病预防控制中心,贵州 贵阳550008;4.重庆三杰众鑫生物工程有限公司,重庆 荣昌 402460)
禽呼肠孤病毒(avian reovirus,ARV)是呼肠孤病毒科、正呼肠孤病毒属的成员。鸭源呼肠孤病毒是其中的一种,目前主要有2种基因型,一种是番鸭呼肠孤病毒(muscovy duck reovirus,MDRV),主要引起番鸭、半番鸭肝脏、脾脏坏死,肾脏出血等病理变化,俗称“花肝病”或“肝白点病”;另一种则是引起麻鸭、番鸭、北京鸭、樱桃谷鸭等多品种鸭以脾脏斑块样坏死为特征的“脾坏死病”,该病的病原为新型鸭呼肠孤病毒(novel duck reovirus,NDRV),可通过垂直和水平2种方式传播,发病鸭病死率达到5%~50%,日龄越小病死率越高,无明显的季节性,已经成为我国近年来最严重的鸭病毒性传染病之一[1]。
NDRV与其他禽源呼肠孤病毒均为呼肠孤病毒科、正呼肠孤病毒属的成员,为分节段的双链RNA病毒[2]。病毒粒子无囊膜,约为70 nm,呈24面体对称,具有双层衣壳结构,病毒基因组由10个基因组片段组成,根据基因组在PGAE电泳中的迁移率不同,可分为3个长片段(L1、L2、L3),3个中片段(M1、M2、M3)和4个小片段(S1、S2、S3、S4)[3]。除了S1片段以外其他的基因片段均只含有1个开放阅读框,分别编码1种蛋白,L组编码λ蛋白(λ1、λ2、λ3),M组编码μ蛋白(μ1、μ2、μ3),S组S2、S3、S4分别编码σA、σB、 σNS蛋白,S1基因片段具有多顺反子结构,包含3个重叠的开放阅读框并编码σC、P10、P17蛋白[4]。NDRV S1片段的多顺反子结构与MDRV差异较大,且MDRV的p10和σC蛋白由最小的基因组节段S4编码,并且不编码p17蛋白,因此NDRV 在基因组序列上与其他禽源呼肠孤病毒存在较大差异[5]。
近年来,我国川渝地区鸭场中多发以肝脏、脾脏出血、坏死为主要特征的传染性疾病,病死率达30%,其特征与NDRV病相似。因此,为明确该病的致病原及其分子特征,本试验对四川省隆昌地区的患病鸭进行了病毒的分离、鉴定与全基因组的测定分析,以期为该病的防控提供必要的理论支撑。
1 材料与方法
1.1 病毒的分离无菌采集四川省隆昌某鸭场5只具有典型脾脏坏死的花边鸭病料(肝脏和脾脏),剪碎混匀,加入无菌PBS液研磨为匀浆液,于-20℃ 和4℃反复冻融3次,12 000 r/min离心15 min 取上清液,用孔径为0.22 μm的一次性滤芯过滤除菌,将滤液经尿囊腔按0.2 mL/枚接种11日龄SPF鸭胚8枚,同时设置8枚作为对照组注射等量无菌生理盐水,用蜡封孔,37℃静置孵育。将接种病料后24~120 h内死亡的鸭胚和对照组鸭胚于4℃冷藏2 h后收集尿囊液,将收集的尿囊液按1∶10的比例加入氯仿后12 000 r/min离心取上清,同样用0.22 μm滤芯过滤除菌后分装于-80℃保存,将其命名为F1代。将F1代尿囊液按照同样的方法接种于一批新的SPF鸭胚,依次传代(标记为Fn),直到感染鸭胚出现规律性死亡,剖解死亡鸭胚并记录病理变化。
1.2 病原的RT-PCR鉴定参考相关文献[6],根据NDRV S1基因序列的保守区域设计合成1对特异性引物,上游F:5′-TGAGACGCCTGACTACGA-TT-3′,下游R:5′-ATGCTTGGAGTGAGACGA-CT-3′,预期扩增片段大小为380 bp,引物由华大基因科技公司合成。取1.1保存的组织匀浆液和尿囊液,分别用EasyPure Viral DNA/ RNA提取试剂盒(ER201-01,北京全式金)提取其总RNA并反转录为cDNA,按如下体系和条件进行扩增。PCR反应体系(25.0 μL):模板3 μL,10 pmol/L上、下游引物各1.0 μL,Premix Taq 12.5 μL,无菌ddH2O 7.5 μL。PCR扩增程序:94℃预变性5 min;94℃ 40 s,55℃ 40 s,72℃ 45 s,共33个循环;72℃延伸10 min,4℃保存,将PCR产物经1.0%琼脂糖凝胶电泳进行检测后回收目的片段,送华大基因科技有限公司进行测序。
1.3 全基因组序列的测定病毒全基因组的测定由上海凌恩生物科技有限公司完成。其主要步骤为:取1.1中保存的尿囊液提取总RNA,利用紫外分光光度计检测其纯度,使其D260/D280值在1.8~2.0之间以制备测序文库。以1 μg 总 RNA起始量建库,首先使用Illumina的TruseqTMRNA sample prep Kit专用片段化缓冲溶液将RNA片段化,接着用随机寡核苷酸合成第1条链后混合DNA聚合酶Ⅰ和RNase H合成双链cDNA。然后通过核酸外切酶/聚合酶将cDNA突出端补平,并在3′端连接上index接头,使用Illumina聚合酶链反应引物混合物在15个循环的聚合酶链反应中选择性富集两端连接有衔接分子的DNA片段,于2%的琼脂糖胶回收长度约150 bp的目的条带,然后利用TBS380(picogreen)对回收的基因片段进行定量,在cBot Truseq PE Cluster Kit v3-cBot-HS上进行桥式扩增,然后将扩增得到的片段在Illunima novaseq 6000测序平台进行300个循环测序获得原始NGS数据。过滤低质量测序数据,利用DNAStar软件对过滤后的测序数据进行组装。将最终测序得到的基因序列上传至NCBI数据库。
1.4 同源性和遗传进化分析利用DNAStar软件和NCBI网站中BLAST功能对测序完成的病毒基因组进行同源性的分析比对;利用MEGA X软件中的Neighbor-Joining法构建进化树(bootstrap值500),分别构建10个基因组片段的禽类呼肠孤病毒的系统发育树,分析分离株在遗传进化树上与其他禽类呼肠孤病毒之间的差异。
1.5 分离毒株对鸭胚的致病性试验取1.1中最新一代尿囊液,按10倍梯度进行系列稀释,取10-4,10-5,10-6和10-74个稀释度,每个稀释度接种5枚9~11日龄SPF鸭胚,每枚绒毛尿囊腔接种0.2 mL,37℃培养,连续观察120 h,根据Reed-Muench法,计算分离毒的ELD50。
1.6 分离毒株对雏鸭的致病性试验20只7日龄健康花边鸭随机分成攻毒组和阴性对照组,每组10只。攻毒组:取1.1中保存的最新一代尿囊液,按照0.3 mL(2×ELD50)/只剂量肌肉注射10只健康花边鸭;阴性对照组:每只肌肉注射0.3 mL无菌生理盐水。攻毒后连续观察10 d,记录鸭发病和死亡的情况。取发病鸭脾脏和肝脏进行组织切片,HE染色后观察其组织病理学变化。
2 结果
2.1 病毒的分离病料接种后的鸭胚在第6代时出现规律性死亡,死亡高峰期集中在72 h左右。F6代鸭胚全部死亡,死亡鸭胚主要表现为胚体出血,尤以腿和内脏器官最明显(图1A、B),部分胚体明显发育不良(图1B、E)。肝脏、脾脏、头部出血明显(图1C、D)。腿部严重出血(图1E)。对照组均未出现异常症状(图1F)。

A~E.均为攻毒组鸭胚(A可见头部,内脏器官出血;B和E中鸭胚发育受阻,腿部出血严重;C和D中鸭胚脾脏严重出血);F.为未接毒的阴性对照,发育正常
2.2 病原的RT-PCR鉴定对匀浆液和尿囊液进行RT-PCR扩增,均扩增出约为380 bp的目的条带 (图2),与预期大小相符。将测序结果与GenBank数据库进行比对,结果显示该病毒为NDRV,将其命名为SL株。

M.DL2000 DNA Marker;1.病料样本检测结果;2.F6代尿囊液检测结果
2.3 分离毒株SL株全基因组的测序结果测序结果显示,SL株基因组全长23 580 bp,G+C含量为49.62%,共由10个基因组片段组成,分别为S1~S4,其中S1 1 534 bp、S2 1 351 bp、S3 1 186 bp、S4 1 175 bp;M1~M3片段中M1 2 249 bp、M2 2 141 bp、M3 2 022 bp;L1~L3片段中L1 3 919 bp、L2 3 827 bp、L3 4 176 bp。将测序得到的全基因组序列上传至NCBI数据库,其登录号分别为MW196679~MW196688。其中S1基因为多顺反子,含有3个重叠的ORF阅读框,分别编码3种蛋白(σC、P10、P17),其他片段各含1个完整的ORF,编码1种蛋白,SL株的所有节段与其他禽类呼肠孤病毒都具有相同的5′-GCUUUUU…UCAUC-3′末端保守序列(表1)。
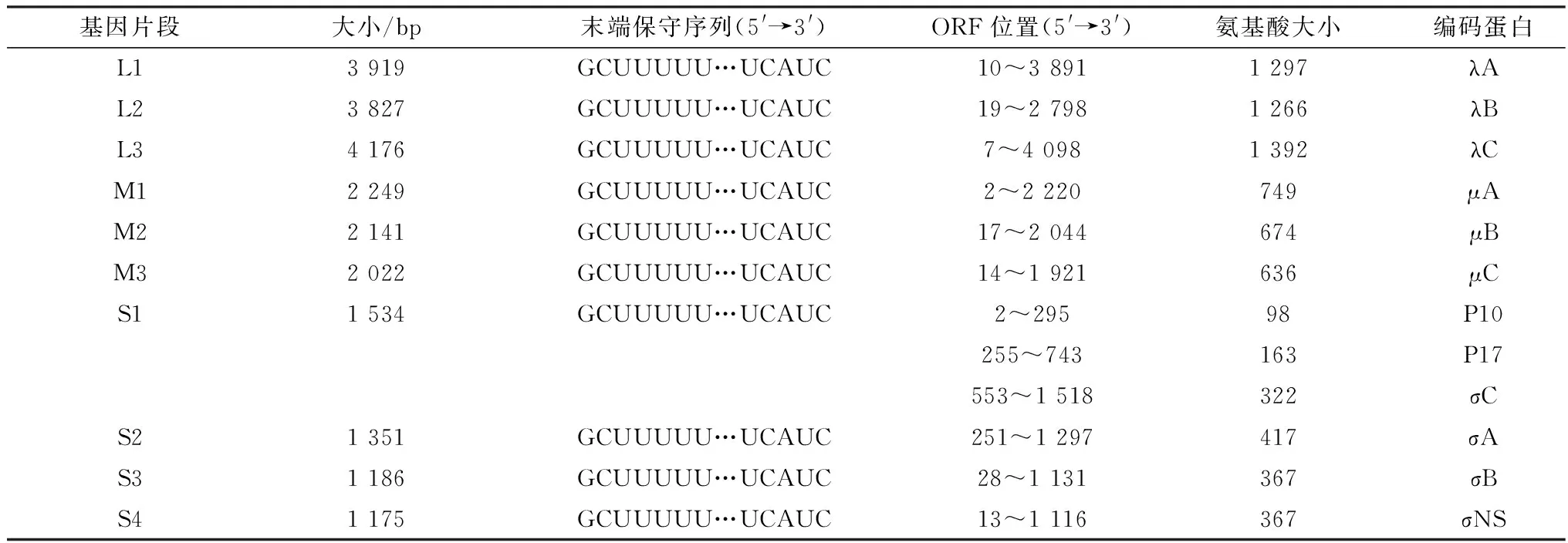
表1 SL株基因组信息
2.4 全基因序列的同源性和遗传进化分析结果将测序得到含有10个基因节段的全基因组序列用DNAStar软件和NCBI的BLAST功能分别进行比对,结果显示:SL株与NDRV、MDRV、GRV (03G株)、ARV的同源性分别为87.20%~99.48%,80.09%~98.77%,87.38%~95.90%和70.04%~91.15%,与NDRV毒株的同源性最高,与ARV毒株的同源性最低。其中与S1、S4、L2、L3等4个片段同源性最高的均是NDRV的GX-Y7株(分别为99.48%,99.23%,98.76%,98.44%),与S2、S3、M3等3个片段同源性最高的均是NDRV的XT18株(分别为99.38%,99.15%,98.98%)。与M2片段同源性最高的是NDRV的SY株(98.55%),与M1片段同源性最高的是NDRV的HN5D株(98.00%)。只有L1片段与MDRV的SH12株同源性最高(98.19%)。在与所有参考毒株的比对结果中,GX-Y7株和XT18株与SL株同源性最高,相比之下,SL株与ARV的同源性最高仅为91.15%。

A~C.L基因片段(L1~L3)的系统进化树;D~F.M基因片段(M1~M3)的系统进化树;G~J.S基因片段(S1~S4)的系统进化树。红色圆点标记的为本试验分离毒株SL株
将测序得到的10个全基因组序列利用MEGA X软件中的Neighbor-Joining法构建进化树,bootstrap设置为500,分别构建禽类呼肠孤病毒的系统发育树,分析SL株全基因序列在遗传进化树上与其他禽类呼肠孤病毒之间的差异。结果显示,参与比对的所有禽类呼肠孤病毒的基因组序列主要分为2个大类的进化支,即ARV主干支和MDRV、NDRV共同构成的主干支。在所有遗传进化树中,SL株的10个基因节段均位于MDRV和NDRV构成的主干支中,除了M1和L1片段的进化树里面有MDRV的DH13株和SH12株外,其他所有的基因节段均与NDRV位于同分支。在SL株的所有遗传进化树中,L3、M2、 S2、 S3片段均与XT18株位于同一分支,遗传位置关系最近(图3C,E,H,I)。S1和S4片段则始终与GX-Y7株位于同一分支,遗传位置最近(图3G,J),在L1、L2、M2片段的遗传进化树中,SY株、XT18株、GX-Y7株、DH13株、SH12株与L1片段位于同一大分支(图3A,B,E),M2片段与SY株位于另一个同分支(图3E),L2片段则与GX-Y7株和XT18株位于同一分支,且与XT18株的遗传位置最近 (图3B)。在所有的遗传进化树中,只有M1片段与MDRV源的DH13株在1个单独的分支上,两者遗传位置最近,且与NDRV源的SY株的遗传位置最近(图3D)。
2.5 对鸭胚的致病性试验接种后24 h内均无鸭胚死亡。在24~120 h内,10-4接种组5枚鸭胚均死亡,10-5接种组共死亡3枚,10-6接种组共死亡1枚,10-7接种组无死亡。根据Reed-Muench法,分离毒SL株的ELD50为10-5.32/0.2 mL。
2.6 对雏鸭的致病性试验SL株感染4 d后有2只雏鸭出现精神沉郁、趴伏、拉黄绿色稀便,6 d后死亡4只,其中1只角弓反张(图4A),其余6只在观察期内均存活,但表现精神萎靡,食欲减退。可见其发病率为100%,病死率为40%。剖检病死鸭可见肝脏出血,脾脏肿大、坏死(图4B,C)。对照组均表现正常。
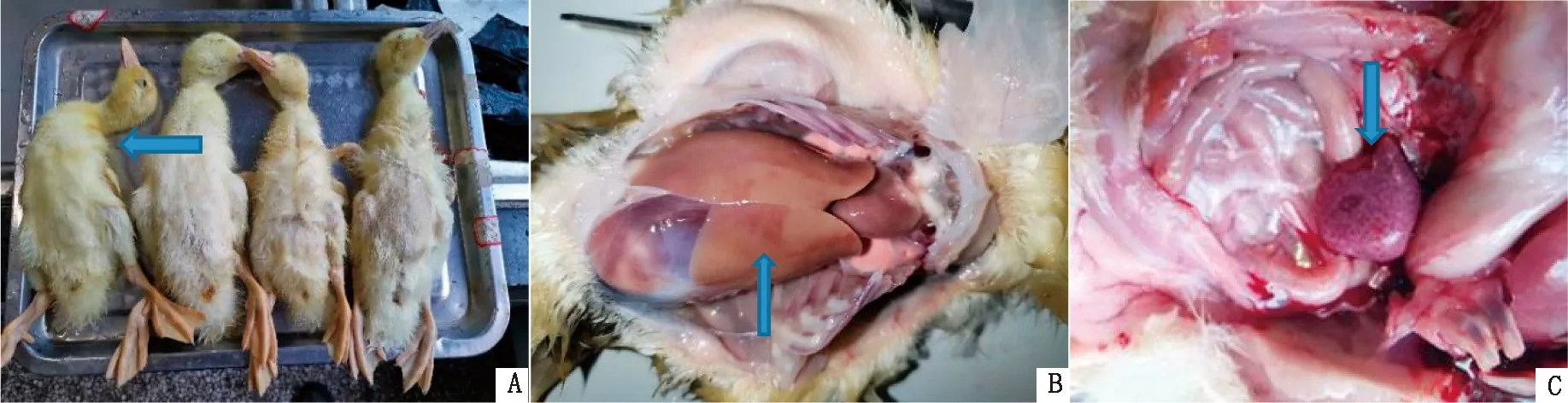
A.感染SL株死亡鸭;B.感染鸭的肝脏出血;C.感染鸭的脾脏肿大出血。箭头指示角弓反张
感染发病鸭肝脏、脾脏的组织病理学观察显示:雏鸭肝脏细胞的正常结构模糊不清,出现肝脏细胞肿胀、空泡变性(图5A),血窦弥漫性出血,局部门管区有少量淋巴细胞及异嗜粒细胞浸润(图5B);脾脏白髓严重萎缩、淋巴细胞坏死,红髓轻度淤血(图5C),脾脏静脉出现混合性血栓(图5D)。

A.肝脏病理切片(×400),箭头指示肝细胞空泡变性;B.肝脏病理切片(×100),箭头指示淋巴细胞及异嗜粒细胞浸润;C.脾脏病理切片(×400),箭头指示白髓萎缩,淋巴细胞坏死;D.脾脏病理切片(×100),箭头指示脾静脉出现混合性血栓
3 讨论
ARV自1954年在患有慢性呼吸道疾病的雏鸡中被发现以来,世界多个国家如美国、意大利、新西兰、巴西、阿根廷等都有发生,呈世界性分布[6]。然而近年来,许多国家又报道了具有不同致病特点的ARV变异株,最为突出就是感染鸭的新型呼肠孤病毒,2011年前后该病在我国大面积暴发,其最为典型的特征是引起鸭脾脏的出血、坏死,俗称“脾坏死病”,病死率35%~40%[7],与以往ARV、MDRV所引起的症状有较大差异,严重威胁着家禽养殖业的健康发展。本试验中四川隆昌地区发病鸭的临床症状与以往报道的新型呼肠孤病毒感染病例非常相似,鉴于川渝地区是我国水禽养殖较为密集的地区,疾病发生造成的损失较大,因此本试验对该地区典型病例进行了病毒的分离、鉴定及致病性研究。
鸭胚传代是经典的毒株分离手段之一,通过连续传代让病毒逐渐适应鸭胚产生规律性死亡,从而达到分离病毒的目的。试验采用此方法成功分离到毒株,经鉴定证实是新型呼肠孤病毒。通过对鸭胚和雏鸭的致病性试验发现该毒株的毒力较强,对鸭胚的ELD50为10-5.32/0.2 mL,与陈宗艳等[8]报道的TH11毒株相比,两者毒力相当。雏鸭的致病性试验能够复制出典型的临床症状,用2倍ELD50剂量攻毒能导致40%的病死率,提示该毒株应属于强毒株。雏鸭感染后肝脏、脾脏的组织病理学变化也充分验证了这一点,其中肝脏细胞表现为肿胀、空泡变性,脾脏白髓严重萎缩、淋巴细胞坏死,其病理变化与之前报道[9]一致,符合强毒的病理特征。目前已将该毒株提交武汉大学保藏中心保藏,毒种保藏号CCTCC(NO.V201970),以期为后续的生物制品开发提供前期基础。
SL株全基因组测序显示该病毒与ARV、NDRV基因组结构相似,均由10个片段组成,在每个片段的起始端和末端都具有禽正呼肠孤病毒特有的5′-GCUUUUU…UCAUC-3′保守序列。10个基因组片段分别编码λA(L1)、λB(L2)、λC(L3)、μA(M1)、μB(M2)、μC(M3)、σA(S2)、σB(S3)、σNS(S4)、σC、P10、P17(S1),根据SL株S1编码3个蛋白,与MDRV 仅编码σC和P10 2个蛋白不同,说明SL株是区别于以往MDRV的1种新型呼肠孤病毒。
对SL株的10个基因组片段进行同源性分析显示,该毒株与NDRV的同源性最高(87.02%~99.48%),亲缘关系最近,而与ARV的同源性最低(91.15%~70.04%),亲缘关系最远。系统进化树显示,SL株与MDRV和NDRV构成一个主干支,而ARV另为一个独立的干支。在MDRV和NDRV构成的主干支里,SL株与GX-Y7和XT18两个NDRV毒株具有较近的亲缘关系,进一步说明SL株为一新型呼肠孤病毒。同时发现SL株中M1片段和L1片段与SH12和DH13两个MDRV毒株也具有较高的进化地位,推测SL株或许存在MDRV和NDRV基因重组现象,这在禽源呼肠孤病毒中并不少见,其原因应与RNA 聚合酶缺乏矫正功能,因而分节段的RNA 病毒容易发生基因重组和抗原变异,与王劭等[10]得出的结论一致。
综上,本试验通过对临床样本的分离鉴定和SL毒株全基因组的测定以及致病性研究,确定新型呼肠孤病毒为致病原,该病毒与以往MDRV、ARV有较大差异。本试验结果可为鸭呼肠孤病毒病的防控及其特异性生物制品的研发奠定基础。
