甘加型藏羊发情周期Kiss-1/GPR54在生殖器官中的表达和分布
2023-01-31孙晓煜何玉英杨亚文何玉琴包莹莹刘莉莉陶乐凯蔡永强
孙晓煜,何玉英,杨亚文,何玉琴*,包莹莹,刘莉莉,陶乐凯,蔡永强
(1.甘肃农业大学 生命科学技术学院,甘肃 兰州 730070;2.中国人民银行兰州中心支行内审处,甘肃 兰州 730070;3.新疆伊犁师范大学 生物与地理科学学院,新疆 伊犁 835000)
Kiss-1基因编码产物称为Kisspeptins,它们的同源受体为GPR54,两者组成Kiss-1/GPR54系统[1]。有研究表明,该系统主要通过下丘脑表达的 Kisspeptin与其受体GPR54结合后刺激下丘脑促性腺激素释放激素(GnRH)的释放,进而促进垂体释放促卵泡素(FSH)和促黄体素(LH),作用于卵巢,构成下丘脑-垂体-性腺轴参与季节性繁殖动物的周期性调控[2]。卵巢、输卵管和子宫在发情周期中会发生一系列生理变化,这为卵母细胞的生长和成熟、精子储存和获能以及受精卵的附着和胚胎的发育提供了有利的条件,因此三者是雌性动物重要的生殖器官。近年来有许多研究表明,Kiss-1/GPR54在人[3]、猪[4]、鼠[5]的卵巢、输卵管和子宫中均有表达,证明Kiss-1/GPR54与雌性动物卵巢、输卵管和子宫的繁殖效应有一定的关系。有研究发现,通过给休情期母绵羊注射 Kisspeptins,可以促进其排卵[6]。还有研究发现,若敲除小鼠的GPR54基因,会导致外生殖器官均出现异常[7]。上述研究表明Kiss-1/GPR54对哺乳动物繁殖活动发挥着重要的调控作用。
甘加藏羊生活在海拔约为3 600 m的高原地区,其肉质鲜美,富含诸多营养物质,并且毛皮可以用来制作地毯等生活物品,是当地重要的畜牧资源。但由于其是典型的季节性发情哺乳动物,繁殖率较低,每年只产1胎,不利于当地经济发展。目前国内外有关Kiss-1/GPR54 系统表达和功能的研究大多集中在动物HPO轴,而针对Kiss-1/GPR54基因及其蛋白的表达和分布是否与藏羊发情周期生殖器官功能活动有关的研究未见报道。因此本研究首次应用RT-qPCR、Western blot和IHC方法从基因、蛋白和细胞形态水平对甘加藏羊发情周期和乏情期卵巢、输卵管和子宫中Kiss-1/GPR54的表达及分布进行研究,为研究Kiss-1/GPR54系统对藏羊的季节性发情的调控机制提供依据。
1 材料与方法
1.1 试验样品采集于甘南藏族自治州甘加乡藏羊养殖场选取30只健康未孕的雌性甘加型藏绵羊。在藏羊非发情季节(3-6月份)为乏情期,设为试验对照组;在藏羊发情季节(7-9月份)为发情周期,参照四期分法,根据公羊爬跨试情以及阴道脱落细胞图片观察,将藏羊发情周期分为发情期、发情后期、间情期、发情前期。在相应各时期颈动脉放血法处死试验羊,迅速取出卵巢、输卵管和子宫等组织。将所取组织平均分为2份,1份置于液氮速冻后移至-80℃ 冰箱以备后续定量RT-qPCR和Western blot试验,另1份置于体积分数为4%多聚甲醛中固定,以备后续免疫组织化学技术试验。
1.2 甘加藏羊生殖器官中Kiss-1、GPR54 mRNA表达检测
1.2.1总RNA的提取与实时荧光PCR 从冷冻的卵巢、输卵管和子宫组织中,按照TranZol试剂总RNA提取试剂盒(北京,TransGen)说明书,分别提取总RNA。超微量核酸蛋白测定仪来测定RNA的纯度和浓度,1%的琼脂糖凝胶电泳法测定RNA的完整性,最后用cDNA反转录合成试剂盒进行反转录操作,保存于-20℃冰箱,备用。
根据NCBI查找绵羊的Kiss-1、GPR54和β-actin基因序列,运用 Premier 5.0 软件设计相关引物 (表 1),由上海生工生物科技有限公司合成。

表1 RT-qPCR引物信息
以反转录合成的cDNA为模板,反应总体系为20.0 μL,其中模板为1.0 μL,上、下游引物各0.5 μL,2×TransStart TiP Green qPCR SuperMix 10.0 μL,ddH2O 8.0 μL,每个样品设置3个重复。反应条件:96℃预变性30 s;95℃变性5 s,60℃退火30 s,循环50次。
1.2.2数据处理和分析 以相应的β-actin内参基因对照,利用2-ΔΔCt方法计算试验数据。SPSS 17.0进行方差分析,t检验比较其差异显著性。
1.3 甘加藏羊生殖器官中Kiss-1、GPR54蛋白表达的检测取1 g冷冻组织,加入1 mL蛋白裂解液,进行研磨,离心取上层清液,分别经过12% SDS-PAGE和15% SDS-PAGE分离后,转移至PVDF膜上,用5%的脱脂羊奶室温封闭2 h;分别加入Kisspeptin抗体、GPR54抗体以及β-actin多克隆抗体(1∶4 500稀释),4℃封闭过夜;用PBST洗涤3次,每次20 min,加入HRP标记的山羊抗兔IgG(1∶4 500稀释),37℃温育2 h;用PBST洗膜3次,每次20 min,配制发光液,使用全自动发光图像分析系统检测蛋白表达,以β-actin为内参。
1.4 甘加藏羊卵巢、输卵管和子宫中 Kisspeptin、GPR54 的免疫组织化学染色分别将卵巢、输卵管和子宫组织进行包埋,制备成5 μm的石蜡切片脱蜡处理后,应用过氧化物标记的链霉卵白素(streptavidin/peroxidase,SP)法进行染色。依次用0.01 mol/L柠檬酸钠抗原修复,H2O2阻断、血清封闭、Kisspeptin和GPR54(博奥森,北京)一抗1∶350稀释,阴性对照用磷酸缓冲盐溶液(PBS)代替一抗,4℃孵育过夜,然后依次滴加生物素标记的羊抗兔 IgG 溶液和辣根酶标记链霉卵白素,分别在37℃下孵育15 min。最后用二氨基联苯胺(DAB)染色,通过复染和脱水透明后用中性树脂封片。利用光学显微镜观察并拍照,Kisspeptin和GPR54阳性部位呈现棕色。
2 结果
2.1 甘加藏羊发情周期生殖器官中Kiss-1和GPR54 mRNA的表达分析甘加藏羊发情周期卵巢、输卵管、子宫中均有Kiss-1和GPR54 mRNA的表达。卵巢和输卵管中Kiss-1和GPR54的表达量在发情期达到峰值,显著高于其他3个时期和乏情期(P<0.05);子宫中Kiss-1在间情期表达量显著高于其他发情时期(P<0.05);GPR54在发情期的表达量显著高于其他发情时期(P<0.05)。乏情期Kiss-1、GPR54 mRNA的表达显著低于发情周期各时期(P<0.05)(图1)。

A.Kiss-1;B.GPR54。相同形状不同小写字母表示组间差异显著(P<0.05);相同小字母表示差异不显著(P>0.05)。下同
2.2 甘加藏羊发情周期生殖器官中Kisspeptin和GPR54蛋白表达水平分析甘加藏羊发情周期卵巢、输卵管和子宫中均有Kisspeptin和GPR54蛋白的表达。卵巢中Kisspeptin表达量从发情前期至发情期呈上升趋势,发情期达到最高,发情期后逐渐降低,乏情期最低,各个时期差异显著(P<0.05);GPR54在发情期的表达量显著高于其他时期(P<0.05);输卵管中Kisspeptin和GPR54的蛋白表达量,在发情前期达到最高,不同时期差异显著(P<0.05);子宫中Kisspeptin表达量在间情期最高,显著高于发情前期、发情后期、间情期以及乏情期(P<0.05);在发情期与发情后期GPR54的表达量差异显著(P<0.05),其他时期差异不显著(P>0.05)。乏情期Kisspeptin、GPR54的蛋白表达显著低于发情周期各时期(P<0.05)(图2,3)。

图2 甘加藏羊发情周期各时期卵巢、输卵管和子宫中Kisspeptin和GPR54 Western blot条带图

A.Kisspeptin;B.GPR54
2.3 甘加藏羊发情周期生殖器官中Kisspeptin和GPR54蛋白免疫组化染色分析免疫组化结果显示,Kisspeptin和GPR54免疫阳性反应产物为黄色或棕色,所有对照组试验的标本均呈阴性,证明所用(一抗)抗体具有Kisspeptin和GPR54免疫反应的特异性。甘加藏羊发情周期各时期卵巢、输卵管和子宫组织中均有 Kisspeptin(图4)和GPR54(图5)蛋白表达,且阳性着色强弱差异明显。在卵巢组织中,Kisspeptin和GPR54主要分布在卵泡颗粒层和卵泡内膜(图4 A、B,图5 A、B)以及黄体细胞中(图4 C,图5 C),其中在颗粒细胞和黄体细胞中免疫阳性产物着色深;在输卵管分泌细胞、纤毛细胞和黏膜上皮中均有表达(图4 E~G,图5 E~G),纤毛细胞中免疫阳性产物表达强,着色深。在子宫上皮细胞和基细胞中呈高表达(图4 I~K,图5 I~K)。
3 讨论
卵巢能够分泌多种生殖激素调节雌性哺乳动物的周期性排卵,为动物受孕繁衍后代,是雌性动物重要的生殖器官[8]。已经有研究证明,Kisspeptin和GPR54在卵巢中表达分布与其功能活动有着重要联系[9]。MERHI等[10]发现敲除Kiss-1和GPR54基因的小鼠,卵巢的质量和体积比正常小鼠小,并且卵泡数目减少。当GAYTN等[11]向大鼠卵巢中注射Kisspeptin时,卵泡和黄体数目增加,表明Kisspeptin对卵巢的生长以及卵泡和黄体的生成有一定的促进作用。DHILLO等[12]给人注射Kiss-peptin发现可以促进LH的分泌。LH是HPOA轴调控动物季节性动情节律的关键激素。有研究证明LH增加可以通过颗粒细胞上的LH受体直接刺激Kisspeptin的合成[13],因此可以推测,Kisspeptin可能参与调控卵巢中卵泡成熟等重要生殖活动。并且研究发现Kisspeptin/GPR54系统能调节卵巢分泌雌激素,雌激素能通过反馈作用,调节血液中的Kisspeptin的含量。当切除卵巢时,不能阻止Kisspeptin促进LH的分泌,但是增加雌激素的含量后,Kisspeptin的含量显著升高[14]。这表明了卵巢中的雌激素对于Kiss-1/GPR54系统正反馈调节,对排卵有着非常重要的影响。并且TERAO等[15]通过研究发现Kisspeptin在卵巢中具备局部功能作用。本研究也证明了,Kiss-1/GPR54 mRNA及其蛋白的表达量在发情期最高,提示卵巢中的Kisspeptin和GPR54通过雌激素的反馈作用,参与调节卵巢颗粒细胞的发育、卵泡的成熟以及排卵等重要活动。
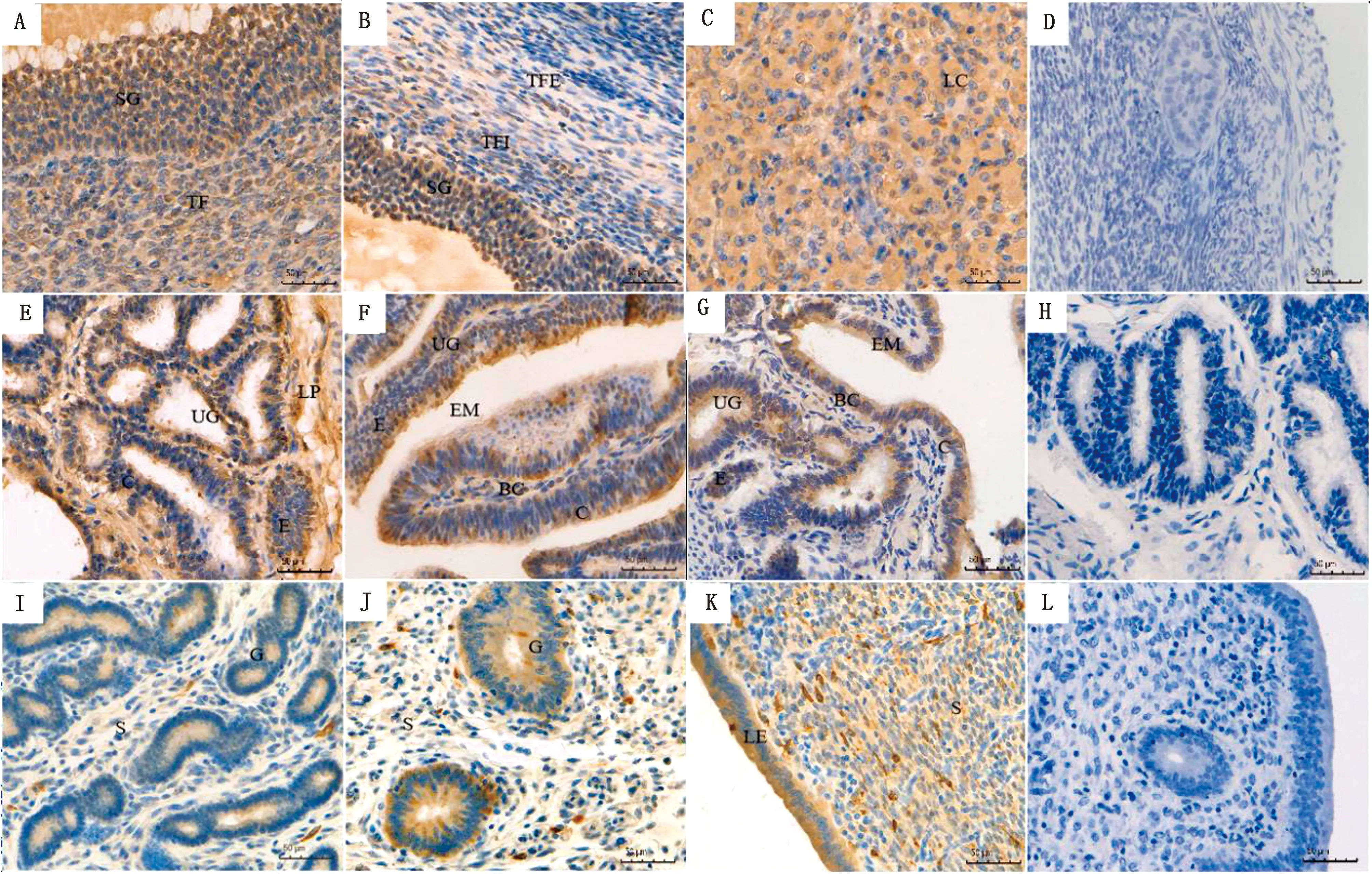
A~D.卵巢;D、H、I.阴性;E~H.输卵管;I~L.子宫。SG.颗粒细胞;TF.卵泡膜;LC.黄体细胞;UG.输卵管腺;LP.固有膜;E.分泌细胞;EM.黏膜上皮;C.纤毛细胞;G.子宫腺;S.基细胞;LE.上皮细胞。下同

图5 甘加藏羊发情周期各时期卵巢、输卵管和子宫组织中GPR54的分布和表达
本研究发现,Kisspeptin和GPR54主要分布于卵巢组织中的颗粒细胞和黄体细胞,证明在这2种细胞中,Kisspeptin和GPR54可能发挥着重要作用。Kisspeptin与颗粒细胞中的GPR54结合后发挥作用,致使颗粒细胞生长,调控细胞上的受体,参与卵泡的生长,随着卵泡的不断发育,颗粒细胞会释放雌激素,促进卵泡进一步生长以及排卵[16]。同时孕酮的含量也会增加,促进颗粒细胞的黄体化[17],进而调控生物体的发情周期,提示Kisspeptin和GPR54参与卵泡的发育和黄体的成熟。
输卵管对卵子的储存、成熟、受精以及早期胚胎发育的功能是生殖活成功的一部分[18]。郑杰等[19]在山羊的输卵管中检测到Kiss-1/GPR54 mRNA的表达,试验结果发现在输卵管组织中的纤毛细胞和分泌细胞中均有Kisspeptin和GPR54的阳性表达。并且Kiss-1/GPR54 mRNA在发情期达到最高,间情期最低,而Kisspeptin和GPR54的蛋白表达量在发情前期最高。基因和蛋白表达出现差异的原因,可能是基因在转录过程受到许多因素影响,例如环境或者基因内源机制。以上提示Kisspeptin和GPR54在输卵管组织中主要在发情前期和发情期的纤毛细胞和分泌细胞中参与调控藏羊的生殖活动。有研究证明,纤毛细胞和分泌细胞的数量是由类固醇激素来调节[20],并且卵巢中的雌激素和孕酮是调节输卵管功能的关键因子。有研究表明,Kiss-1/GPR54可以调节雌激素的含量,并且雌激素的负反馈作用也是借助Kiss-1/GPR54系统信号来实现的[21]。
子宫具备构成胎盘、参与胎儿生长发育、影响生殖机能等重要的生理作用[22],并且这些生理功能主要取决于由卵巢激素调节的子宫内膜的周期性变化[23]。本试验免疫组化结果表明Kiss-1/GPR54主要分布在子宫上皮细胞和基细胞中,提示Kiss-1/GPR54主要在这2种细胞中发挥作用。LEON等[24]研究发现,当敲除小鼠的Kiss-1/GPR54基因,雌性成年鼠的子宫减小,同时子宫腺的数目会减少,当恢复雌激素水平时,小鼠的子宫发育大体恢复正常,但是子宫腺仍表示为缺失,这个结果提示,子宫内膜和腺体的发育可能依赖于Kiss-1/GPR54系统的调控。HERBISEN等[25]发现大部分的Kiss-1细胞表达ERα,而ERα的反馈作用主要由Kisspeptin和GPR54系统实现。ROBINSON等[26]发现奶牛子宫内膜中的ERα mRNA在间情期表达量显著高于其他时期。本研究发现Kiss-1 mRNA及其蛋白表达量在间情期达到最大值,由此推测Kisspeptin可能诱导ERα的转录,从而促进雌激素的分泌,调节子宫内膜的周期性变化,进而调节生殖活动。
本研究结果表明,Kiss-1/GPR54 mRNA及其蛋白在整个发情周期中卵巢、输卵管以及子宫中均有表达和分布,且相对表达量呈动态变化,并且存在一定的差异,证明Kiss-1/GPR54系统参与生殖系统发情周期调控,研究结果为进一步探究Kiss-1/GPR54系统对动物生殖系统繁殖活动的调节提供了一定的科学参考依据。
