改良鸡胚尿囊膜肿瘤实验动物模型及其生物学行为观察
2013-11-27马继伟张逸铠李海莹马征来夏潮涌钟雪云
马继伟,张 勇,张逸铠,李海莹,马征来,王 超,夏潮涌,钟雪云
(1.暨南大学医学院病理教研室,广州 510632;2.暨南大学医学院组织学与胚胎学教研室,广州 510632)
动物模型是研究疾病发生发展及相关机制的重要手段,目前常用的体内实验模型为裸鼠,而裸鼠模型因其实验周期长,费用昂贵、实验条件要求高,限制了它的广泛应用。近年来,鸡胚尿囊膜(chick chorioallantoic membrane,CAM)模型在肿瘤血管方面的研究受到关注。因鸡胚发育的9~14 d,免疫系统并没有完全形成,排斥反应尚未建立,有利于建立各种移植肿瘤模型。相比裸鼠等哺乳动物模型,利用鸡胚CAM建立肿瘤模型,建模周期短,便于观察。肿瘤细胞种植到CAM相对无血管的区域后3~5 d,肉眼可见肿瘤形成,且生长迅速。国内外已有学者利用鸡胚尿囊膜成功建立了前列腺癌[1]、卵巢癌[2]、肾癌[3]及 U87 细胞胶质瘤[4]等移植瘤模型。本研究利用改良的实验技术建立恶性胶质瘤鸡胚尿囊膜(CAM)移植肿瘤模型,为后续开展恶性胶质瘤的生物学行为、肿瘤与血管形成关系、抗肿瘤药物筛选等研究提供良好的动物实验模型。
1 材料和方法
1.1 材料
SWO-38胶质瘤细胞株由暨大医学院病理教研室自行建系,该细胞来源于12岁男性小脑蚓部纤维性星形细胞瘤(WHO胶质瘤分类I级),经体外培养生物学性质稳定,具有恶性星形细胞瘤的特征,主要用于胶质瘤生物学特征的体外研究[5,6];受精种蛋:(华农正大禽业有限公司);改良型RPMI-1640培养基(Hyclone公司);胎牛血清(天津灏阳公司);胰蛋白酶(Difco公司);甲醛(国产分析纯试剂);Olympus体视显微镜(日本奥林巴斯公司)。
1.2 方法
1.2.1 细胞培养:细胞培养SWO-38细胞于5%CO2、37℃细胞培养箱中培养。培养基为改良型RPMI-1640培养液(加入10%胎牛血清、1×105U/L青霉素、100 mg/L链霉素)。取处于对数生长期细胞用于实验。
1.2.2 鸡胚孵育:德国伊沙鸡种,购自华南农业大学正大禽业有限公司,受精种蛋经消毒放入于温度37.0℃,相对湿度60% ~80%的恒温孵箱中孵育,胚头斜向上方,鸡蛋长轴与蛋托约成45°,每天晾蛋及翻蛋10 min,孵育备用。
1.2.3 细胞接种:取对数生长期的SWO-38细胞,常规 0.25%胰酶消化 4 min,1 000 r/min离心 3 min,用无血清培养基调整细胞数量并分为0.8×106/60 μL,1 ×106/60 μL,2 ×106/60 μL,4 × 106/60 μL,8 ×106/60 μL 和不含细胞的无血清培养基组(对照组)。种蛋46支,共分为6组,参考贺国安等[7]的无气室孵育法(有改进)。孵育 9 d 后[7]在照蛋器下用铅笔划定气室的范围,75%酒精常规消毒,无菌镊子在划定气室范围内先轻轻敲开蛋壳大小约(5×5)mm保留壳膜,用浸湿的PBS棉球轻沾壳膜以吸走蛋壳碎屑,继续开口至(1.5×1.5)cm大小,无菌镊子撕去周围蛋壳和壳膜,沾有无菌PBS溶液的棉球轻轻湿润气室膜,此时可清楚显现尿囊膜的血管,尖镊子轻轻划开气室膜,切勿损伤其下尿囊膜,揭开气室膜暴露其下尿囊膜,于大血管之间相对无血管区放置一内径为0.4 mm的硅胶圈,按照分组每只鸡胚滴加不同密度的细胞或不含细胞的无血清培养基60 μL,用无菌透明胶封闭,接种24 h后取出硅胶圈,同时覆盖(2×2)cm的无菌保鲜膜于开口位置,继续用无菌透明胶封闭。每隔24 h在灯下通过窗口观察鸡胚存活及接种区尿囊膜肿瘤及周围血管情况。
1.2.4 移植瘤取材:鸡胚接种后继续孵育5 d,于水下剥离蛋壳和壳膜,完整取下鸡胚,置于盛有4%甲醛固定液的皿中,肿瘤取出常规石蜡包埋,HE染色进行形态学观察。
1.2.5 统计学方法:本文分类资料采用率表示,多组数据之间率的比较采用X2检验,P<0.05为差异有统计学意义。
2 结果
2.1 接种细胞数量对存活率及成瘤率的影响
本实验将SWO-38细胞按细胞数分成5组分别接种至鸡胚尿囊膜,继续孵育5 d观察,结果显示各组SWO-38细胞对鸡胚存活率并无影响,1×106细胞数量组存活率略低,经统计学分析不同细胞数量对鸡胚存活率的影响差别无统计学意义(P>0.05)。如表1所示成瘤率随细胞数目的增加而升高,8×106细胞数量组的成瘤率与对照组及0.8×106组比较差异有统计学意义(P<0.05)
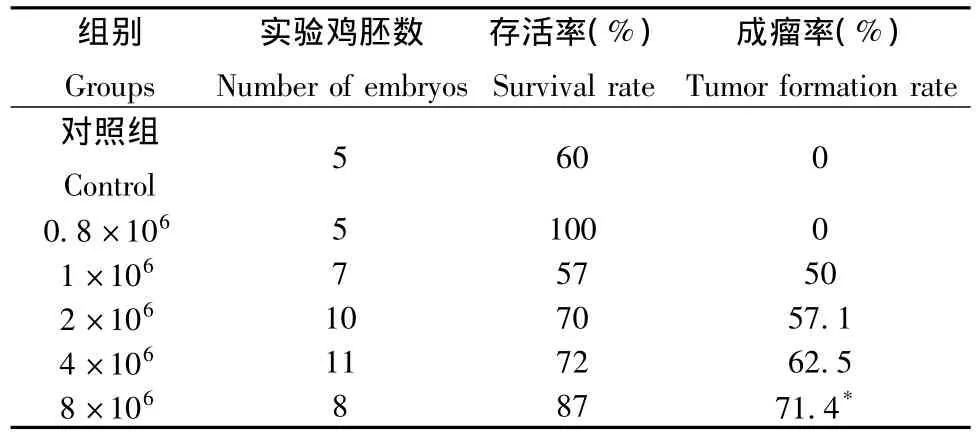
表1 不同细胞数目对鸡胚存活率和成瘤率的影响Tab.1 Effect of the number of inoculated glioma cells on the survival rate of chicken embryos and tumor formation rate
2.2 移植瘤诱导血管生成
实验中观察到,肿瘤细胞接种24 h内肿瘤细胞悬液呈薄膜样浮于尿囊膜上,血管无特殊改变;48 h内肿瘤肉眼可见,并可观察到较为微弱的血管反应;72 h肿瘤小团块形成并牵拉尿囊膜使尿囊膜包裹肿瘤团块,血管增粗紊乱;至接种后第5天,肿瘤质韧、呈鱼肉状,外有尿囊膜包裹,肿瘤诱导血管围绕肿瘤生长。(图1,见文后彩插2)
2.3 移植瘤的形态学特征
常规石蜡包埋,HE染色,镜下见模型瘤体以鸡胚尿囊膜为基质生长,2×106/60 μL细胞密度肿瘤组织生长较8×106/60 μL细胞密度生长较好(图2A、B)。局部区域可见肿瘤细胞迁移至血管周围(图2D),新生血管围绕肿瘤团块生长(图2C),血供丰富处肿瘤团块较大,反之肿瘤细胞分布稀疏。肿瘤细胞较密集的地方还可以观察到肿瘤中心因血供不足而发生坏死,肿瘤细胞周围存在炎症反应(图2E)。肿瘤细胞多呈圆形或椭圆形,体积大,可见瘤巨细胞,胞浆少,核大深染,异型性明显,病理性核分裂相常见(图2F)。上述表现均符合恶性肿瘤的组织学特征(图2见文后彩插2)。
3 讨论
已有学者利用鸡胚尿囊膜模型成功建立宫颈癌[8]、骨肉瘤[9]等移植瘤模型,但均未对其技术细节进行探讨,本实验着重对实验技术进行改良及优缺点进行探讨。常见的开窗法是在孵育第7~9天的蛋壳上磨切开窗,本文采用无气室开窗法,减少了蛋壳碎屑残留,同时尿囊膜可充分暴露,便于确定加样位置。有文献报道利用透明胶封闭后每天通过透明胶观察鸡胚存活及成瘤情况[10],但是直接用透明胶封闭24 h后,透明胶产生白雾,无法观察鸡胚内部情况。故本实验尝试先用无菌保鲜膜封闭窗口再以透明胶固定的方法,既避免白雾的产生,又利于直观观察鸡胚情况。以无气室开窗法结合无菌保鲜膜封闭窗口,保证了鸡胚存活率的稳定,同时利于后续实验观察。尿囊膜的药物及移植瘤实验中,常用载体为滤纸、甲基纤维素、明胶海绵或者直接滴加,本实验采用内径为0.4 mm的硅胶圈放置于大血管间的相对无血管区,利于肿瘤细胞悬液聚集在一定范围内不致弥散。胶圈虽然可以很好的聚集肿瘤细胞但是因其对血管有损伤故于接种后24 h取出胶圈。虽然上述三点可以保证尿囊膜移植瘤模型成功建立,但是该模型若要开展后续研究仍存在着其自身的不足。该模型若作为抗肿瘤药物筛选模型给药方式只能滴加给药或静脉注射给药,相反裸鼠模型可以实现多种方式给药最大可能地模拟人体的给药方式,更为精确地得完成药物抗肿瘤作用的评价;文献报道利用U87[11]胶质瘤细胞株和SWO-38[6]细胞株建立裸鼠模型所需细胞数均在2×106/只以下,而建立相应的尿囊膜移植瘤模型至少需要(5~8)×106/只,其他类型肿瘤的移植瘤所需的细胞数量标准不一,差异较大,细胞数1×105~1×1012/只不等[2],使得不同实验室只能根据自身的条件探索合适的细胞数量,因此一定程度地消弱了此模型的价值。
本研究重点观察了不同细胞数目对鸡胚存活、成瘤的影响及肿瘤组织与血管生成的关系。研究发现:不同细胞数目对鸡胚存活率无影响,且随着接种细胞数目的增加鸡胚成瘤率也在增加,但是实验中观察到细胞密度2×106/60 μL组较之细胞密度8×106/60 μL组肿瘤整体生长好,能很好的观察到肿瘤组织在尿囊膜的生物学行为,但是成瘤率较低。因此建立鸡胚尿囊膜移植瘤模型需根据细胞株及实验目的,探索合适的细胞密度,保证成瘤率同时又能较好观察其相关生物学行为。细胞数目过少成瘤率较低不利于实验开展,细胞数过多,造成肿瘤区域营养不足,影响肿瘤生长。因此本实验综合此两种因素认为4×106/60 μL为合适细胞密度。肿瘤组织生长与血液供应关系密切[12],通过对尿囊膜上移植瘤的连续动态观察,观察到尿囊膜血管较接种之前有所增加,尿囊膜血管围绕肿瘤组织生长。同时通过组织学也发现肿瘤细胞体积较大,核大深染,病理性核分裂相十分易见,肿瘤组织周围血液供应丰富,同时血运贫乏处肿瘤分布稀疏,符合恶性肿瘤的细胞形态及肿瘤组织生长特征,因此本实验为研究恶性胶质瘤的生物学行为尤其是肿瘤与血管生成的关系建立了一个良好的模型。
与裸鼠移植瘤模型相比,尿囊膜模型更能直观的观察肿瘤的发生、发展变化过程,且可以简单明了的观察到肿瘤与血管的关系,有研究预先通过siRNA干扰技术将胶质瘤U87细胞下调VEGF表达后,接种至尿囊膜观察到低表达VEGF的移植瘤的新生血管明显减少,肿瘤细胞密度也下降[13],对U87胶质瘤尿囊膜移植瘤应用抗癌药物也得到类似结果[14],说明尿囊膜移植瘤模型在观察肿瘤生长规律、抗肿瘤药物筛选尤其是抗血管相关药物筛选具有应用前景。
4 结论
通过改良的方法对9日龄鸡胚的尿囊膜进行胶质瘤细胞接种,成功建立了胶质瘤的鸡胚移植瘤模型,该模型相较于裸鼠等其他模型具有实验周期短、成本廉价等优点,同时该模型能较好地观察肿瘤的生物学行为,为后期建立抗肿瘤药物筛选模型提供了良好的平台。
[1] Kunzi-Rapp K,Genze F,Küfer R,et al.Chorioallantoic membrane assay:vascularized 3-dimensional cell culture system for human prostate cancer cells as an animal substitute model[J].J Urol,2001,166(4):1502 -1507.
[2] 杨丽华,王凯峰,周轶铁,等.人卵巢癌鸡胚尿囊膜血管生成模型的建立[J].现代妇产科进展,2003,12(6):407-409.
[3] 张斌,阮喜云,陈杰,等.人肾癌鸡胚模型的建立及其肿瘤生物学特性的研究[J].西安交通大学学报 (医学版),2012,33(1):68-70.
[4] Strojnik T,Kavalar R,Barone TA,et al..Experimental model and immunohistochemical comparison of U87 human glioblastoma cell xenografts on the chicken chorioallantoic membrane and in rat brains[J].Anticancer Res,2010,30(12):4851 -4860.
[5] Zhong XY,Chen YX,Ye SF,et al.Establishment of two cell sublines from SWO-38 glioma cell:immunohistoimmunal and ultrastructural study[J].Int J Modern Cancer Ther,2000,3(2):34-36.
[6] 司徒锐,王慧华,王锦环,等.人脑恶性胶质瘤体外细胞系SWO-38的建立和生物学特征[J].癌症,1987,6(4):235-238.
[7] 贺国安,罗进贤,张添元,等.改进的鸡胚绒毛尿囊膜技术-无气室孵育法[J].中山大学学报:自然科学版,2003,42(2):126-128.
[8] 汤球,崔淑芳,蔡丽萍,等.鸡胚宫颈癌模型的建立及其生物学特性[J].中国比较医学杂志,2010,20(10):19-22.
[9] Wang JP,Wang LH,Cai L.Establishment of a transplantation tumor model of human osteosarcoma in chick embryo[J].Chin-Germ J Clin Oncol,2009,8(9):531 -536.
[10] 于文静,赵静,连波,等.人大肠癌鸡胚尿囊膜移植模型的建立及血管生成特征的观察[J].中国比较医学杂志,2012,22(3):32-35.
[11] 张治业.蜈蚣藻多糖对人神经胶质瘤U87细胞及其裸鼠移植瘤生长的抑制作用[J].重庆医科大学学报,2011,36(9):1051-1053.
[12] Hanahan D,Weinberg RA.Hallmarks of cancer:the next generation[J].Cell,2011,144(5):646 -674.
[13] Hagedorn M,Javerzat S,Gilges D,et al.Accessing key steps of human tumor progression in vivo by using an avian embryo model[J].PNAS 2005,102(5):1643 -1648.
[14] Hagedorn M,Zilberberg L,Wilting J,et al.Domain swapping in a COOH-terminal fragment of platelet factor 4 generates potent angiogenesis inhibitors[J].Cancer Res,2002,4(2):6884-6890.
