非洲猪瘟病毒CD2v胞外区蛋白多克隆抗体的制备及其应用
2023-01-31姜文廷王嘉宾石雪建杜永坤蒋大伟姬鹏超张改平
姜文廷,王嘉宾,石雪建,万 博,杜永坤,蒋大伟,姬鹏超,张改平
(河南农业大学 国家动物免疫学国际联合研究中心,河南 郑州 450002)
非洲猪瘟(African swine fever,ASF)是由ASFV感染引起的高度致病性、传染性疾病,可感染各年龄段的家猪和野猪,家猪感染高致病性毒株突发高热后即死亡,致死率高达100%,是世界动物卫生组织法定报告的通报性疾病[1-3]。
ASFV是一种大型双链DNA病毒,基因组大小170~193 kb,由中心保守区和两端可变区组成,具有151~167个开放阅读框,编码50多种结构蛋白[4],是非洲猪瘟病毒科、非洲猪瘟病毒属的唯一成员[5],主要感染家猪、野猪和软蜱虫,是目前发现的仅有的以昆虫为传播媒介的DNA病毒[6]。
CD2v蛋白由EP402R(8DR)基因编码,是位于ASFV粒子的外囊膜上的特征性糖基化蛋白,介导病毒粒子和感染细胞的血吸附,在病毒感染的晚期表达活跃[7-8]。EP402R基因在ASFV感染细胞中表达,可以检测到105~110 kDa的糖基化全长形式[9]。全长表达的CD2v蛋白分为胞外区、跨膜区和胞质区。胞外区由1个信号肽和2个IgG样结构域组成,与T细胞黏附分子CD2同源,在结构和功能上具有相似性,能够与猪红细胞表面的受体结合,参与病毒在体内的运输。跨膜区为单次跨膜结构,胞质区末端有两簇富含脯氨酸的重复序列,不同菌株间该重复序列的长度不同,可作为一种遗传标记来示踪病毒的传播[10]。该序列可以介导蛋白通过内吞作用进入细胞,被认为是一种细胞穿透肽(cell penetrating peptide,CPP),具有潜在的应用价值[11]。
本研究利用生物信息学方法对CD2v蛋白氨基酸序列进行分析,截取其胞外区序列并利用真核表达系统进行表达,蛋白经纯化后免疫家兔制备多克隆抗体,为CD2v蛋白功能的进一步研究奠定基础,也可用于野毒株与CD2v基因缺失毒株鉴别诊断方法的建立。
1 材料与方法
1.1 细胞、菌株和质粒293 F细胞和pcDNA3.1(+)载体由本实验室保存;JM109感受态细胞购自上海唯地生物技术有限公司;CD2v胞外区基因根据真核表达系统进行密码子优化后连入pUC57载体,重组质粒由GeneScript公司合成,命名为ASFV-CD2v-pUC57。
1.2 实验动物清洁级新西兰雌性大白兔,体质量2.5 kg,购自郑州鼎国生物技术有限公司。
1.3 主要试剂Q5®热启动高保真DNA聚合酶、NheⅠ/EcoRⅠ 限制性核酸内切酶均购自NEB公司;EasyPure®Plasmid MiniPrep Kit、EasyPure®PCR Purification Kit均购自北京全式金生物技术有限公司;SMM 293-TⅡExpression Medium、Sinofection转染试剂均购自义翘神州生物技术有限公司;Lipofectamine 2000转染试剂、胎牛血清、Opti-MEM®Ⅰ减血清培养基均购自Thermo公司;高糖DMEM培养基购自上海源培生物科技股份有限公司;AEC酶底物试剂盒购自北京中杉金桥生物技术有限公司;HisTrap Excel购自Cytiva公司。
1.4 主要仪器基因扩增仪购自AnalytikJena公司;多功能凝胶成像系统、超灵敏多功能成像仪购自Bio-RAD公司;冷冻离心机购自Eppendorf公司;倒置荧光显微镜购自Olympus Corporation公司;振荡培养箱购自INFORS公司等。
1.5 方法
1.5.1CD2v蛋白氨基酸序列的生物信息学分析 参照NCBI公布的China/2018/AnhuiXCGQ基因序列(登录号:MK128995.1),对ASFV EP402R基因序列进行分析,跨膜结构预测使用在线软件服务器TMHMM-2.0(https://services.healthtech.dtu.dk/service.php?TMHMM-2.0);疏水性预测使用在线软件服务器ProtScale(https://web.expasy.org/protscale);信号肽预测使用SignalP-4.1(http://www.cbs.dtu.dk/services/SignalP-4.1/)。
1.5.2CD2v胞外区蛋白氨基酸序列比对分析 参照从NCBI下载的国内各地区(登录号:MN172368.1、MN393476.1、MK333180.1、MK333181.1、MK-645909.1、MN393477.1、MT496893.1、MK940252.1)及国外流行株(登录号:NC_044947.1、NC_044959.2、NC_044958.1、NC_001659.2、NC_044943.1)的ASFV EP402R全基因序列,使用在线工具TMHMM-2.0进行跨膜区预测,截取胞外区氨基酸序列与截短的目的片段使用DNAMAN软件进行氨基酸序列比对。
1.5.3引物设计与扩增 以ASFV-CD2v-pUC57为模板,用SnapGene 4.1.9软件设计特异性引物,上游引物F:5′-GCTAGCATGATCATCCTGATC-TTC-3′;下游引物R:5′-GAATTCTCACATCATCACCATCACCACGTACAGCTTAAAGAA-3′(下划线分别为Nhe Ⅰ、EcoR Ⅰ 酶切位点和6×His标签),由上海生工生物工程有限公司合成。PCR反应程序:98℃ 30 s;98℃ 10 s,58.5℃ 30 s,72℃ 30 s,共30个循环;72℃延伸8 min,4℃保存。PCR产物经1%琼脂糖凝胶电泳鉴定后用EasyPure®PCR Purification Kit按照说明书方法回收。
1.5.4表达载体构建 将回收的PCR产物与pcDNA3.1(+)载体分别进行双酶切,37℃酶切4 h,跑胶鉴定正确后回收。将回收的载体和目的片段酶切产物进行连接,16℃连接2 h后转化JM109感受态细胞,将菌液涂布于Amp抗性的LB平板,37℃倒置培养过夜。挑取单克隆进行菌液PCR鉴定(阴性对照模板设为LB)和双酶切鉴定(阴性对照为未酶切的质粒)。将初步鉴定正确的克隆送北京擎科生物科技有限公司测序。
1.5.5蛋白的表达与鉴定 293 F细胞在37℃、5% CO2条件下培养至细胞密度为2.5×106/mL,活率大于95%。将重组质粒与Senofection配制成转染复合物转染细胞,同时转染pcDNA3.1(+)空载体设为阴性对照,转染24 h后开始按比例添加补料,每隔24 h添加1次,并收集细胞检测蛋白表达情况。抽取1 mL转染细胞,500×g离心5 min,上清用0.22 μm滤膜过滤后置于冰上,细胞用预冷PBS清洗3遍后加细胞裂解液裂解。将培养上清和裂解上清进行SDS-PAGE电泳,转印至PVDF膜,分别以His单抗和ASFV阳性血清、ASFV阴性血清作为一抗鉴定目的蛋白的表达。
1.5.6CD2v胞外区蛋白的纯化 收集转染后5 d的细胞上清,经0.22 μm滤膜过滤,用Ni-NTA层析柱进行亲和层析,收集洗脱下的目的蛋白,经透析浓缩和除盐后测定蛋白质量浓度为2.1 g/L,抽取30 μg 蛋白用PBS稀释后进行SDS-PAGE检测。
1.5.7CD2v蛋白与ASFV阳性血清的反应 通过间接ELISA方法测定抗体效价。具体方法:用CBS(pH9.6)稀释CD2v蛋白至1 mg/L,每孔100 μL 于4℃条件下包被过夜,洗板后加脱脂奶进行封闭。加入倍比稀释的ASFV阳性血清,每孔100 μL,ASFV阴性血清设为阴性对照,每组3个复孔,37℃孵育1 h;加入1∶5 000稀释的HRP-羊抗猪IgG二抗,37℃孵育1 h;加入TMB双组分显色液进行显色,读取D450 nm,使用GraphPad Prism 8.0.2软件取平均值进行分析并作图,以阳性∶阴性(P/N)≥ 2.1结果判定为阳性。
1.5.8多克隆抗体的制备 将体质量2.5 kg健康雌兔在新环境中稳定适应1周,通过耳缘静脉采血2 mL,分离血清于-20℃条件下保存,标记为兔阴性血清。初次免疫将蛋白用PBS稀释后与弗氏完全佐剂按体积比为1∶1混合进行乳化,每只家兔背部多点皮下注射免疫100 μg。分别在第3,5,7周进行二免、三免和四免。三免后7~10 d通过耳缘静脉采血分离血清,Western blot鉴定阳性后于四免后第10天通过大腿动脉放血制备抗血清,分装后于-80℃ 存放。
1.5.9多克隆抗体的效价测定 采用间接ELISA方法测定多克隆抗体与CD2v蛋白的结合效价,参照方法1.5.7。
1.5.10多克隆抗体的Western blot鉴定 将纯化的CD2v胞外区蛋白用PBS稀释后按每泳道2 μg蛋白制样,参照1.5.5方法进行Western blot检测。
1.5.11多克隆抗体的IPMA鉴定 将PK-15细胞接种于24孔板,待细胞密度长至70%时转染重组质粒,并转染空载体设为阴性对照;转染6~8 h后换液继续培养至24 h,用PBS洗去残余培养基,固定细胞并进行封闭,加入1∶2 000稀释的多克隆抗体37℃孵育1 h;TBST洗5遍后,加入HRP-羊抗兔二抗IgG,37℃孵育1 h;加入AEC显色液室温显色15 min,用自来水清洗终止反应于倒置显微镜下观察。
1.5.12多克隆抗体的IFA鉴定 参照1.5.11方法,将PK-15细胞接种于细胞爬片,转染36 h后固定,一抗为1∶2 000稀释的多克隆抗体,二抗为1∶500稀释的FITC-羊抗鼠IgG,避光干燥后于倒置荧光显微镜下观察结果。
2 结果
2.1 CD2v蛋白氨基酸序列的生物信息学分析EP402R基因经生物信息学软件预测其跨膜区(图1A)及疏水性(图1B)及信号肽(图1C),预测结果显示:胞外区为1~206 aa,跨膜区为207~229 aa,胞内区为230~360 aa,信号肽1~22 aa。
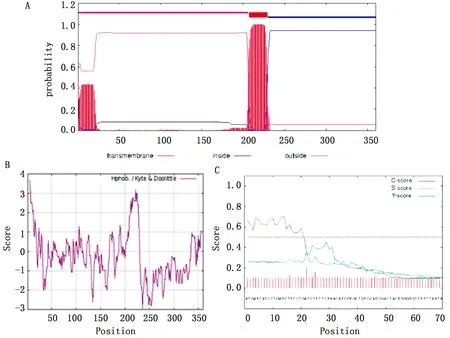
图1 CD2v蛋白的跨膜区(A)、疏水性(B)及信号肽(C)分析结果
2.2 CD2v胞外区蛋白的氨基酸序列比对分析将截短的CD2v胞外区序列与选取的13株ASFV流行株的CD2v胞外区序列用DNAMAN软件进行氨基酸序列比对,序列相似性为84.16%(图2),其中与8株国内流行性株相似性高达100.00%,与5株国外流行株相似性为79.64%,在国外流行株中与典型高致病性流行株Georgia 2007/1(登录号:NC_044959.2)序列相似度高达100.00%。

图2 CD2v胞外区蛋白的氨基酸序列比对结果
2.3 CD2v胞外区蛋白重组质粒的构建以ASFV-CD2v-pUC57为模板设计特异性引物进行扩增,经1%琼脂糖凝胶电泳,得到约为651 bp大小的特异性条带(图3A),与预期大小相符;挑选的阳性克隆经菌液PCR鉴定,特异性条带大小约为651 bp,与预期相符(图3B);重组质粒经双酶切鉴定,可见载体和目的片段(图3C);测序结果显示目的基因插入位置正确,无缺失和移码突变。
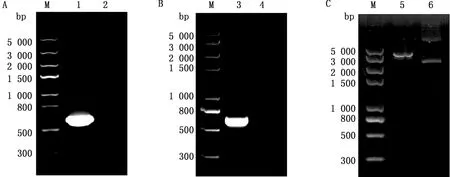
A.CD2v胞外区基因PCR扩增结果(M.Trans 5K Marker;1.PCR扩增;2.阴性对照);B.重组质粒菌液PCR鉴定结果(M.Trans 5K Marker;3.菌液PCR;4.阴性对照);C.重组质粒双酶切鉴定结果(M.Trans 5K Marker;5.双酶切;6.阴性对照)
2.4 CD2v胞外区蛋白的表达鉴定收集转染细胞的培养基,利用His单抗和ASFV阳性血清进行Western blot鉴定。结果显示,CD2v胞外区蛋白能够与His单抗(图4A)和ASFV阳性血清(图4B)发生特异性反应,蛋白的相对分子质量大小为63~89 kDa,蛋白发生糖基化,呈弥散状条带。为检测CD2v胞外区蛋白的表达规律,收集转染后1~8 d的细胞上清用His单抗进行检测,结果显示目的蛋白在转染后第2天开始大量表达,至转染后第8天,表达量逐渐增高,检测期间没有显示出其他非特异性蛋白的表达(图4C)。

A.CD2v胞外区重组蛋白与His单抗反应的Western blot检测(M.蛋白Marker;1.细胞上清;2.阴性对照);B.CD2v胞外区重组蛋白与ASFV阳性血清反应的Western blot检测(M.蛋白Marker;1.细胞上清;2.阴性对照);C.转染后1~8 d CD2v胞外区重组蛋白在293 F细胞中的表达鉴定(M.蛋白Marker;1~8.1~8 d细胞上清;9.阴性对照)
2.5 CD2v胞外区重组蛋白的纯化收集转染后的培养基上清进行亲和层析纯化,纯化后的CD2v胞外区蛋白经SDS-PAGE电泳鉴定,可见大小为63~89 kDa的弥散条带,目的条带较为单一,与图4A相符,表明CD2v胞外区蛋白亲和层析纯化效果良好(图5)。
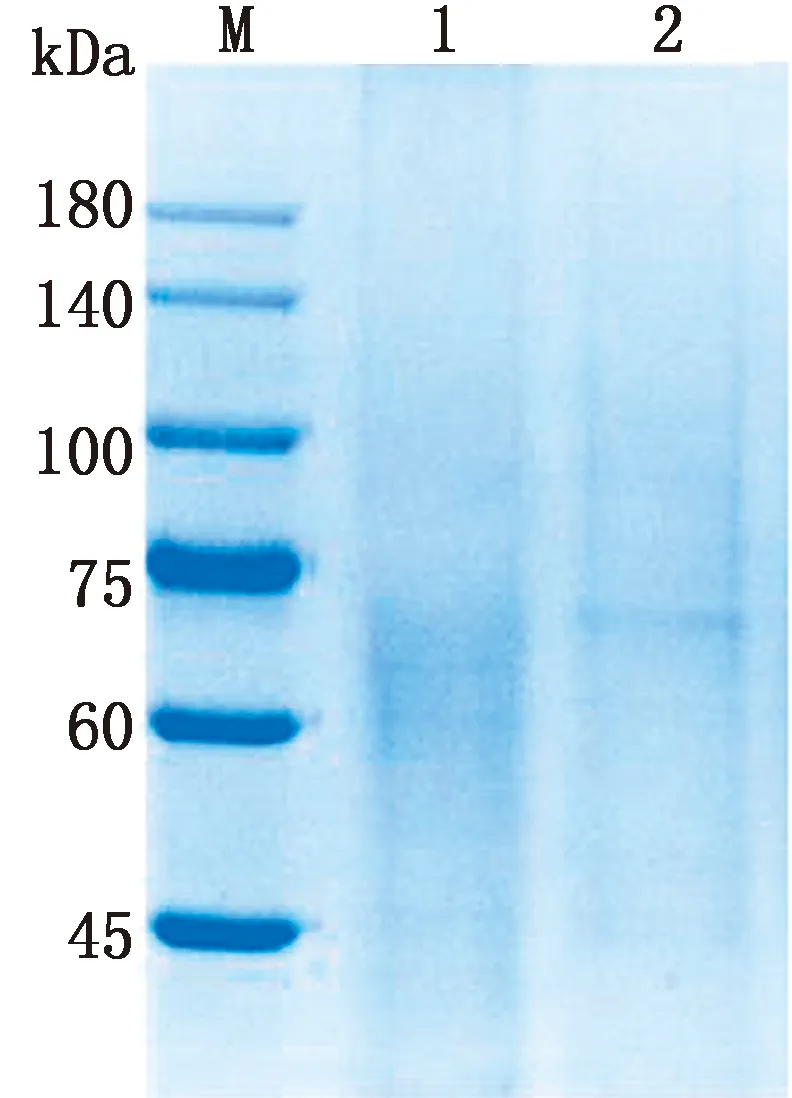
M.蛋白Marker;1.纯化后;2.纯化前
2.6 CD2v蛋白与ASFV阳性血清的抗原性反应利用间接ELISA方法检测CD2v蛋白与ASFV阳性血清的反应,读取D450 nm,取平均值进行分析,以阳性∶阴性(P/N)≥ 2.1结果判定为阳性。结果显示ASFV阳性血清抗体效价为1∶32 000(图6)。
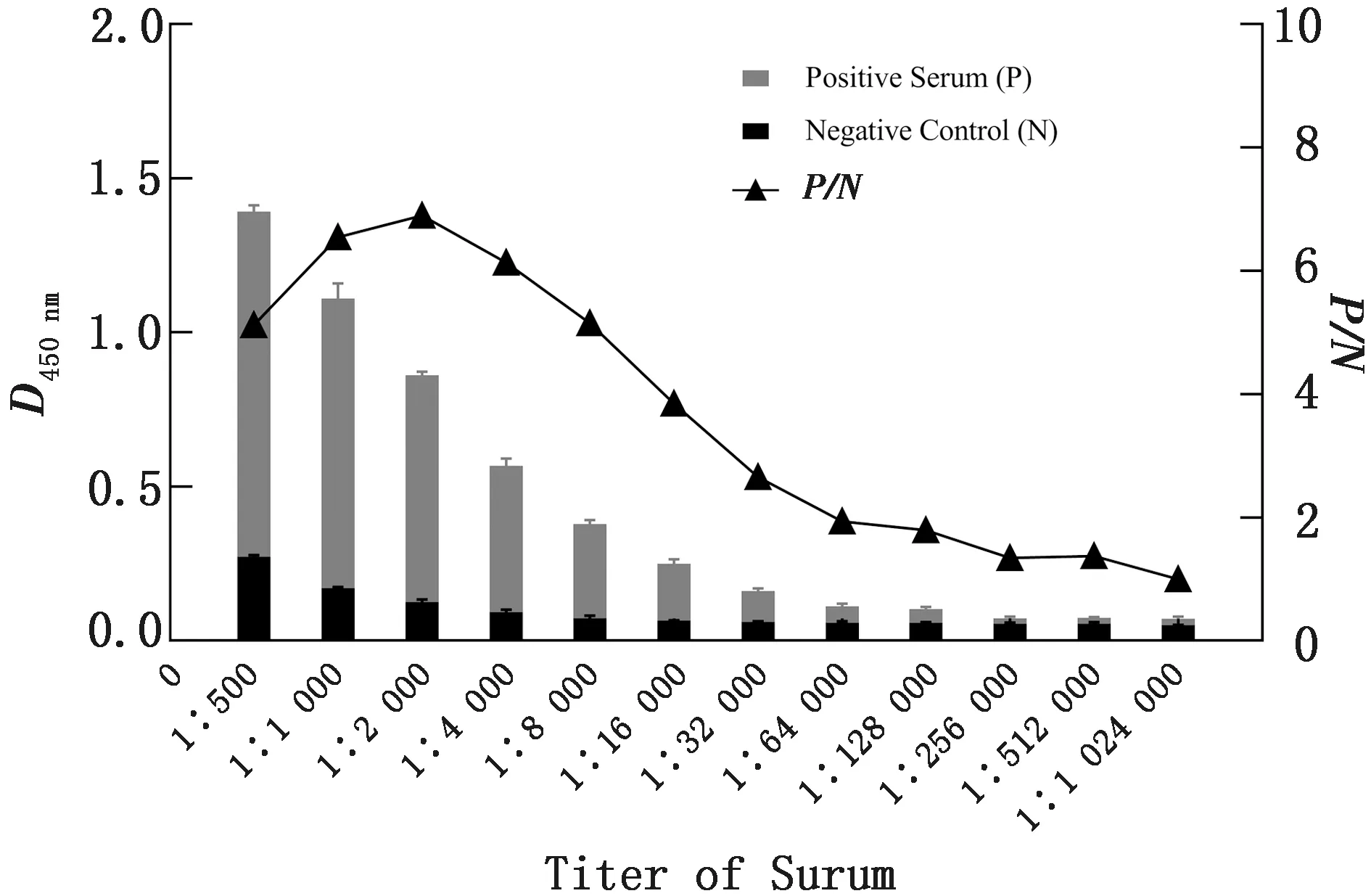
图6 CD2v蛋白与ASFV阳性血清的反应
2.7 多克隆抗体的抗体效价测定利用间接ELISA方法测定多克隆抗体的效价,兔抗血清和兔阴性血清分别倍比稀释后加入作为一抗,显色终止后读取D450 nm,以阳性∶阴性(P/N)≥ 2.1结果判定为阳性。结果兔抗血清效价为1∶1 024 000(图7)。
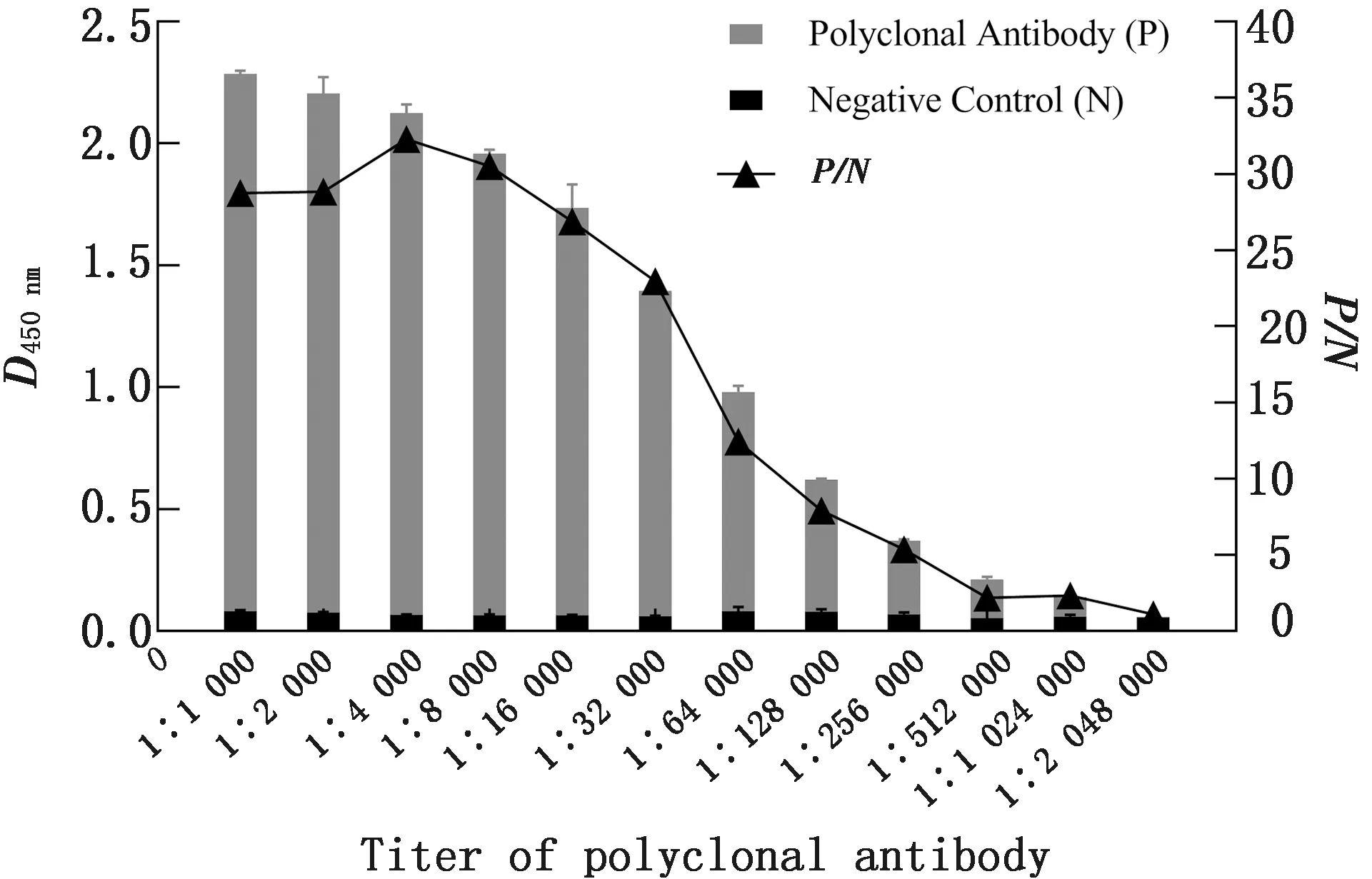
图7 多克隆抗体的抗体效价测定结果
2.8 多克隆抗体的Western blot鉴定以1∶2 000稀释的兔多克隆抗体作为一抗,兔阴性血清为阴性对照,对CD2v胞外区蛋白进行检测,检测到大小与预期相符的蛋白条带(图8A),阴性对照组中没有检测到目的蛋白(图8B)。表明制备的多克隆抗体特异性良好,能够用于CD2v胞外区蛋白的Western blot检测。

A.兔多克隆抗体;B.兔阴性血清。M.蛋白Marker;1.CD2v蛋白
2.9 多克隆抗体的IPMA鉴定将重组质粒转染PK-15细胞(图9A),同时转染空载体质粒设为阴性对照(图9B),转染后24 h将细胞固定,加入1∶500稀释的兔多克隆抗体作为一抗,在显微镜下可观察到明显的染色细胞。表明制备的多克隆抗体能够用于CD2v蛋白的IPMA检测。
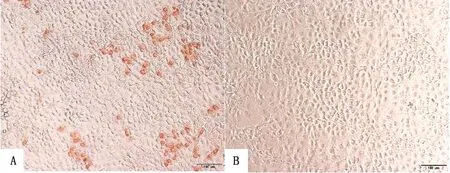
A.转染CD2v胞外区重组质粒的PK-15细胞;B.转染空载质粒的PK-15细胞
2.10 多克隆抗体的IFA鉴定将重组质粒转染PK-15细胞(图10A),设阴性对照同2.9(图10B),以1∶500稀释的兔多克隆抗体作为一抗,在荧光显微镜下可观察到明显的染色细胞。表明制备的多克隆抗体可用于CD2v蛋白的IFA检测。
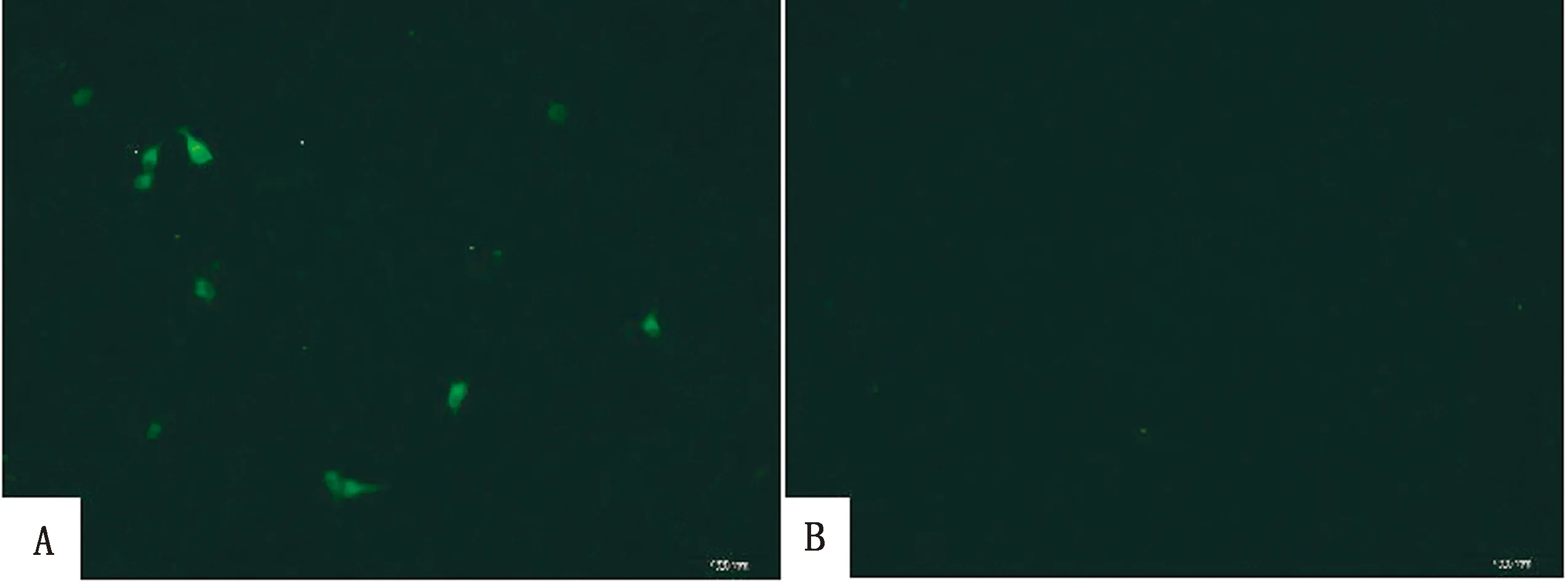
A.转染CD2v胞外区重组质粒的PK-15细胞;B.转染空载质粒的PK-15细胞
3 讨论
ASF疫情于1921年在肯尼亚首次被报道[12],随后欧洲、南美洲、亚洲的多个国家均先后暴发了ASF疫情。虽然ASF不是一种人畜共患疾病[13],但ASF疫情的暴发在全球养猪业造成严重的经济损失,对ASFV感染机体的免疫保护机制认识不足,导致ASF疫苗的研究有很大的局限性。
灭活疫苗作为初次被尝试研发的疫苗,免疫机体后没有表现出明显的免疫保护效果,后来通过试验发现即使加以高效佐剂也不能产生有效的免疫保护[14]。针对ASFV的毒力基因和逃逸相关基因研发的核酸疫苗、亚单位疫苗、活载体疫苗、基因缺失疫苗以及分离出的减毒活疫苗,都没有或部分表现免疫保护效果[14-19],因此目前的控制措施主要依赖于检测和捕杀受感染的动物。一些自然分离的ASFV弱毒株表现为血吸附现象的缺失[20-22],或CD2v基因的突变[23],研究发现通过缺失CD2v基因产生的ASFV 弱毒株取得了良好的免疫保护效果[24],尽管减毒活疫苗的开发面临着许多问题与挑战,但仍被认为是实现交叉保护的理想工具[25]。一旦ASFV减毒活疫苗开发成功,将被广泛应用于ASF疫情的防控,因此需要来区分野生型和缺失疫苗株感染[26],且由于CD2v缺失株和野生型在毒力和致病性方面的表现差异,一种有效的检测方法也可以用来辅助评估ASF疫情的发展趋势,采取更有效的防治措施以减少损失。
制备高质量和高效价的CD2v蛋白多克隆抗体是研究CD2v蛋白功能的基础。本研究选择了ASFV CD2v蛋白的胞外结构域,以其自身信号肽作为分泌信号,使其在培养细胞中分泌表达,表达的蛋白大小为63~89 kDa,与真核表达的一些糖基化蛋白具有相似的特征[27-29],可能是蛋白在细胞中糖基化程度的不同导致了蛋白相对分子质量不均一。ELISA检测该糖基化蛋白与ASFV阳性血清反应效价可达1∶32 000,在1 000倍稀释后D450 nm仍可达到1.0。制备的兔抗ASFV CD2v胞外区蛋白多克隆抗体,能够识别细胞中表达的CD2v蛋白,可用于CD2v蛋白的 ELISA、Western blot、IPMA和IFA检测,具有很强的特异性和亲和力,为进一步研究CD2v蛋白的功能和ASFV鉴别诊断方法的建立奠定了基础。
