云芝葡聚糖对非洲猪瘟病毒的体外抑制作用
2023-01-31刘欣媛李连峰仇华吉
刘欣媛,孙 元,李 素,李连峰,仇华吉
(中国农业科学院 哈尔滨兽医研究所 兽医生物技术国家重点实验室,黑龙江 哈尔滨 150069)
非洲猪瘟(African swine fever,ASF)是由非洲猪瘟病毒(African swine fever virus,ASFV)引起的一种急性、烈性、高度接触性传染病,猪只感染后病死率高达100%[1]。ASFV于1921年在肯尼亚首次被发现[2],直至今日已传播至全球多个国家,给养猪业造成了巨大的经济损失。ASF自2018年8月在我国暴发以来,疫情迅速蔓延全国,造成了大量生猪发病死亡,给我国的养猪业带来了毁灭性的打击,同时也对我国经济和社会构成了巨大的威胁。目前对ASF的防控主要还是依靠检测和扑杀,考虑到经济及社会因素,改进防控策略如研发疫苗、开发抗病毒药物等迫在眉睫。
抗病毒药物可依据作用靶标大致分为2种:一是作用于ASFV复制相关宿主因子的药物;二是作用于ASFV蛋白或核酸本身的药物。目前已报道了许多靶向宿主细胞蛋白的抗病毒药物,例如芫花素能够抑制ASFV侵入和释放、病毒早期和晚期蛋白以及病毒DNA的合成[3-4]。因此,面对ASF疫情的持续传播,开发抗病毒药物在未来的研究和应用中可能会具有更广阔的前景,开发一种安全、有效的抗病毒药物以缓解ASF疫情的蔓延和暴发是十分必要的。
云芝(Coriolusversicolor),也称杂色云芝,属担子菌亚门多孔菌科真菌。云芝分布广泛,是最具药用价值的真菌之一。云芝的主要活性成分是云芝葡聚糖(Coriolusversicolor-derived polysaccharides,CVP),目前认为该成分具有抗肿瘤、抗氧化、免疫调节以及抗病毒作用[5]。研究表明,CVP在体内外均具有抵抗鼠伤寒沙门菌感染的作用;CVP可诱导细胞产生干扰素、白细胞介素等细胞因子,也可通过激活巨噬细胞和T淋巴细胞来刺激免疫应答[5]。CVP表现出潜在的抗病毒能力,同时还具有提取方便、生产周期短、价格相对低廉、性质稳定、运输方便等优点,因此在应对ASF疫情时具有开发及规模应用的前景。
1 材料与方法
1.1 药物与试剂CVP溶液由安徽省农业科学院畜牧兽医研究所石少华博士馈赠,以磷酸盐缓冲液(phosphate buffered saline,PBS)为溶剂配制成1 g/L 溶液,储存于4℃[5]。RPMI-1640培养基、胎牛血清(fetal bovine serum,FBS)和青霉素-链霉素(双抗)等购自Gibco公司;RT-qPCR相关试剂及分子生物学试剂均购自TaKaRa公司;病毒DNA和细胞总RNA提取试剂盒均购自杭州博日科技公司;细胞增殖-毒性检测试剂盒(cell counting kit-8,CCK-8)购自东仁化学科技公司。
1.2 细胞培养与病毒株根据CARRASCOSA等[6]报道的方法,通过支气管灌洗制备原代猪肺泡巨噬细胞(porcine alveolar macrophage,PAM),并在含10% FBS、2% 双抗的RPMI-1640培养基中生长,培养条件为37℃、5% CO2。本研究中使用的表达增强型绿色荧光蛋白(EGFP)的ASFV报告病毒(ASFV-HLJ/18-ΔI7L)由本实验室构建并保存。ASFV-HLJ/18-ΔI7L是以亲本病毒ASFV/HLJ-18株为骨架,缺失I7L基因并替换为完整的EGFP基因,经纯化得到的重组病毒,此重组病毒与ASFV/HLJ-18株生长曲线一致、复制动力学无差异。
1.3 病毒基因组拷贝数测定使用自动核酸提取仪及配套的病毒DNA提取试剂盒提取ASFV基因组DNA,利用KING等[7]推荐的OIE荧光定量PCR法检测ASFV的病毒基因组拷贝数,引物及探针见表1。

表1 ASFV荧光定量PCR引物及探针
1.4 病毒滴度测定将PAM培养于96孔板(5×104个/孔)中,收集细胞培养上清进行10倍倍比稀释,取稀释后的病毒液100 μL接种于96孔板中,每个稀释度设置8个重复孔,同时设立对照组,置于37℃、5% CO2条件培养5 d,使用倒置荧光显微镜观察并记录96孔板中细胞出现荧光的细胞孔数,按照Reed-Muench方法计算病毒的半数组织培养感染量(50% tissue culture infective dose,TCID50)。
1.5 细胞毒性试验将PAM培养于96孔板(5×104个/孔)中,将质量浓度分别为6.25,12.50,25.00,50.00,100.00,200.00,400.00和800.00 mg/L的CVP溶液加入96孔板中,每个质量浓度设置4个重复孔,以PBS缓冲液作为对照。将细胞置于37℃、5% CO2条件培养72 h,每孔加入10 μL CCK-8试剂,37℃孵育2 h,使用酶标仪测定450 nm波长处的光密度值(D450 nm),并计算不同质量浓度CVP处理下的细胞活力及半数细胞毒性浓度(50% cell cytotoxicity,CC50)。
1.6 体外抑制病毒试验将PAM培养于24孔板(106个/孔)中,置于37℃、5% CO2条件培养12 h。将报告病毒ASFV-HLJ/18-ΔI7L以感染复数(MOI)= 0.1的剂量感染PAM,感染后2 h弃去病毒液,用PBS洗涤1次,试验组分别换为含有1.562 5,3.125 0,6.250 0,12.500 0,25.000 0,50.000 0和100.000 0 mg/L CVP的新鲜培养基,而对照组则换为不含CVP的新鲜培养基。将细胞置于37℃、5% CO2条件培养72 h,收取细胞培养上清检测病毒基因组拷贝数及子代病毒滴度,评价CVP抗ASFV感染的效果,并计算半数抑制浓度(50% maximal inhibitory concentration,IC50)。
1.7 体外杀灭病毒试验参考SIRAKANYAN等[8]报道的方法,将PAM培养于24孔板(106个/孔)中,将MOI=0.1的ASFV-HLJ/18-ΔI7L悬液与质量浓度为25 mg/L的CVP于体外37℃孵育1 h,随后将混合液稀释至CVP质量浓度达IC50以下,弃去24孔板中的细胞培养基,将稀释后的混合液加入PAM培养孔中。将细胞置于37℃、5% CO2条件培养72 h,收取细胞培养上清检测病毒基因组拷贝数及子代病毒滴度,以评价CVP体外直接杀灭ASFV的效果。
1.8 动力时间窗试验按照HUANG等[9]介绍的方法,将PAM培养于24孔板(106个/孔)中,用质量浓度为25 mg/L CVP溶液分别在病毒感染前2,6和12 h处理PAM,以MOI = 0.1的剂量将ASFV-HLJ/18-ΔI7L感染PAM(此时记为0 h),感染后2 h弃去病毒液,用PBS洗涤1次,换为含10% FBS的新鲜培养基。由于ASFV的复制周期约为18 h,我们分别在病毒感染后的不同时间点(0,2,4,8,12和16 h)加入CVP(25 mg/L)。将细胞置于37℃、5% CO2条件培养24 h,收取细胞培养上清检测病毒基因组拷贝数及子代病毒滴度,以初步确定CVP抑制ASFV复制的阶段。
1.9 细胞因子转录水平测定将PAM培养于24孔板(106个/孔)中,将质量浓度为25 mg/L CVP溶液提前6 h加入PAM,以MOI=0.1的剂量将ASFV-HLJ/18-ΔI7L感染细胞,感染后2 h弃去病毒液,用PBS洗涤1次,换为含10% FBS的新鲜培养基,将细胞置于37℃、5% CO2条件培养48 h。弃去细胞培养基,收集细胞样品并提取细胞总RNA,反转录为cDNA,以此为模板进行荧光定量PCR检测,以GAPDH为内参基因,采用2-ΔΔCt法计算目的基因的mRNA水平,相关引物序列见表2。

表2 荧光定量PCR引物
1.10 生物安全声明所有涉及ASFV活病毒操作的试验均在经农业农村部和中国合格评定国家认可委员会批准的中国农业科学院哈尔滨兽医研究所的P3级生物安全实验室内进行。
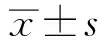
2 结果
2.1 CVP对PAM的细胞毒性利用CCK-8试剂测定CVP对PAM的细胞毒性。结果显示,高质量浓度的CVP对PAM显示出明显的细胞毒性作用。当CVP质量浓度为400~800 mg/L时,PAM的细胞活力仅为0%~20%,与对照组相比差异极显著(P<0.000 1);当CVP的质量浓度为100~200 mg/L 时,PAM的细胞活力为80%左右,与对照组相比差异显著(P<0.01);当CVP的质量浓度在50 mg/L及以下时,其不会影响PAM的细胞活力(P>0.05)(图1A),同时在显微镜下观察相应试验组与对照组细胞形态无明显差异。计算得到CVP的CC50为270.100 mg/L(图1B)。

1.CCK-8法检测CVP对PAM的细胞毒性;B.采用非线性回归分析法计算CC50
2.2 CVP抑制ASFV复制的效果在37℃、5%CO2的培养条件下,将ASFV-HLJ/18-ΔI7L感染PAM并持续孵育2 h,以确保病毒粒子完全侵入细胞。结果表明,随着CVP质量浓度的增加,ASFV基因组拷贝数和子代病毒滴度明显降低。1.562 5,3.125 0,6.250 0和12.500 0 mg/L的CVP抑制ASFV 复制的效果显著(P<0.01);25,50和100 mg/L 的CVP抑制ASFV复制的效果极显著(P<0.000 1)。25 mg/L CVP不影响PAM的细胞活力,同时其抑制ASFV复制的效果最显著,因此我们选定25 mg/L作为后续试验使用的CVP的质量浓度(图2A、B)。上述结果证实,CVP可以抑制ASFV的复制,其抑制效果呈现一定的剂量依赖性,其IC50为0.957 5 mg/L(图2C)。

A.ASFV基因组拷贝数;B.子代病毒滴度;C.采用非线性回归法计算IC50
2.3 CVP体外直接杀灭ASFV效果结果显示,质量浓度为12.5,25.0和50.0 mg/L的CVP试验组与对照组相比,ASFV基因组拷贝数和子代病毒滴度无显著性差异(P>0.05)(图3A、B),说明CVP不具备体外直接灭活ASFV的能力,其并未直接作用于ASFV。

A. ASFV基因组拷贝数;B.子代病毒滴度
2.4 不同时间加入CVP对ASFV复制的影响将CVP在ASFV复制周期的不同时间点处理PAM(图4A),以初步确定该药物抑制ASFV复制的具体阶段。结果显示,在ASFV感染前6~12 h使用25 mg/L CVP处理PAM,其抑制病毒复制的效果最为明显(P<0.000 1);而随着CVP处理时间点的延后,其对ASFV复制的抑制效果逐渐减弱;在病毒粒子释放阶段使用该药物处理已不能有效阻止病毒复制(P>0.05)(图4B、C)。以上结果提示,CVP可能在病毒感染前通过诱导PAM产生某种(些)细胞因子而发挥抑制ASFV复制的作用。

A.检测CVP影响ASFV复制阶段模式图;B.ASFV基因组拷贝数;C.子代病毒滴度
2.5 CVP通过激活细胞因子发挥抗病毒功能IL-1β、IL-6、IL-8和TNF-α是重要的抗病毒细胞因子[10-13],已有研究报道,β-葡聚糖可以激活宿主细胞上述部分细胞因子[14]。因此,我们利用荧光定量PCR方法检测CVP处理PAM后,相关细胞因子的mRNA水平,进而评估该药物能否通过诱导抗ASFV细胞因子来发挥抗病毒功能。结果显示,与对照组相比,试验组中IL-1β、IL-6、IL-8和TNF-α的mRNA水平分别增加了近8,4,6和4倍(图5)。以上结果显示,CVP通过激活宿主抗病毒细胞因子,尤其是炎症相关细胞因子的表达进而抑制ASFV复制。

图5 CVP对PAM细胞因子转录水平的影响
3 讨论
ASF在全球大部分地区广泛流行且造成了严重的危害,我国于2018年8月发生首例ASF疫情[15],随后全国各地不断有疫情出现,导致大量生猪发病死亡,给我国养猪业带来了巨大灾难[16]。由于ASFV结构复杂,基因组较长,免疫逃逸机制十分复杂,以致现阶段对ASFV保护性免疫知之甚少,迄今为止仍无有效疫苗和抗病毒药物问世[17-18]。有效且安全的抗病毒药物可以在疫情暴发的情况下提供保护,从而有助于遏制疫情并为养殖户争取更多的时间寻找应对措施[19]。因此,开发针对ASFV的抗病毒药物显得尤为迫切。
ASFV主要感染骨髓细胞、巨噬细胞和树突状细胞等抗原递呈细胞,这些细胞均在免疫系统中发挥关键作用[20]。目前大多数抗ASFV的药物为化学合成药物,本研究中使用的CVP为一种人工提取的天然药物,考虑到天然药物具有的纯天然、安全无害、原料易获得和提取工艺成熟等特点,故欲探究其抑制ASFV的可能性。本研究对CVP体外抑制ASFV复制效果进行了评估。试验使用的报告病毒ASFV-HLJ/18-ΔI7L为本实验室构建并保存的病毒株,该毒株与亲本毒株复制动力学无差异,可代替亲本病毒作为报告病毒用于药物筛选和评估试验。首先检测该药物对PAM的细胞毒性,确定了该药物不影响PAM细胞活力的质量浓度范围,并计算其CC50为270.100 0 mg/L;验证了该药物可以在体外抑制ASFV的复制,确定了CVP有效且安全的最佳质量浓度为25 mg/L,计算该药物的IC50为0.957 5 mg/L;随后为探索CVP发挥抗病毒作用的机制,先排除了该药物直接灭活ASFV的可能性,这也与多数抗病毒药物的作用机制一致,并不直接作用于病毒[21];通过在病毒复制周期的不同时间点加入CVP,来确定其发挥抗病毒功能的阶段,结果表明在ASFV感染前6~12 h使用CVP处理PAM,其抑制病毒复制的效果最为明显,因此猜测是否该药物在病毒感染前已诱导PAM某些细胞因子表达上调而抑制ASFV复制。IL-1β、IL-6、IL-8和TNF-α是重要的抗病毒细胞因子,本试验检测结果也证实了CVP处理细胞后,上述细胞因子均表达上调;CVP通过激活细胞因子尤其是炎症通路相关细胞因子表达,以从初始阶段就抑制了病毒的感染进而抑制病毒复制,这可能是CVP一类天然抗病毒药物发挥抗病毒活性的普遍机制。
CVP的抗ASFV效果的确弱于特异性的抗ASFV化学药物。本研究认为这是由于CVP是通过激活宿主一些炎症通路细胞因子进而发挥抗病毒功能,这些细胞因子通常作为广谱的抗病毒因子,并不能特异性抵抗某种病毒的感染,这也使得CVP可能成为一种广谱性的天然抗病毒药物。本研究结果也带给两点提示,一是天然广谱抗病毒药物或许可以作为辅助性抗病毒药物使用;二是想要开发安全有效的抗ASFV药物,还是应着眼于特异性作用于ASFV复制相关元件的药物。
面对ASF疫情的挑战,现阶段主要是预防为主,通过消毒、快速诊断、禁止患病动物贸易以及扑杀患病动物来控制疫情的传播。对于ASFV感染与宿主免疫反应间的博弈关系也正逐渐被发现,不断了解ASFV复制和致病机制的过程,即是开发抗ASFV药物靶点的过程。本研究为开发天然抗ASFV药物提供了参考,而更为安全且特效的抗ASFV药物仍有待于科研工作者们积极地探索开发。
