清洗对蔬菜中灭蝇胺、咪鲜胺及其代谢物的影响
2023-01-30齐秋爽刘立宏仇岑王娜廖振宇闫师杰
齐秋爽,刘立宏,仇岑,王娜,2,廖振宇,闫师杰,2*
(1.天津农学院食品科学与生物工程学院,天津 300392;2.天津市农副产品深加工技术工程中心,天津 300392;3.谱尼测试科技(天津)有限公司,天津 300384)
我国是农业大国,蔬菜产量较高。现阶段,蔬菜种植过程中农药使用量较多,导致我国非有机果蔬农药残留率接近80%[1-2]。研究表明[3],在一些认证蔬菜样品中单项农药残留检出率比常规蔬菜样品高,接近70%有机样品检测出农药残留。不论是对农药的过度依赖还是环境等外界因素,常出现农药过量使用的现象,然而农药残留超标对人体健康和环境均会造成一定危害[4]。
农药种类较多,通过调研了解果蔬种植中农药的使用情况,结合天津市本地农田实际使用的农药种类,最终选择使用频率较高、用途较广且研究较少的灭蝇胺、咪鲜胺进行重点研究。灭蝇胺又名环丙氨嗪,是一种新型高效、低毒、含氮杂环类杀虫剂,主要用于防治叶菜类、菜豆类、瓜果类和花卉上的美洲斑潜蝇等农业害虫[5-7]。GB 2763—2021《食品安全国家标准食品中农药最大残留量》[8]限制了部分蔬菜、瓜果等使用灭蝇胺后的残留量,美国环境保护署也将灭蝇胺列为C类致癌物。灭蝇胺在植物体内和环境中光降解形成三聚氰胺[9],是2B类致癌物。张杰群等[10]研究发现,三聚氰胺会导致肾功能衰竭、生殖系统受损。咪鲜胺又名施保克、扑霉灵、施百克、灭丙菌,可有效防治农作物的叶斑病、白粉病等[11-12]。咪鲜胺在环境中和植物体内最终会代谢为 2,4,6-三氯苯酚。2,4,6-三氯苯酚毒性高,可引起人体呼吸系统、神经系统的损害,同时具有不易降解特性,易造成严重的环境污染[13-14]。联合国粮农组织/世界卫生组织食品法典委员会规定咪鲜胺在作物上的最高残留限量为咪鲜胺及其含有2,4,6-三氯苯酚部分的代谢产物之和。因此,可以将样品中咪鲜胺及其代谢物全部水解为2,4,6-三氯苯酚,通过测定2,4,6-三氯苯酚以实现咪鲜胺的检测。
在日常生活中,自来水清洗是蔬菜烹制前最常用的处理方式。因此,评价清洗后蔬菜的农药残留对其质量安全具有重要意义。本研究选取天津市西青区蔬菜种植基地具有代表性的蔬菜(根类的旱萝卜、叶类的结球甘蓝、豆类的短豆角)进行田间试验,经自来水清洗加工,采用液相色谱法、气相色谱法分别对灭蝇胺、咪鲜胺及其代谢物进行检测,并对其去除效果进行比较,以期为消费者提供食品安全参考。
1 材料与方法
1.1 材料与试剂
旱萝卜、结球甘蓝、短豆角、灭蝇胺、咪鲜胺:天津市弘昊农业科技发展有限公司;乙腈、甲醇、正己烷(均为色谱纯):上海默克化工技术有限公司;氯化钠:天津市汇杭化工科技有限公司;氨水:天津市风船化学试剂科技有限公司;丙酮:天津市科密欧化学试剂有限公司;石油醚(60℃~90℃):天津市基准化学试剂有限公司;盐酸:天津市北方天医化学试剂厂;柠檬酸:天津市科威有限公司;吡啶盐酸盐(化学级):天津市光复精细化工研究院;1-庚烷磺酸钠(98%):上海麦克林生化科技有限公司;灭蝇胺标准品(99.18%)、三聚氰胺标准品(99.4%)、2,4,6-三氯苯酚标准品(99.6%):德国Dr.Ehrenstorfer公司。除注明外,所用试剂均为分析纯。
1.2 仪器与设备
均质机(T25):德国IKA GmbH公司;冷冻离心机(3K15):德国西格玛公司;氮吹仪(HGC-12A):天津恒奥科技发展有限公司;超纯水机(Millipore ZRQSVR-800):上海君翼仪器设备有限公司;旋转蒸发仪(RE-2000):上海力辰仪器科技有限公司;恒温鼓风干燥箱(DH-101):天津中环实验电炉公司;恒温沙浴锅(GESY-1):金坛市成辉仪器厂;1200型液相色谱仪、78908型气相色谱仪、Agilent ZORBAX SB-Aq C18色谱柱、Agilent HP-5毛细管柱:美国安捷伦科技有限公司;MCX阳离子交换柱(SPE Column):美国沃特世科技有限公司。
1.3 试验方法
1.3.1 田间试验与样品采集
根据NY/T 1276—2007《农药安全使用规范总则》[15],将甘蓝、短豆角、旱萝卜每种蔬菜设置3个农药浓度组,分别为空白组、低浓度组、高浓度组。农药的喷施方式为手动喷雾法,3种蔬菜间及3个浓度组间均设有隔离带,防止污染。低浓度组为2 g灭蝇胺与5 000 mL水,3.3 mL咪鲜胺与5 000 mL水喷施剂量为正常浓度,空白组不喷洒农药,高浓度组喷施与低浓度组喷施相差3倍浓度。每个处理匀速往复喷施3次,尽可能使农药散落均匀。灭蝇胺的安全间隔期为3 d,咪鲜胺的安全间隔期为15 d。安全间隔期后对蔬菜进行采收,运至实验室立即加工。
1.3.2 样品清洗
将采收回的蔬菜各取600 g,其中豆角去掉不可食用部分,旱萝卜去除头部和根茎部,甘蓝取从外向内的5层叶片。对角线分割,四分法取样。于3 000 mL自来水中浸泡5 min,滤干水分,用菜刀切碎,于-20℃下保存备用。每个处理均进行3次重复。
1.3.3 灭蝇胺、三聚氰胺的提取及测定
参照NY/T 1725—2009《蔬菜中灭蝇胺残留量的测定高效液相测定法》[16]中的方法测定3种蔬菜灭蝇胺、三聚氰胺残留量的检测。
1.3.3.1 样品前处理
称取25.00 g蔬菜样品放入离心管中,加入60 mL甲醇-水混合液(体积比为9∶1),17 000 r/min匀浆2 min后过滤。取滤液于100 mL容量瓶中,加入8 mL 0.5 mol/L HCl溶液,用上述甲醇-水混合液定容至100 mL,摇匀,取10 mL提取液待过柱净化。
依次用5 mL甲醇、5 mL超纯水激活MCX阳离子交换柱(6 mL、200 mg),之后将 10 mL 提取液过柱,再依次用5 mL超纯水、5 mL甲醇冲洗MCX阳离子交换柱,抽干。用8mL 5%氨水-甲醇(体积比为1∶50)洗脱,收集洗脱液,用氮吹仪在40℃下吹干,最后用5 mL流动相定容,过0.22 μm膜后上机待测。
1.3.3.2 液相色谱检测条件
色谱柱:AgilentZORBAXSB-C18色谱柱(150 mm×4.6 mm,5 μm);流动相:A 乙腈-B 庚烷磺酸钠缓冲盐溶液(体积比为85∶15);检测器:紫外检测器,波长240 nm;流速为 1 mL/min;柱温为 35℃;进样量 10 μL。三聚氰胺的保留时间为4.1 min,灭蝇胺的保留时间为8.2 min。
1.3.4 2,4,6-三氯苯酚的提取及测定
参照NY/T 1456—2007《水果中咪鲜胺残留量的测定气相色谱法》[17]中的方法测定3种蔬菜中2,4,6-三氯苯酚的残留量,略有改动,需将咪鲜胺全部水解,转化成 2,4,6-三氯苯酚。
1.3.4.1 样品前处理
称取40.00 g蔬菜样品,加入50.0 mL乙腈置于匀浆杯中,17 000 r/min匀浆2 min,过滤。向滤液中加入5.0 g氯化钠,剧烈振荡1 min,25℃下静置30 min使充分分层。取上清液20 mL于25 mL比色管中,氮气吹干,加入5 g吡啶盐酸盐,恒温沙浴锅中水解1.5 h,沙浴锅温度为230℃,25℃下冷却。用60 mL蒸馏水分次将比色管中得到的物质冲洗转移至250 mL分液漏斗中,每次使用50 mL石油醚萃取,直至将有机相完全萃取出,合并有机相,旋转蒸发仪浓缩至近干,待净化。
用25 mL丙酮-正己烷(体积比为9∶1)活化硅酸镁萃取柱,10 mL正己烷溶液分次冲洗圆底烧瓶,振荡,将冲洗后的溶液过萃取小柱。弃去滤液,再用25 mL丙酮-正己烷(体积比为9∶1)混合溶液洗脱收集,氮吹后,用5 mL正己烷溶解,过0.22 μm滤膜,上机待测。
1.3.4.2 气相色谱检测条件
色谱柱:Agilent HP-5毛细管柱(30 m×0.25 mm,0.25 μm);进样量:1 μL;进样口温度:240 ℃;检测器温度:280 ℃;载气:高纯氮气;流速:1.0 mL/min;进样方式:不分流进样;柱箱温度:升温程序见表1。

表1 柱箱程序升温Table 1 Programmed temperature rise of column box
1.3.5 2种检测方法的有效性评价
1.3.5.1 线性关系及检测限、定量限
用甲醇-水混合溶液(体积比为9∶1)稀释灭蝇胺和三聚氰胺混合标准溶液,用丙酮稀释2,4,6-三氯苯酚标准溶液,将质量浓度稀释至0.05 mg/L~1.00 mg/L,分别上机测定。采用外标法定量,以峰面积为纵坐标,质量浓度为横坐标绘制标准曲线,得到回归方程。以3倍信噪比计算检测限(limit of detection,LOD),10倍信噪比计算定量限(limit of detection,LOQ)
1.3.5.2 回收率及相对标准偏差的计算
在短豆角、甘蓝、旱萝卜的空白组中分别添加灭蝇胺、三聚氰胺、2,4,6-三氯苯酚3个浓度水平的标准溶液,其中灭蝇胺、三聚氰胺的添加水平为0.02、0.06、0.20 μg/mL,2,4,6-三氯苯酚的添加水平为 0.01、0.03、0.10 μg/mL,分别按 1.3.3、1.3.4中的方法对样品进行处理,每组3个平行。计算短豆角、甘蓝、旱萝卜中2种农药及其代谢物的回收率及相对标准偏差(relative standard deviation,RSD)。
1.4 数据处理
利用平均回收率、相对标准偏差评价液相色谱法、气相色谱法检测灭蝇胺、咪鲜胺及其代谢物的测定方法。采用加工因子(processing factor,PF)和农药去除率衡量清洗对农药的去除效果。
1.4.1 加工因子的计算
加工因子的计算公式如下[18]。
PF=B1/B2
式中:B1为加工后样品农药残留量,mg/L;B2为加工前样品的农药残留量,mg/L。
当加工因子PF<1时,说明在加工过程中农药残留量降低,PF值越低,农药的残留浓度越低;PF=1时,说明在加工过程中农药残留量没有变化;PF>1时,说明在加工过程中农药残留量反而升高。
1.4.2 农药去除率的计算
农药去除率的计算公式如下[19]。
去除率/%=[(C1-C2)/C1]×100
式中:C1为加工前样品的农药残留量,mg/L;C2为加工后样品的农药残留量,mg/L。
2 结果与分析
2.1 灭蝇胺、咪鲜胺及其代谢物的线性关系
表2为灭蝇按、咪鲜胺及其代谢物的回归方程、检出限和定量限。

表2 灭蝇胺、咪鲜胺及其代谢物的回归方程、检出限和定量限Table 2 Regression equations,detection and quantification limits of cyromazine,prochloraz and their metabolites
由表2可知,3个分析物在其线性范围内,质量浓度与峰面积均有良好的线性关系,相关系数R2均大于0.999。灭蝇胺和三聚氰胺的LOD分别为0.02、0.01mg/kg,LOQ 分别为 3.00、2.00 mg/kg;2,4,6-三氯苯酚的 LOD为 0.01 mg/kg,LOQ 为 1.00 mg/kg。
2.2 灭蝇胺、咪鲜胺及其代谢物的回收率及相对标准偏差
灭蝇胺、咪鲜胺及其代谢物在3种蔬菜中各添加浓度的回收试验结果见表3~表5。
表3 灭蝇胺在3种蔬菜中的加标回收率(n=3)Table 3 Standard addition recovery of cyromazine in three vegetables(n=3)

表4 三聚氰胺在3种蔬菜中的加标回收率(n=3)Table 4 Standard addition recovery of melamine in three vegetables(n=3)

表5 2,4,6-三氯苯酚在3种蔬菜中的加标回收率(n=3)Table 5 Standard addition recovery of 2,4,6-trichlorophenol in three vegetables(n=3)
由表3~表5可知,在3个添加浓度下,灭蝇胺在短豆角、甘蓝、旱萝卜中的平均回收率为78.2%~93.1%,RSD为2.12%~6.95%;三聚氰胺平均回收率为89.1%~110.2%,RSD 为 1.09%~4.11%;2,4,6-三氯苯酚的平均回收率为92.8%~105.1%,RSD为0.90%~4.21%。灭蝇胺、三聚氰胺、2,4,6-三氯苯酚在3种蔬菜中的平均回收率均大于70%,RSD均小于10%,结果满足NY/T 788—2018《农作物中农药残留试验准则》[20]中的规定,说明2种测定方法的精密度、准确度较好,能够满足灭蝇胺、咪鲜胺及其代谢物残留量的检测。
2.3 灭蝇胺、咪鲜胺及其代谢物在3种蔬菜中的初始残留检测
在进行清洗加工处理前,分别对短豆角、旱萝卜、甘蓝进行上机检测。3种蔬菜的空白组中均未检测到灭蝇胺、咪鲜胺及其代谢物。说明田间试验所用的试验基地没有受到灭蝇胺和咪鲜胺的污染。在喷洒低、高浓度组灭蝇胺的3种蔬菜中均检测到灭蝇胺及其代谢物三聚氰胺;喷洒低、高浓度组咪鲜胺的3种蔬菜中均可检测到 2,4,6-三氯苯酚。
2.4 清洗对短豆角中灭蝇胺、咪鲜胺及其代谢物的影响
清洗对短豆角中灭蝇胺、咪鲜胺及其代谢物农药残留的去除效果如图1所示。

图1 清洗后短豆角中不同农药的去除效果Fig.1 Removal rate of different pesticides in short beans after cleaning
由图1A可知,清洗后短豆角对不同浓度的灭蝇胺、咪鲜胺及其代谢物的加工因子均小于1.0,说明在清洗加工过程中灭蝇胺、咪鲜胺及其代谢物的残留量降低,清洗对去除农药有一定效果。由图1B可知,灭蝇胺低浓度组、高浓度组的去除率分别达到了57.70%、61.99%;三聚氰胺低浓度组、高浓度组的去除率分别达到了 38.27%、45.15%;2,4,6-三氯苯酚低浓度组、高浓度组的去除率分别达到了30.93%、20.69%。由此可见,清洗可降低短豆角灭蝇胺、咪鲜胺及其代谢物的残留量,其中灭蝇胺的低浓度组和高浓度组PF值和去除率较好,可能是灭蝇胺在短豆角中发生的微生物降解、化学降解及本身的理化性质等因素导致消解速率较快,农药原始残留量降低,但具体的降解机理还需进一步研究[21-22]。
2.5 清洗对甘蓝中灭蝇胺、咪鲜胺及其代谢物的影响
清洗对甘蓝中灭蝇胺、咪鲜胺及其代谢物农药残留的去除效果见图2。

图2 清洗对甘蓝中不同农药的去除效果Fig.2 Removal rate of different pesticides in cabbageafter cleaning
由图2A可知,清洗后甘蓝的灭蝇胺、咪鲜胺及其代谢物在低浓度组和高浓度组的加工因子各不相同,但所有加工因子均小于1.0,说明清洗可降低甘蓝中灭蝇胺和咪鲜胺及其代谢物的残留水平。由图2B可知,灭蝇胺低浓度组、高浓度组的去除率分别达到了25.61%、62.88%;三聚氰胺低浓度组、高浓度组的去除率分别达到了14.69%和87.45%;2,4,6-三氯苯酚低浓度组、高浓度组的去除率分别达到了32.60%、50.73%。由此可见,甘蓝中灭蝇胺、三聚氰胺、2,4,6-三氯苯酚高浓度组的PF值和去除率较好,原因可能是灭蝇胺和咪鲜胺是内吸性杀菌剂,在甘蓝叶和球内起作用,高浓度组农药内吸性更强,导致高浓度组的农药原始残留量相对较高。然而甘蓝的叶表面积大,内部容易清洗,从而可去除农药残留[23]。
2.6 清洗对旱萝卜中灭蝇胺、咪鲜胺及其代谢物的影响
清洗对旱萝卜中灭蝇胺、咪鲜胺及其代谢物农药残留的去除效果见图3。
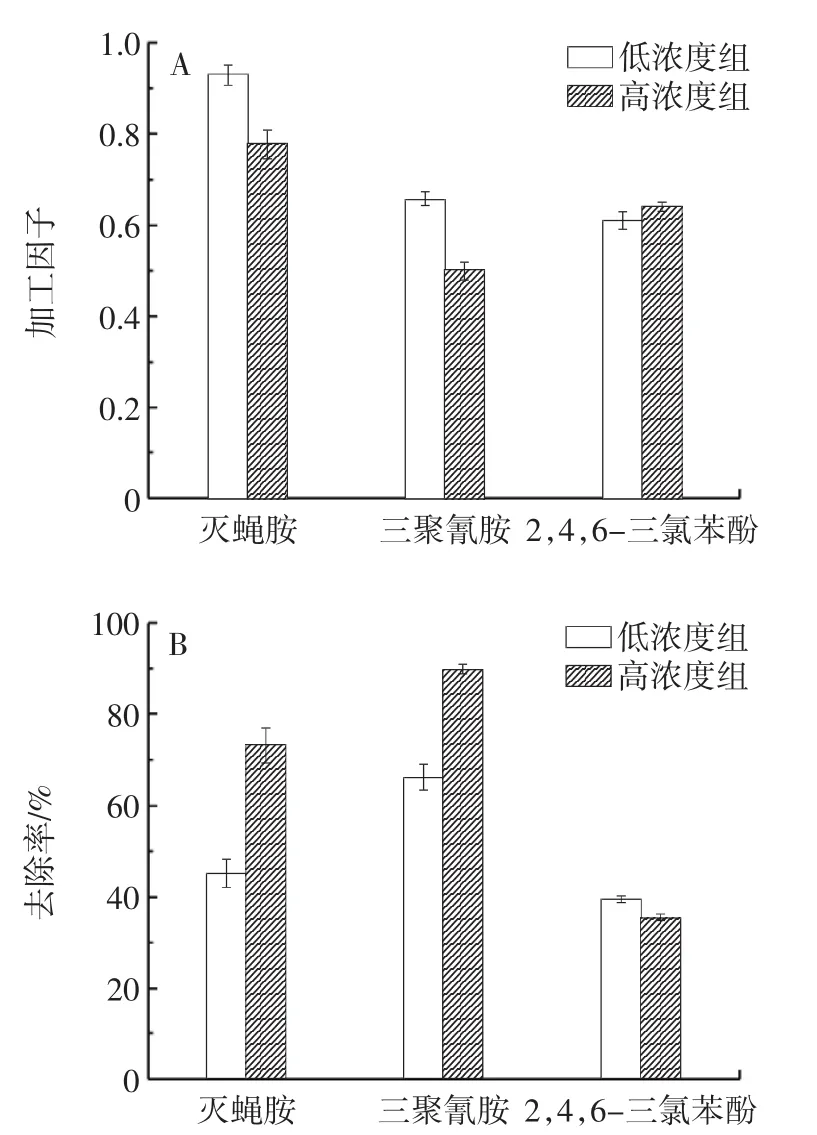
图3 清洗对旱萝卜中不同农药的去除效果Fig.3 Removal rate of different pesticides in dry radish after cleaning
由图3A可知,清洗后的旱萝卜中灭蝇胺、咪鲜胺及其代谢物加工因子均小于1.0,说明清洗对旱萝卜中的灭蝇胺、三聚氰胺、2,4,6-三氯苯酚均有去除效果。由图3B可知,灭蝇胺低浓度组、高浓度组的去除率分别达到了45.02%、66.00%;三聚氰胺低浓度组、高浓度组的去除率分别达到了 73.10%、89.74%;2,4,6-三氯苯酚在低浓度组、高浓度组中去除率分别达到了39.48%、35.54%。由此可见,清洗对灭蝇胺、三聚氰胺的去除效果较好,可能是灭蝇胺在旱萝卜内更易通过脱烷基代谢产生三聚氰胺;也可能是农药直接喷施到叶片上,而萝卜根生长于土壤中未能与喷施的农药直接接触,其原始农药沉积量少。此外,咪鲜胺的去除率较低的可能原因是灭蝇胺的安全间隔期为3 d,咪鲜胺的安全间隔期为15 d,随着农药喷施时间的延长,渗透到蔬菜中的农药量会增多,蔬菜表面的农药残留量减少;还可能是块根类蔬菜初生结构中存在韧皮部和纤维,会产生保护组织,导致清洗对安全间隔期长的农药去除效果差[24-25]。
对比图1、图2和图3的试验结果发现,清洗对灭蝇胺、咪鲜胺及其代谢物的去除效果与蔬菜种类有关,例如,清洗能减少三聚氰胺在旱萝卜中的残留(低浓度组去除率为73.10%),但对甘蓝中三聚氰胺残留的去除效果较弱(低浓度组去除率仅为14.69%)。其次,农药在蔬菜上的残留量还取决于农药施药量浓度,试验结果发现,喷施高浓度灭蝇胺的3种蔬菜的去除率高于低浓度处理组,表明高浓度农药的原始残留量高于低浓度组,且残留量与施药浓度呈正相关。此外,农药在蔬菜上的残留量还可能与农药的理化性质和手工清洗强度有关。
3 结论
本试验研究清洗对短豆角、甘蓝、旱萝卜中常用农药灭蝇胺、咪鲜胺及其代谢物残留的去除效果,结果表明,3种蔬菜中灭蝇胺的去除率在25.61%~66.00%;三聚氰胺的去除率在 14.69%~89.74%;2,4,6-三氯苯酚的去除率在20.69%~50.73%。综上,清洗对灭蝇胺的去除效果比咪鲜胺更好。虽然清洗浸泡的方式对于农药及其代谢物有去除效果,但做不到完全去除,即去除率达不到100%。因此,建议在食用皮可食蔬菜前先进行充分的清洗,去皮后再烹制更优。
