饲喂大蒜素对小尾寒羊羊肉品质的影响
2023-01-30蒲仕文梁辰徐雯杨燕高倩王振南吕慎金艾合买提江艾海提
蒲仕文,梁辰,徐雯,杨燕,高倩,王振南,吕慎金*,艾合买提江·艾海提*
(1.新疆大学生命科学与技术学院,新疆 乌鲁木齐 830046;2.临沂市农业科学院,山东 临沂 276012;3.临沂大学农林科学学院,山东 临沂 276000)
天然植物提取物运用到畜牧业不仅能够改善动物的状态,并且具有调节肉品品质的作用。大蒜及其副产品在畜牧业广泛应用,其含有多种活性代谢物,包括大蒜素、蒜素、二烯丙基硫化物[1]。大蒜素是大蒜中含量较高的硫代硫酸盐,具有强烈的刺激性气味,并且具有抗菌[2]、抗氧化[3]、免疫调节的功效[4],大蒜素的抗氧化活性使其能有效清除O2-自由基、羟自由基,因此,大蒜素在畜牧业及食品工业中均有一定的应用。
在小尾寒羊的养殖过程中,会有温度、声音等环境因素对其刺激而造成氧化应激反应。氧化应激会造成代谢活动增加,从而导致自由基的产生增加。自由基是在线粒体中电子传递链式反应中作为细胞呼吸的正常副产物[5]。在氧化应激期间,活性氧的过量产生会影响抗氧化的防御系统,例如谷胱甘肽过氧化物酶(glutathion peroxidase,GSH-Px)、超氧化物歧化酶(superoxide dismutase,SOD)和过氧化氢酶(catalase,CAT)等抗氧化酶活性降低,从而导致小尾寒羊的氧化应激[6]。当活性氧的产生失去控制会损害机体的功能和生存能力。天然的植物提取物能够用来控制氧化应激、增强内源性抗氧化能力,对抗氧化应激及活性氧诱导的组织损伤和退化性疾病[7],在动物生产过程中补充天然植物提取物,可缓解畜牧业中的生产压力[8]。
氧化损伤是导致肉品质降低和货架期缩短的主要原因,肉类产品中氧化产物的快速积累会对肉品质产生不利影响,因此降低肉的氧化损伤很重要[9]。天然植物提取物已被证实对动物生产以及动物宰后肉品质有影响。羊肉中不饱和脂肪酸含量较高,因此羊肉的保质期一般比较短[10],在羊肉生产过程中饲喂天然植物提取物是常见提高肉品质的方法。饲喂含有生育酚的日粮能够在家禽冷却肉和冷冻肉中表现出更好的氧化稳定性[11],Lopez-bote等[12]的研究发现饲粮中添加α-生育酚能够明显降低兔肉脂质氧化的速率。不同的饲料日粮一般不会导致肉色的差异[13],但Priolo等[14]的研究发现富含单宁的日粮可以使肉色变浅。天然植物提取物可以通过调节瘤胃微生物来调节肉类不饱和脂肪酸的含量[15],研究表明,生物活性物质对饲粮中的多不饱和脂肪酸的分解和生物氢化具有抑制作用[16]。Campidonico等[15]的研究发现富含单宁的青贮混合物对羊肉n-3多不饱和脂肪酸有积极的调节作用。
脂肪的氧化作用,氨基酸与糖的美拉德反应以及蛋白质和氨基酸的降解,均会产生肉香的风味物质。屠宰年龄、性别均会影响肉的风味,但饲粮也是影响畜禽肉风味的一个重要因素[17]。刘旺景等[18]的研究发现饲粮中添加沙葱粉后羊肉中的特征风味物质由风味较差的饱和直链醛转变为风味较好的不饱和醛,羊肉风味得以改善。关于饲喂天然植物提取物对羊肉品质的改善以及对肉的风味影响的研究较少,本研究以大蒜素为实验材料,小尾寒羊公羊为研究对象,旨在研究日粮中添加大蒜素对小尾寒羊羊肉品质、抗氧化能力、氨基酸含量、脂肪酸含量以及风味的影响,为寻找天然饲料添加剂提供支撑,为大蒜及其副产物在畜禽业生产中应用提供参考。
1 材料与方法
1.1 材料与试剂
小尾寒羊羊肉来源于临沂大学试验羊场。大蒜素粉剂:潍坊加易加生物科技有限公司;超氧化物歧化酶(superoxide dismutase,SOD)试剂盒、谷胱甘肽过氧化物酶(glutathion peroxidase,GSH-Px)试剂盒、过氧化氢酶(catalase,CAT)试剂盒、总抗氧化(total antioxidant capacity,T-AOC)试剂盒、丙二醛(malondialdehyde,MDA)试剂盒:南京建成生物工程研究所;脂肪酸甲酯标准品:美国默克试剂公司;焦性没食子酸(分析纯):上海易恩化学技术有限公司;14%三氟化硼-甲醇(分析纯):上海麦克林生化科技有限公司。
1.2 仪器与设备
电热鼓风干燥箱(DHG-9070A):上海一恒科学仪器有限公司;恒温水浴锅(HS-3001):上海康华生化仪器公司;肌肉嫩度仪(C-LM3B):东北农业大学自制;精密色差仪(NR10QC):深圳三恩时科技公司;pH计(S2):梅特勒-托利多仪器公司;凯氏定氮仪(K9840):济南海能仪器股份有限公司;脂肪测定仪(SZC-C):上海纤检仪器公司;酶标仪(SynergyHTX):美国伯腾仪器有限公司;气相色谱仪(GC8890)、气相色谱仪(7890A)、质谱仪(5975C):美国安捷伦仪器科技公司;全自动氨基酸分析仪(L-8900):日本日立公司。
1.3 实验方法
1.3.1 实验设计
将14只约120日龄无特征小尾寒羊(25.77±1.45)kg分成两组,每组7只,实验组在基础饲粮中添加15 g/100 kg大蒜素粉,对照组仅饲喂基础饲粮。预实期10 d,正式实验期100 d,结束后按照NY 467—2001《畜禽屠宰卫生检疫规范》屠宰羊,进行肉品质指标测定。每天下午喂食前清洗1次羊圈,每周消毒1次。
最后1 d所有的动物禁食24 h,采集实验羊后腿肉,采集部分肉样分装于冻存管液氮速冻后置于-80℃冰箱中,用于测定抗氧化酶、风味、氨基酸、脂肪酸指标。其余肉样放置到4℃保藏等待测定指标。
1.3.2 肉品质测定
1.3.2.1 pH值的测定
在肉样采集后45 min和24 h时用pH计测定,不同位置重复测定3次,取平均值。
1.3.2.2 肉色的测定
先将色差仪用标准白板进行校正,然后将镜头垂直于肉的平面上后进行测量,每次测定肉面重复3次,最后取平均值。
1.3.2.3 蒸煮损失率的测定
取m1(g)肉样装入真空袋,口袋朝上置于80℃恒温水浴锅中,水浴至中心温度达到75℃计时20 min,冷却至室温(25℃)后放置于4℃冰箱24 h,此时肉样质量记为m2(g),按下列公式计算蒸煮损失率。

1.3.2.4 滴水损失率的测定
取肉样m1(g)用绳子穿好,悬挂于真空包装袋中,在4℃条件下悬挂24 h后,记悬挂后的肉样质量为m2(g),按下列公式计算滴水损失率。
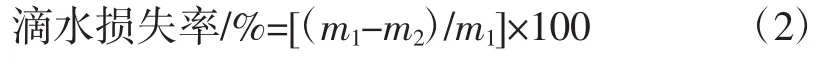
1.3.2.5 剪切力的测定
取肉样放入80℃恒温水浴锅中加热,待中心温度到达70℃时,将肉样取出冷却至4℃,用取样器沿与肌纤维平行的方向取样,取样后用嫩度仪立即进行测定。
1.3.2.6 基本营养指标测定
水分参照GB 5009.3—2016《食品安全国家标准食品中水分的测定》中的直接干燥法测定;灰分参照GB 5009.4—2016《食品安全国家标准食品中灰分的测定》测定;脂肪按照GB 5009.6—2016《食品安全国家标准食品中脂肪的测定》中的索氏抽提法测定;蛋白质参照GB 5009.5—2016《食品安全国家标准食品中蛋白质的测定》中的凯氏定氮法测定;钙参照GB 5009.92—2016《食品安全国家标准食品中钙的测定》中的乙二胺四乙二酸滴定法测定;磷参照GB 5009.87—2016《食品安全国家标准食品中磷的测定》中的钒钼黄分光光度法测定。
1.3.2.7 抗氧化特性测定
肉样中 SOD、CAT、GSH-Px、T-AOC、MDA 使用试剂盒说明书方法进行测定。
1.3.2.8 肌肉脂肪酸组成测定
羊肉样品的甲酯化参考梁永飞[19]的方法。气相色谱条件:DB-FastFAME型毛细管柱(90 m×0.25 mm×0.25 μm);进样器温度 260℃,分流比为 50 ∶1;柱箱升温程序80℃保持1 min,40℃/min升温至200℃保持20 min,3℃/min升温至235℃保持20 min。检测器:氢火焰离子化检测器,检测器温度:280℃。
1.3.2.9 肌肉氨基酸组成的测定
取0.15 g肉样于水解管中,加入6 mol/L盐酸溶液10 mL,放入冰水中冷冻3 min,抽真空充氮气,重复3次后在氮气的保护下封管,封管后放入110℃电热鼓风干燥箱中水解22 h。冷却后打开水解管,将水解液用滤纸过滤后定容至50 mL容量瓶。取1 mL滤液在40℃~50℃真空条件下旋蒸,用去离子水溶解,反复抽干。用0.02 mol/L盐酸溶液定容至10 mL,过滤后用全自动氨基酸测定仪测定。
1.3.2.10 顶空固相微萃取与气质联用分析
固相微萃取挥发性风味物质的测定:称取2 g剪碎后的样品放置于20 mL的顶空瓶中,在50℃温度下预热40 min,50℃水浴条件下使用固相微萃取(solid phase micro extraction,SPME)萃取针顶空萃取 40 min,将萃取针插入气相色谱(gas chromatography,GC)进样口解吸5 min。
GC条件:HP-5毛细管柱(30 m×0.25 mm×0.25 μm)进样器温度为250℃;载气为氦气,恒定流速为1mL/min;不分流模式进样;柱箱升温程序:40℃保持5 min,以2℃/min的速度升至50℃,以8℃/min的速度升至140℃,最后以10℃/min的速度升至280℃保持10min。
质谱(massspectrometer,MS)条件:接口温度280℃;离子源温度230℃;四极杆温度150℃;电子能量设置为70 eV;扫描范围m/z 25~550。
1.4 数据处理
采用Excel 2006对数据进行统计分析,采用SPSS 26.0 t检验法检验组间实验前后的差异显著性,结果以平均值±标准差表示,P<0.05表示差异显著。
2 结果与分析
2.1 饲粮添加大蒜素对小尾寒羊羊肉肉质的影响
饲粮添加大蒜素对羊肉肉质的影响见表1。

表1 添加大蒜素对小尾寒羊羊肉品质的影响Table 1 Effect of allicin on the mutton quality of small-tailed Han sheep
由表1可知,对照组和实验组的小尾寒羊羊肉的pH值、蒸煮损失、剪切力、水分、灰分、粗蛋白、粗脂肪、钙、磷差异不显著。但实验组的滴水损失和剪切力均显著低于对照组(P<0.05)。实验组24 h的L*显著低于对照组(P<0.05)。
2.2 饲粮添加大蒜素对小尾寒羊羊肉抗氧化指标的影响
饲粮添加大蒜素对小尾寒羊羊肉抗氧化指标的影响见表2。

表2 饲粮添加大蒜素对小尾寒羊羊肉抗氧化指标的影响Table 2 Effect of allicin on the antioxidant indexes of mutton of small-tailed Han sheep
由表2可知,实验组的小尾寒羊羊肉中的GSHPx活性显著高于对照组(P<0.05),并且总抗氧化能力实验组显著高于对照组(P<0.05)。MDA标志着脂质过氧化物程度,实验组中MDA含量显著低于对照组(P<0.05)。
2.3 饲粮添加大蒜素对小尾寒羊羊肉脂肪酸组成的影响
添加大蒜素对小尾寒羊羊肉脂肪酸组成的影响见表3。

表3 添加大蒜素对小尾寒羊羊肉脂肪酸组成的影响Table 3 Effect of allicin on fatty acid composition of mutton of small-tailed Han sheep mg/kg
由表3可知,不同实验组共检测出7种饱和脂肪酸(saturated fatty acid,SFA)、4种单不饱和脂肪酸(monounsaturated fatty acid,MUFA)、4 种多不饱和脂肪酸(polyunsaturatedfattyacid,PUFA)。其中饱和脂肪酸含量最高的是棕榈酸(C16:0),单不饱和脂肪酸含量最高的是油酸(C18:1),多不饱和脂肪酸含量最高的是亚油酸(C18:2),各实验组小尾寒羊羊肉中 SFA、PUFA和UFA的含量差异均不显著,但饱和脂肪酸中的己酸差异显著(P<0.05),十三酸差异显著(P<0.05),肉豆蔻酸差异显著(P<0.05),十七烷酸差异显著(P<0.05),11,14,17-顺-二十碳三烯酸差异显著(P<0.05)。
2.4 饲粮添加大蒜素对小尾寒羊羊肉氨基酸组成的影响
饲粮添加大蒜素对小尾寒羊羊肉氨基酸组成的影响见表4。
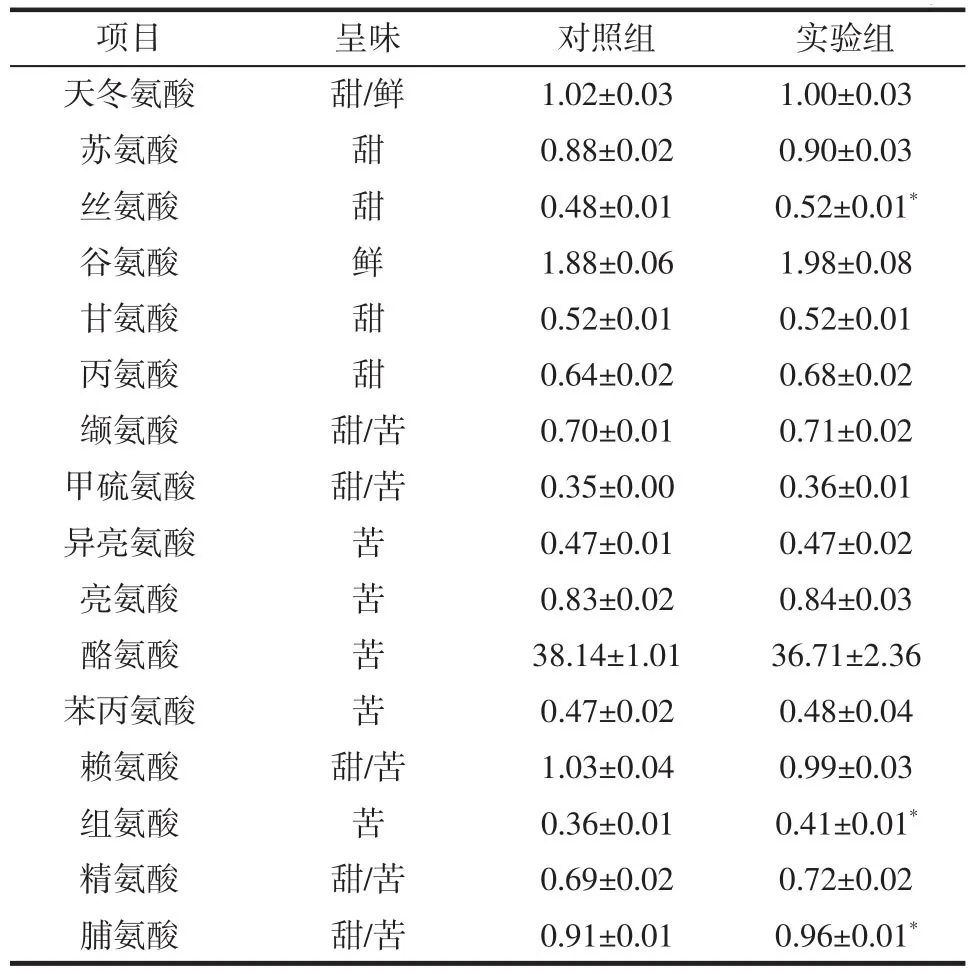
表4 添加大蒜素对小尾寒羊羊肉氨基酸组成的影响Table 4 Effect of allicin on the amino acid composition of mutton of small-tailed Han sheep g/kg
由表4可知,实验组中丝氨酸、组氨酸以及脯氨酸均显著高于对照组(P<0.05);其它氨基酸中,实验组谷氨酸、丙氨酸、精氨酸、苯丙氨酸和亮氨酸的含量均略高于对照组,但是差异不显著(P>0.05)。
2.5 饲粮添加大蒜素对于小尾寒羊羊肉风味的影响
饲粮添加大蒜素对于小尾寒羊羊肉风味的影响见表5。

表5 添加大蒜素对小尾寒羊羊肉风味的影响Table 5 Effect of allicin on the flavor of mutton of small-tailed Han sheep
由表5可知,小尾寒羊羊肉中的风味物质选择比对美国国家标准技术研究院(National Institute of Standards and Technology,NIST)库后匹配度大于90%的物质,由此共鉴别出6种化合物,其中共有4种差异化合物。
3 讨论
3.1 饲粮中添加大蒜素对小尾寒羊羊肉肉质的影响
羊肉的剪切力、pH值、肉色、滴水损失以及蒸煮损失等指标均是反映鲜肉品质的指标。羊肉的pH值变化反映糖原酵解的速度与强度,肉的pH值下降能够对微生物有一定的抑制作用。通常羊肉的pH值越高,羊肉越嫩[20]。本实验发现实验组pH45min和pH24h均大于对照组,但是差异不显著,但Long等[21]发现天然活性物质能提高肉在24 h时的pH值,提升肉的品质。
肉色是直接反映给消费者肉品质优劣的直观指标[22],但对肉的营养价值没有太大的影响。肉的颜色主要与肌红蛋白和血红蛋白的含量有关,本实验发现饲喂大蒜素的小尾寒羊羊肉的L*值低于对照组,a*值高于对照组,但是仅L*值具有显著性(P<0.05)。可能是添加大蒜素组羊肌肉中血红素浓度较高,使得实验组的羊肉具有更高的红度值。
滴水损失是反映肌肉组织持水能力的重要指标,本实验发现饲喂大蒜素能降低羊肉的滴水损失(P<0.05),一般情况下,宰后pH值会影响肌肉持水能力,pH值低会加速肌动球蛋白的形成和收缩,内部的汁液会加速流出,高pH值的肌肉具有较高的持水能力[23]。
羊肉中水分、粗蛋白、粗脂肪、粗灰分、钙和磷等指标均是常规化学成分,本实验中发现饲喂大蒜素的组别羊肉粗蛋白含量升高,但不显著(P>0.05),粗蛋白的含量与肌肉的红度值呈正相关,在本实验中发现红度值有一定程度的升高。
3.2 饲粮中添加大蒜素对于羊肉抗氧化性能的影响
脂质氧化是肉类腐败的主要现象,肉以及肉制品很容易在加工过程和贮藏过程中发生氧化酸败,会导致其风味、外观和营养价值的损失[11]。在肉储藏和加工过程中加入抗氧化剂可以延长制品的保质期,在饲养过程中添加抗氧化剂也能在一定程度上提高畜禽抗氧化能力,Lopez-Bote等[24]发现在饲养过程中添加迷迭香和α-生育酚都能降低鸡肉的脂质氧化速率。Zhang[9]发现甘草提取物可以作为抗氧化剂,增加非酶类抗氧化剂的含量从而清除氧自由基,减少脂质氧化的作用。α-生育酚是传统的饲料添加剂,通过延缓氧化肌球蛋白抑制不饱和脂肪酸来改善新鲜肉的肉色[25]。在本实验中发现,与对照组相比,饲喂大蒜素能显著降低肉的MDA含量,提高肉的T-AOC能力,提高GSHPx活性。MDA是脂质氧化的产物,MDA升高代表组织损伤,抗氧化机制减弱,也反映细胞损伤的程度。本次实验中MDA降低可能是由于补充大蒜素抑制活性氧,降低脂质氧化程度。Wang等[26]发现饲喂大蒜素能明显降低组织中的MDA含量,提高GSH-Px的活性,这与本实验的实验结果一致。
3.3 饲粮中添加大蒜素对羊肉脂肪酸组成的影响
羊肉脂肪酸的组成及含量主要受遗传、饲养管理和营养因素的影响,通过营养调控脂肪酸是当前主要的调控方式。羊肉中不饱和脂肪酸含量丰富,特别是富含亚油酸、亚麻酸和花生四烯酸等必需脂肪酸。Zong等[27]研究发现膳食中摄入较多的饱和脂肪酸会增加患冠心病的风险,饱和脂肪酸的摄入量与抑郁症存在关联,并且呈正相关[28]。在生产羊肉的过程中,通过营养调控减少羊肉中饱和脂肪酸含量可以限制人们膳食饱和脂肪酸的摄入量。本次实验中发现饲喂大蒜素会减少己酸(C6:0)、十三酸(C13:0)、肉豆蔻酸(C14:0)的含量,这对于人体健康有益。添加植物提取物可以改变肉类脂肪酸的组成[29],Avila-Ramos等[30]研究得出饲喂牛至精油能够明显提升鸡肉中亚麻酸的含量,并且能够改善鸡对于饲料的消化能力。
3.4 饲粮中添加大蒜素对羊肉氨基酸组成和风味的影响
肉是必需氨基酸的重要来源,羊肉是必需氨基酸的良好来源。本次实验中发现饲喂大蒜素能够提升必需氨基酸组氨酸的含量,同时也增加了丝氨酸与脯氨酸的含量。Pogány等[31]提出鼠尾草提取物能够提高兔肉中必需氨基酸的水平,Yu等[32]发现茴香提取物能够改变鸡肉中氨基酸组成。马小明等[33]发现在滩羊的饲粮中添加地椒可以提高其必需氨基酸与非必需氨基酸的含量。氨基酸同时也是重要的风味前体物质,Strecker降解反应、氨基酸与还原糖发生美拉德反应均是形成风味的途径[34]。谷氨酸和天冬氨酸会产生咸味,氨基酸和有机酸结合会产生苦味,甲硫氨酸会产生肉类的风味物质[35]。羊肉的挥发性风味物质按照匹配度大于90%的条件筛选,由此共鉴别6种化合物,其中共有4种差异化合物,因此饲喂大蒜素能改变风味物质的成分。
4 结论
饲粮中添加大蒜素可以改善小尾寒羊羊肉肉色、滴水损失、脂肪酸组成,提高肉的抗氧化能力,为延长小尾寒羊羊肉的保质期提供参考。饲粮中添加大蒜素会减少小尾寒羊羊肉中己酸(C6:0)、十三酸(C13:0)、肉豆蔻酸(C14:0)的含量,这对于人体健康有益,通过营养调控减少羊肉中饱和脂肪酸含量可以限制人们膳食饱和脂肪酸的摄入量。添加大蒜素对羊肉风味有一定影响,可能与大蒜素影响脂肪酸和氨基酸组成相关,关于饲料中添加大蒜素提高抗氧化性能的机理以及羊肉的风味影响机理还需要进一步研究。
