黑曲霉AnM1产葡萄糖酸及纯化低聚异麦芽糖
2023-01-30满在伟崔慧慧蒋心怡邹平张迎阳郭静
满在伟,崔慧慧,蒋心怡,邹平,张迎阳,郭静
(1.常州大学石油化工学院食品学院,江苏 常州 213164;2.山东恒仁工贸有限公司,山东 枣庄 277533;3.常州大学药学院,江苏 常州 213164)
葡萄糖酸广泛应用于食品、医药、建筑等行业中[1-3]。目前,葡萄糖酸主要采用生物法催化葡萄糖氧化生产,包括酶催化和微生物发酵2种方式。酶催化法是利用葡萄糖氧化酶和过氧化氢酶共同作用将葡萄糖氧化成葡萄糖酸,该法存在用酶成本高的问题。微生物发酵法是培养具有较强葡萄糖氧化酶和过氧化氢酶合成能力的菌株,使葡萄糖氧化生产葡萄糖酸[4-8]。因此,产酶能力强和培养要求低的微生物菌株是发酵生产葡萄糖酸的关键。目前,发酵生产葡萄糖酸最有竞争力的微生物是黑曲霉[6-8],而葡萄糖酸的生产研究也大多与黑曲霉相关。氧气供应是葡萄糖酸生产的关键因素,通过优化黑曲霉发酵产葡萄糖酸钠过程中的氧气供应方式,采用两阶段供氧策略可提高葡萄糖酸钠得率[2]。通过调整发酵罐搅拌转速将黑曲霉菌体形态控制为分散状,可提高氧气传递速率和葡萄糖酸生产效率,50 L发酵罐中葡萄糖酸生产强度达到21.0 g/(L·h),葡萄糖酸得率为1.05 g/g[3]。研究表明,黑曲霉催化葡萄糖合成葡萄糖酸的葡萄糖氧化酶和过氧化氢酶分布并固定在菌丝体细胞壁的外围[3,7-8]。已有研究循环使用黑曲霉细胞使其用于连续发酵产葡萄糖酸工艺,可降低用于细胞生长及维持所需碳源,能够明显提高葡萄糖酸生产速率及得率[8]。也有研究将产葡萄糖酸黑曲霉菌体进行回收,然后将细胞破碎提取葡萄糖氧化酶和过氧化氢酶,并重复用于酶促反应生产葡萄糖酸[6]。
低聚异麦芽糖是一类含有一个或多个α-1,6糖苷键的低聚葡萄糖。低聚异麦芽糖由于其特殊的分子结构,不能被口腔菌群利用,因此具有抗龋齿功能,其具有良好的双歧杆菌增殖功能,能够促进肠道菌群平衡健康[9-11]。目前,低聚异麦芽糖主要采用酶法催化生产,首先将淀粉通过酶法水解成麦芽糖,然后利用α-葡萄糖苷酶催化麦芽糖生成低聚异麦芽糖[12-14]。α-葡萄糖苷酶的催化产物是异麦芽糖(isomaltose,IG2)、潘糖(panose,P)、异麦芽三糖(isomaltotriose,IG3)、异麦芽四糖和异麦芽五糖等混合物,其中IG2、P和IG3是体现低聚异麦芽糖功能性的主要成分,也是衡量低聚异麦芽糖质量的重要指标,又称有效三糖。另外,α-葡萄糖苷酶催化过程中会产生副产物葡萄糖并残留少量麦芽糖[15-16]。根据GB/T 20881—2017《低聚异麦芽糖》规定,低聚异麦芽糖产品分为50型(isomaltooligosaccharide-50,IMO-50)和 90 型(isomaltooligosaccharide-90,IMO-90)两种糖浆(粉),90型产品总低聚异麦芽糖含量不低于90%(占干物质),其中有效三糖含量不低于45%(占干物质)[17-18]。为了得到IMO-90型低聚异麦芽糖产品,需要将α-葡萄糖苷酶催化产物中的葡萄糖和麦芽糖含量降低。例如,可以采用酵母菌发酵法将葡萄糖和麦芽糖吸收并代谢生成酒精以提高低聚异麦芽糖纯度[15-16];也可利用乳酸菌发酵法提高低聚异麦芽糖纯度,但是乳酸菌会消耗一部分低聚异麦芽糖,降低产品收率[19]。此外,将IMO-50型产品中的葡萄糖氧化成葡萄糖酸也可提高低聚异麦芽糖纯度。徐小艳等[20]利用葡萄糖氧化酶和过氧化氢酶,可将商品化低聚异麦芽糖中的葡萄糖完全氧化去除,低聚异麦芽糖纯度可由62.78%提高至85.28%。姜艳军等[21]的研究发现,将葡萄糖氧化酶和过氧化氢酶固定化后可重复用于氧化去除低聚异麦芽糖产品中的葡萄糖,葡萄糖去除率可达80%。但是,利用葡萄糖氧化酶和过氧化氢酶纯化低聚异麦芽糖存在用酶成本较高和麦芽糖不能去除的问题。
本文对实验室筛选到的产葡萄糖酸黑曲霉AnM1进行发酵条件优化,并对菌体重复利用产葡萄糖酸进行探究,以提高葡萄糖酸生产效率;随后对利用黑曲霉AnM1菌体纯化低聚异麦芽糖进行研究,以期为产葡萄糖酸黑曲霉菌体重复利用以及低聚异麦芽糖和葡萄糖酸联产提供思路。
1 材料与方法
1.1 材料与试剂
1.1.1 试验菌株
黑曲霉(Aspergillus niger)AnM1:常州大学食品生物技术实验室筛选并斜面低温(4℃)保藏。
1.1.2 主要试剂
α-葡萄糖苷酶(500 000 U/mL):江苏锐阳生物科技有限公司;葡糖淀粉酶(260 000 U/mL):沧州夏盛酶生物技术有限公司;CuCl2(分析纯):国药集团化学试剂有限公司;玉米浆(试剂级):上海阿拉丁生化科技有限公司;其他试剂均为国产分析纯。
1.1.3 培养基
斜面培养基:20 g/L葡萄糖、5 g/L玉米浆、0.3 g/L KH2PO4、0.2 g/L MgSO4·7H2O、5 g/L 轻质碳酸钙、20 g/L琼脂粉。
基础发酵培养基:120 g/L葡萄糖、1 g/L玉米浆、0.3 g/L KH2PO4、0.2 g/L MgSO4·7H2O、40 g/L 轻质碳酸钙、0.3 g/L消泡剂。
优化后发酵培养基:120 g/L葡萄糖、0.8 g/L玉米浆、0.3 g/L KH2PO4、0.3 g/L MgSO4·7H2O、40 g/L 轻质碳酸钙、0.3 g/L消泡剂。
1.2 仪器与设备
恒温培养箱(StabS2型):上海润度生物科技有限公司;离心机(1-14型):德国Sigma公司;生物传感分析仪(S-10):深圳市西尔曼科技有限公司;高温干燥箱(DHG-9038A):无锡玛瑞特科技有限公司。
1.3 方法
1.3.1 黑曲霉AnM1孢子培养及葡萄糖酸发酵
将黑曲霉AnM1冻管孢子悬液划线至斜面培养基上,37℃静置培养7 d。待菌落表面布满孢子,用5 mL无菌水冲洗培养好的黑曲霉斜面,获得孢子悬液。取1 mL孢子悬液接入装有30 mL发酵培养基的500 mL带挡板三角瓶中,37℃、220 r/min发酵,待葡萄糖浓度降至2 g/L以下时结束发酵。葡萄糖酸生产强度、葡萄糖酸得率的计算公式如下。

1.3.2 发酵培养基优化
采用单因素试验,分别改变基础发酵培养基中玉米浆(0.2、0.4、0.6、0.8、1.0、1.2 g/L)、KH2PO4(0.1、0.2、0.3、0.4、0.5 g/L)和 MgSO4·7H2O(0.1、0.2、0.3、0.4、0.5 g/L)的浓度,37℃、220 r/min发酵,待葡萄糖浓度降至2 g/L以下时结束发酵,考察培养基组分对黑曲霉AnM1发酵产葡萄糖酸的影响。
1.3.3 黑曲霉AnM1菌体重复利用产葡萄糖酸
利用优化后发酵培养基进行黑曲霉AnM1发酵,产葡萄糖酸,发酵结束后,开放条件下30 mL发酵液离心(8 000×g,5 min,25℃)收集黑曲霉菌体。利用30 mL转化液(120 g/L葡萄糖、40 g/L轻质碳酸钙、0.3 g/L消泡剂)悬浮黑曲霉菌体,然后装入500 mL带挡板三角瓶。37℃、220 r/min发酵,待葡萄糖浓度降至2 g/L以下时结束发酵。然后,取30 mL发酵液再次离心(8 000×g,5 min,25℃)收集黑曲霉菌体,并在相同条件下重复利用产葡萄糖酸。
1.3.4 α-葡萄糖苷酶催化麦芽糖生成低聚异麦芽糖
去离子水溶解麦芽糖,利用1 mol/L HCl和NaOH调节pH值,配制成麦芽糖浓度为300 g/L、pH4.5的麦芽糖溶液。添加450 μL/L α-葡萄糖苷酶,混匀后将反应液置于54℃环境中,静置反应24 h。
1.3.5 低聚异麦芽糖反应液中葡萄糖与麦芽糖的去除
低聚异麦芽糖反应液中的葡萄糖可直接利用黑曲霉AnM1菌体氧化去除。黑曲霉AnM1菌体的收集同1.3.3的方法。取1.3.4中的低聚异麦芽糖反应液30 mL,再添加30 mL黑曲霉AnM1发酵液收集的菌体、40 g/L轻质碳酸钙、0.3 g/L消泡剂,37℃、220 r/min反应,待葡萄糖浓度降至2 g/L以下时结束反应。低聚异麦芽糖反应液添加0.02%葡糖淀粉酶,54℃静置反应2 h,然后90℃灭酶10 min,将剩余麦芽糖水解成葡萄糖。待反应液温度降至37℃,利用黑曲霉AnM1菌体氧化去除葡萄糖。
1.3.6 分析方法
菌体量通过称量细胞干重进行测定,取20 mL发酵液离心收集菌体,菌体利用去离子水清洗3次,然后置于105℃烘干并进行称重。葡萄糖含量利用生物传感分析仪进行测定。葡萄糖酸采用二价铜离子显色法测定[1],为避免发酵液中Ca2+与SO42-形成沉淀而影响测量,因此本文利用CuCl2代替CuSO4。同时,选取特定葡萄糖酸发酵样品寄送至南京仁研测试公司进行高效液相色谱分析。葡萄糖酸高效液相色谱检测条件:色谱柱为Amethyst C18-H液相色谱柱(5 μm,4.6 mm×250 mm),流动相为甲醇和磷酸水溶液(50 mL甲醇和5 mL磷酸用去离子水稀释至1 L),柱温25℃,流动相流速1 mL/min,检测波长为210 nm,进样量10 μL。对低聚异麦芽糖反应液中麦芽糖、低聚异麦芽糖等糖的含量测定采用液相色谱分析方法,样品送至江南大学分析测试中心进行分析,液相色谱检测条件参照GB/T 20881—2017《低聚异麦芽糖》[17]中的方法进行测定。
1.4 数据处理
所有试验均进行3次重复试验,所有数据以平均值±标准差表示。
2 结果与分析
2.1 黑曲霉AnM1葡萄糖酸发酵培养基的优化
葡萄糖氧化成葡萄糖酸需要消耗氧气,因此葡萄糖酸发酵是一个极度耗氧的过程,需要大量氧气供给[2-3]。本文利用带挡板三角瓶、较少的装液量(30 mL)和较高的摇床转速(220 r/min)进行黑曲霉AnM1葡萄糖酸发酵以保证供氧量。培养基成分对黑曲霉AnM1发酵产葡萄糖酸的影响如图1所示。
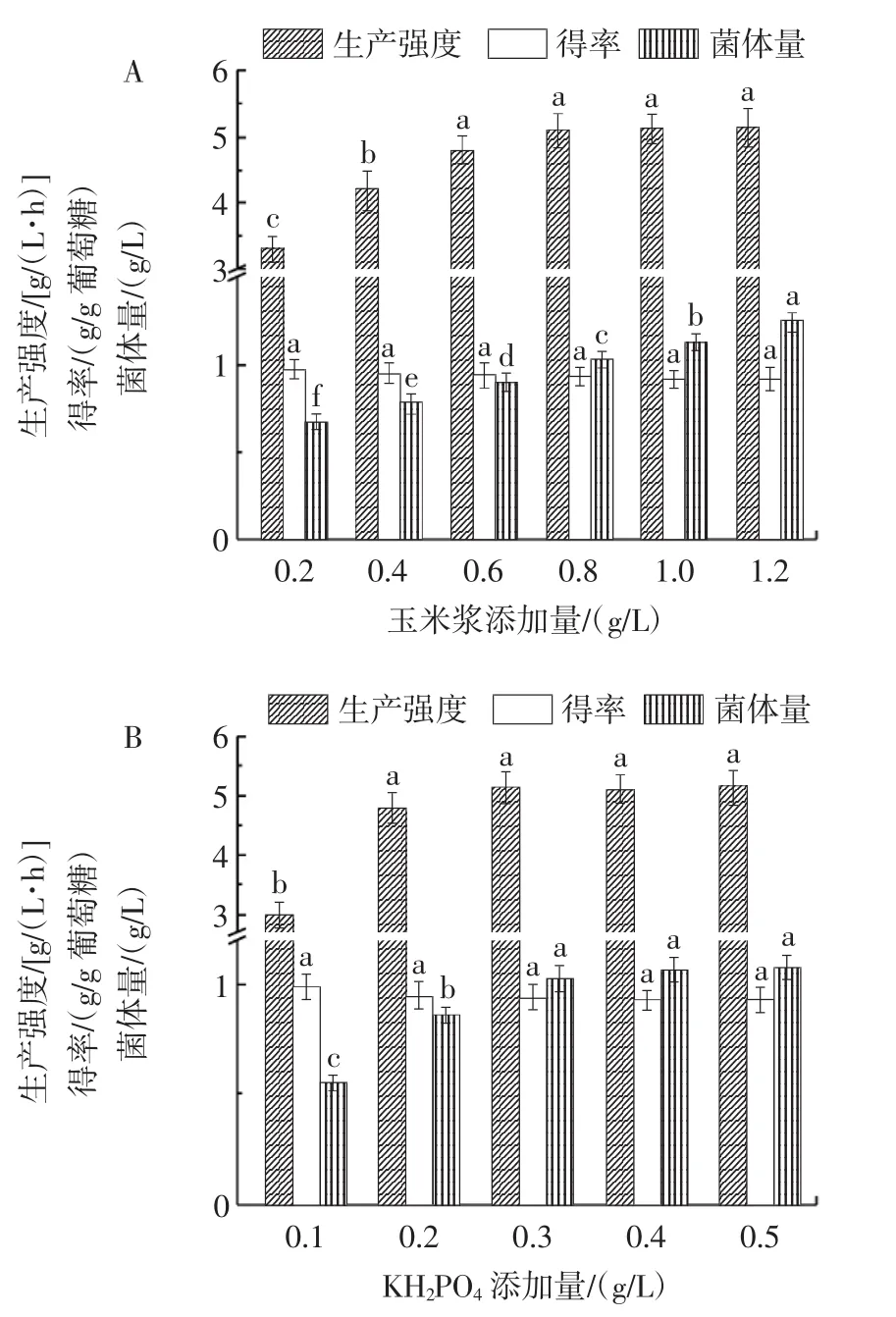
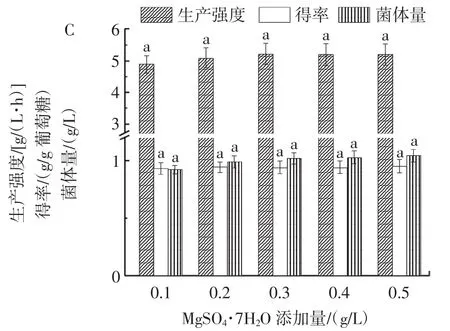
图1 培养基成分对黑曲霉AnM1发酵产葡萄糖酸的影响Fig.1 The effects of components in medium on gluconic acid fermentation production by Aspergillus niger AnM1
由图1A可知,培养基中玉米浆添加量对黑曲霉AnM1菌体生长和葡萄糖酸合成具有重要影响。玉米浆含有菌体生长所需的多种物质,随着培养基中玉米浆添加量的增加,菌体量逐渐增加。在玉米浆添加量为0.2 g/L~0.8 g/L时,黑曲霉AnM1葡萄糖酸生产强度由3.3 g/(L·h)提高至5.1 g/(L·h)。当玉米浆添加量继续增加时,葡萄糖酸生产强度不再提高,这种现象可能由菌体所含的葡萄糖氧化酶、过氧化氢酶总量和供氧量限制所导致[7-8]。当玉米浆添加量在0.8 g/L以下时,菌体生长量较少导致发酵体系中葡萄糖氧化酶和过氧化氢酶总量较少,酶总量是葡萄糖酸合成的限制性因素。当玉米浆添加量在0.8 g/L以上时,菌体量较大,菌体所含的葡萄糖氧化酶和过氧化氢酶总量不再是限制性因素,供氧量成为葡萄糖酸合成的限制性因素,因此葡萄糖酸生产强度不会继续随着菌体量的增加而增加。葡萄糖酸得率随着菌体量的增加逐渐下降,由0.97 g/g葡萄糖降至0.91 g/g葡萄糖,这可能是由于菌体生长和维持需要消耗一部分葡萄糖[7]。综合考虑葡萄糖酸生产强度和得率,玉米浆添加量选择0.8 g/L。
由图1B可知,培养基中KH2PO4添加量同样对黑曲霉AnM1菌体生长和葡萄糖酸合成具有重要影响。磷源是菌体生长所必需的物质,随着KH2PO4添加量的增加,黑曲霉AnM1菌体量和葡萄糖酸生产强度逐渐增加而后趋于平稳。造成这种现象的原因是当KH2PO4添加量高于0.3g/L时,玉米浆添加量是菌体生长的限制性因素,培养基中由于玉米浆提供的氮源、金属离子等不足限制了菌体的生长。结合玉米浆添加量优化试验,当玉米浆添加量为0.8 g/L、KH2PO4添加量为0.3 g/L时,菌体所含葡萄糖氧化酶和过氧化氢酶的总量不再是葡萄糖酸合成的限制性因素,由于供氧量限制,继续增加菌体量,葡萄糖酸生产强度并不会继续增加。因此,KH2PO4添加量选择0.3 g/L。
由图1C可知,培养基中MgSO4·7H2O添加量对黑曲霉AnM1菌体生长和葡萄糖酸合成影响不显著(p>0.05),当 MgSO4·7H2O 添加量为 0.3 g/L 时,葡萄糖酸生产强度[5.3 g/(L·h)]和得率(0.94 g/g葡萄糖)均较高,因此MgSO4·7H2O添加量选择0.3 g/L。
结合葡萄糖酸生产强度和得率确定了黑曲霉AnM1摇瓶发酵培养基成分。黑曲霉AnM1摇瓶发酵生产葡萄糖酸的生产强度和得率已达到其他已报道的高产葡萄糖酸黑曲霉菌株生产水平[5,22]。但是,黑曲霉AnM1摇瓶发酵过程中的葡萄糖酸生产强度远低于发酵罐中黑曲霉发酵过程[2-3,7-8],这是由于发酵罐的供氧水平明显高于摇瓶发酵过程,高水平的供氧能够明显提高葡萄糖酸的生产[7-8]。
2.2 黑曲霉AnM1菌体重复利用产葡萄糖酸
对黑曲霉AnM1菌体重复利用产葡萄糖酸进行研究,菌体收集和重复利用产葡萄糖酸在开放条件下进行,为避免杂菌污染,发酵液(转化液)中不添加氮源,仅含有葡萄糖、碳酸钙和消泡剂。图2为重复利用次数对黑曲霉AnM1菌体产葡萄糖酸的影响。

图2 重复利用黑曲霉AnM1菌体产葡萄糖酸Fig.2 Gluconic acid production by recycling the A.niger AnM1 mycelia
由图2可知,黑曲霉AnM1菌体重复利用也可高效生产葡萄糖酸。与直接发酵过程(图1C)相比,葡萄糖酸生产强度有明显提高,菌体重复利用前3次,葡萄糖酸生产强度均在7 g/(L·h)以上。这是由于菌体重复利用过程没有菌体生长与产酶阶段,菌体所含的葡萄糖氧化酶和过氧化氢酶直接催化葡萄糖合成葡萄糖酸,可以缩短发酵时间,因此与直接发酵过程相比生产强度明显提高。随着菌体重复利用次数的增加,葡萄糖酸生产强度逐渐下降,推测是由于长时间重复使用导致菌体破碎,部分葡萄糖氧化酶和过氧化氢酶脱离菌体释放到转化液中,离心回收菌体并不能将转化液上清液中的酶重新回收;同时,菌体长时间重复使用过程中葡萄糖氧化酶和过氧化氢酶酶活降低。菌体重复利用第5次,生产强度降至5.6 g/(L·h),与直接发酵[5.3 g/(L·h)]相近。与直接发酵过程(图1C)相比,黑曲霉AnM1菌体重复利用时葡萄糖酸得率也有所提高,达到1.02 g/g葡萄糖左右,这是由于菌体的重复利用几乎没有菌体生长,更多的葡萄糖用于葡萄糖酸合成。
2.3 黑曲霉AnM1纯化低聚异麦芽糖
利用黑曲霉AnM1菌体氧化低聚异麦芽糖反应液中的葡萄糖来提高低聚异麦芽糖纯度,结果如表1所示。
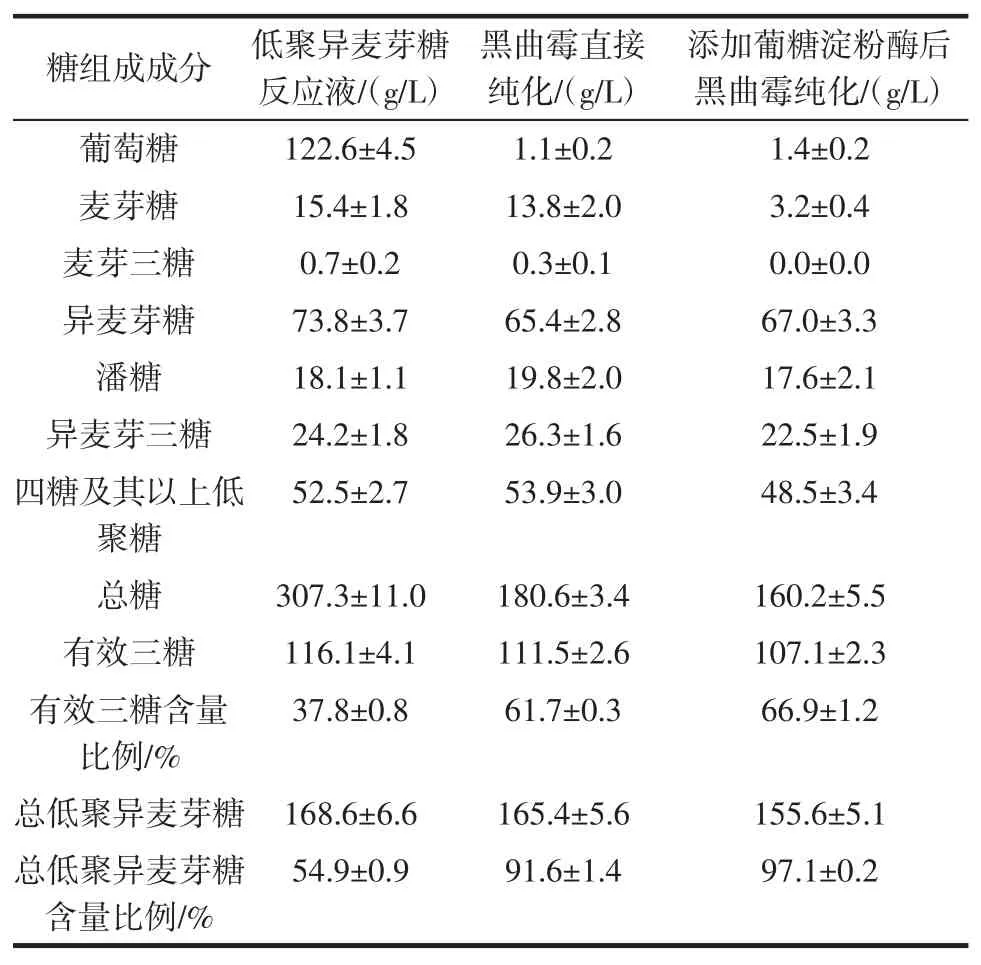
表1 低聚异麦芽糖溶液的糖组成成分Table 1 Composition of saccharides in isomaltooligosaccharides solution
由表1可知,α-葡萄糖苷酶催化麦芽糖溶液得到的低聚异麦芽糖反应液中总低聚异麦芽糖含量占总糖的54.9%,其中有效三糖含量占总糖的37.8%,符合GB/T 20881—2017《低聚异麦芽糖》中IMO-50型产品要求[17]。
低聚异麦芽糖反应液中葡萄糖含量达到122.6 g/L,占总糖含量的39.9%。黑曲霉直接纯化后的低聚异麦芽糖溶液中总低聚异麦芽糖含量占总糖的91.6%,其中有效三糖含量占总糖的61.7%,符合GB/T 20881—2017《低聚异麦芽糖》中IMO-90型产品要求[17]。因此,利用黑曲霉AnM1菌体将低聚异麦芽糖反应液中的葡萄糖氧化成葡萄糖酸,可以明显提高溶液中低聚异麦芽糖占总糖的比例,提高低聚异麦芽糖纯度。由表1还可以看出,黑曲霉AnM1菌体基本不会降解低聚异麦芽糖,不会降低低聚异麦芽糖收率。黑曲霉直接纯化过程没有使α-葡萄糖苷酶失活,α-葡萄糖苷酶可以继续发挥作用,因此异麦芽三糖、潘糖和四糖及其以上低聚糖的含量略有上升。
黑曲霉直接纯化后,溶液中麦芽糖是影响低聚异麦芽糖纯度的主要成分。因此,在黑曲霉纯化前,利用葡糖淀粉酶将麦芽糖水解成葡萄糖,然后利用黑曲霉氧化葡萄糖。因为葡糖淀粉酶具有缓慢水解α-1,6糖苷键的能力[23],为减少葡糖淀粉酶对低聚异麦芽糖的降解,在葡糖淀粉酶短时间作用后进行高温灭酶操作。由表1可以看出,添加葡糖淀粉酶后黑曲霉纯化溶液中低聚异麦芽糖含量有所降低,但总低聚异麦芽糖含量占总糖的比例提高至97.1%,其中有效三糖含量占总糖比例提高至66.9%。
利用黑曲霉AnM1纯化低聚异麦芽糖反应液后,离心收集菌体并重复用于直接纯化低聚异麦芽糖反应液,反应过程葡萄糖酸合成的分析结果见图3。

图3 重复利用黑曲霉AnM1菌体纯化低聚异麦芽糖Fig.3 Purification of isomaltooligosaccharides by recycling the A.niger AnM1 mycelia
由图3可知,黑曲霉AnM1菌体重复3次用于直接纯化低聚异麦芽糖反应液过程中,葡萄糖酸生产强度没有明显降低,重复利用5次的葡萄糖酸生产强度也在5 g/(L·h)以上,表明黑曲霉AnM1菌体可以重复应用于纯化低聚异麦芽糖。同时,黑曲霉AnM1菌体用于纯化低聚异麦芽糖反应液过程中,葡萄糖酸生产强度相比菌体重复利用产葡萄糖酸过程(图2)有所降低,这种现象是供氧量降低导致的。纯化低聚异麦芽糖过程反应液中总糖含量约为300 g/L,而菌体重复利用产葡萄糖酸过程葡萄糖浓度约为120 g/L,较高的糖浓度会影响氧传递,而供氧量下降导致了葡萄糖酸生产强度下降。
3 结论
本文对实验室保藏的黑曲霉AnM1发酵产葡萄糖酸进行了研究,结合葡萄糖酸生产强度和得率确定了发酵培养基的组成,优化后葡萄糖酸生产强度为5.3 g/(L·h)、得率为0.94 g/g葡萄糖。黑曲霉AnM1发酵产葡萄糖酸后收集的菌体可重复利用,用于催化葡萄糖氧化产葡萄糖酸。菌体重复利用前3次的葡萄糖酸生产强度在7 g/(L·h)以上,菌体重复利用5次生产强度降至5.6 g/(L·h)。与直接发酵过程相比,菌体重复利用过程葡萄糖酸得率也有所提高,达到1.02 g/g葡萄糖左右。因此,黑曲霉AnM1菌体重复利用可以提升葡萄糖酸发酵效率,降低发酵成本。
利用黑曲霉AnM1菌体氧化低聚异麦芽糖反应液中的葡萄糖可提高低聚异麦芽糖纯度。黑曲霉直接纯化后的低聚异麦芽糖溶液中总低聚异麦芽糖含量占总糖的91.6%,其中有效三糖含量占总糖的61.7%,符合GB/T 20881—2017《低聚异麦芽糖》中的IMO-90型产品要求,而且低聚异麦芽糖收率基本没有影响。利用葡糖淀粉酶将低聚异麦芽糖反应液中残留的麦芽糖水解成葡萄糖,然后利用黑曲霉纯化,总低聚异麦芽糖含量占总糖的比例提高至97.1%,其中有效三糖含量占总糖比例提高至66.9%,因此,黑曲霉AnM1菌体同样可以重复应用于纯化低聚异麦芽糖。利用黑曲霉AnM1可以将低聚异麦芽糖反应液中的葡萄糖和麦芽糖转化成容易分离的葡萄糖酸,且低聚异麦芽糖纯化效果好,工艺简单,并且可以得到副产品葡萄糖酸,具有很好的应用前景。
