基于分子模拟优化筛选甲磺隆特异性多肽
2023-01-30尚华赵雷兴秦月刘冰
尚华,赵雷兴,秦月,刘冰
(天津科技大学食品科学与工程学院,天津 300457)
甲磺隆是一种磺酰脲类除草剂[1-2],由于生物活性极高,甲磺隆在土壤中微量的残留就会对后茬敏感作物造成严重影响[3-4]。因此深入研究其环境行为、毒性作用、污染机制及生态效应,从而有效控制它对农业生态系统和农业生产造成的危害和损失,是十分紧迫的重要课题。甲磺隆残留的检测方法主要有高效液相色谱法(high performance liquid chromatography,HPLC)[5]、气相色谱法(gas chromatography,GC)[6]、酶联免疫测定法(enzyme-linked immunosorbent assay,ELISA)[7]等传统方法。液相色谱等大型仪器方法需要专业的仪器和技术人员,免疫方法获得抗体周期长、不确定性高,考虑到甲磺隆的应用场景,开发能够特异性识别甲磺隆的识别元件以及方便快捷灵敏的现场检测方法非常必要。
分子模拟技术现已成为各应用领域科研拓展的热点方向,希望能克服由实际试验中试验周期较长、类型众多以及复杂性大等实际问题所造成的局限性[8]。Ao等[9]应用分子模拟开发出一种使用分子印迹聚合物的高选择性样品净化方法。通过分子对接[10-11],可以找到受配体结合的最有利位置、方向和构象,其对接算法和评分函数能够生成受体-配体复合物的结构、评估结合能或亲和性。Davella等[12]借助AUTODOCK对接程序分析胡椒中的某些植物化学物质对COVID-19的主要蛋白酶的敏感度。目前,较为普遍使用的分子对接程序有 DOCK、LIBDOCK、AUTODOCK、CDOCKER等。分子对接通常包括3类,刚性对接、半柔性对接、柔性对接。本文中应用的CDOCKER程序[13]属于半柔性对接工具,应用CHARMm立场。
分子对接中的多肽片段对接也一直是对接领域的热门话题[14]。多肽是指将3个或3个以上的氨基酸分子以肽键方式连结到一起的肽。Kumar等[15]通过筛选一个针对牛胰蛋白酶的500条多肽片段Maybridge库,参与基于SAMPL3片段的虚拟筛选挑战并评估虚拟片段筛选方法。由于多肽具有免疫原性低、生物降解性好、穿透性高、合成和修饰容易以及高亲和力等优点,可作为特异性识别元件建立快捷灵敏的快速检测方法[16-18]。
基于此,本文创新性地应用分子模拟技术设计筛选特异性识别甲磺隆目标物的多肽,探索多肽作为识别元件在检测领域的应用。应用CDOCKER程序运行受配体对接,依据对接后蛋白空腔结构和关键作用氨基酸位置进行肽链的设计,并且应用虚拟氨基酸突变对所设计的多肽进行优化,依据分子对接结果对多肽初步筛选。应用量子点荧光淬灭免疫层析试纸条进一步验证模拟结果并考察试验结果和模拟结果的一致性。分子模拟技术优化筛选多肽具有省时、易制备储存、成功率高等多种优势,为快速获得特异性多肽作为识别元件建立快捷灵敏的快速检测方法提供新思路。
1 材料与方法
1.1 材料与试剂
甲磺隆的多肽序列P14:IAVGARFDDRVWGNISKWRQGMVTQWQS;P31:AILPVRDAYHNSDKFWFWLPKHEQGRGHWAEGYARASGKPGVV;P40:VTPMADAFADGIPMVVFTGQVPTSAIGTDAFQEADVVGISRSCTKWN(纯度98%,pH7.4磷酸盐缓冲液解):苏州金唯智生物科技有限公司合成;甲磺隆:国药集团化学试剂有限公司;羧基水溶性量子点:武汉珈源量子点公司;N,N-二甲基甲酰胺(N,N-dimethylformamide,DMF)、牛血清蛋白(bovine albumin,BSA)、钥孔血蓝蛋白(keyhole limpet hemocyanin,KLH)、二环己基碳二亚胺(dicyclohexylcarbodiimide,DCC)、N-羟基琥珀酰亚胺(N-hydroxy succinimide,NHS)、1-(3-二甲氨基丙基)-3-乙基碳二亚胺[1-(3-dimethylaminopropyl)-3-ethylcarbodiimide,EDC]:美国Sigma公司;其他试剂均为国产分析纯。
1.2 仪器与设备
Precision T7810系列工作站:美国Dell公司;涡旋混合器(HQ-60):北方同正生物技术发展有限公司;单道微量可调移液器、八道微量可调移液器、台式冷冻离心机(5810R):德国 Eppendorf公司;加热磁力搅拌器(RH-KT):美国 IKA 公司;分析天平(BL610):赛多利斯科学仪器(北京)有限公司;吸水垫、样品垫、结合垫:上海金标有限公司;超纯水系统(Milli-Q Integral)、酸纤维素膜:美国Millipore公司;紫外分析仪(ZF1-II):上海嘉鹏科技有限公司;真空干燥箱(ZK-40RS):天津三水科技发展有限公司。
1.3 方法
1.3.1 基于分子对接设计多肽
通过查阅文献得到甲磺隆作用于乙酰乳酸合成酶,因此在蛋白质数据库(http://www.rcsb.org/)中搜索乙酰乳酸合成酶,得到带有甲磺隆配体分子的乙酰乳酸合成酶的晶体结构(PDB ID:1T9A、1T9D)。将得到的蛋白质导入到DS程序,去除结构中多余亚基、水分子和配体,加氢,大分子模块下对蛋白质进行清理,之后设置参数准备蛋白质。在工具浏览器中选择模拟,对蛋白质施加CHARMm力场。之后选择“受体-配体相互作用”,在系统视图中选中整个蛋白质分子,定义该蛋白质为受体,并添加活性球。甲磺隆配体分子SDF文件(Conformer 3D_CID_52999)从网站(http://pubchem.ncbi.nlm.nih.gov)下载并导入DS程序,在小分子模块下将该配体进行准备及能量最小化等操作,之后在模拟板块下对该配体添加CHARMm力场。
在工具浏览器中的受体-配体相互作用一栏选择CDOCKER对接,在受体一栏选择已经定义好的受体蛋白(蛋白ID prep:蛋白ID),在配体一栏选择处理好的配体小分子,设置构象集群半径为0.5,其余参数默认,点击运行进行分子对接。对接完成后对蛋白质分子添加表面处理,观察对甲磺隆有活性的空腔结构,结合空腔的空间结构和影响受配体相互作用的关键氨基酸设计新的多肽。设计原则:保留关键作用位点的氨基酸、尽可能保留活性空腔的空间结构。将关键作位点截取后进行排列组合,得到新设计的多肽。
1.3.2 虚拟氨基酸突变优化多肽
为增强多肽的稳定性和亲和力,通过虚拟氨基酸突变来进一步优化多肽,将设计得到的每一条多肽均进行虚拟氨基酸突变。
将所选择的蛋白-配体复合物导入DS窗口,在系统视图中将配体重命名为Ligand。在工具浏览器中对该蛋白结构进行预处理并且添加CHARMm力场,并且以线性方式显示每一个原子,选择3Å范围内的氨基酸进行丙氨酸扫描,突变为丙氨酸后亲和力降低的氨基酸为关键氨基酸。将这些氨基酸继续进行饱和突变确定关键氨基酸最佳突变类型。突变后结合能没有明显变化或者降低则保持原有结构,突变后结合能明显提高的结构保留突变后的结构。
1.3.3 量子点荧光猝灭免疫层析试纸条验证
1.3.3.1 半抗原和包被原的制备
半抗原是指与目标分析物的结构相似,并具有反应活性基团的低分子质量的有机物[19]。在免疫试验中,半抗原的分子设计与合成是建立小分子免疫化学分析方法的关键步骤[20]。甲磺隆结构是由苯磺酰胺和三嗪环两部分组成,本文根据苯磺酰胺部分的结构进行甲磺隆半抗原的设计与合成[21]。
称取5.25 mg甲磺隆半抗原、4.12 mg DCC和2.3 mg NHS置于小棕瓶中,加入200 μL N,N-二甲基甲酰胺将其搅拌溶解,磁力搅拌常温(20℃~25℃)过夜(约12 h),即得A液;将20 mg KLH置于25 mL圆底烧瓶中,溶解于4 mL、0.13 mol/L NaHCO3缓冲溶液中,即得B液;将A液缓慢滴加到反应液B中,边滴加边搅拌,室温(20℃~25℃)下反应3 h。反应后将上清液置于透析袋中,在4℃下用磷酸盐缓冲液透析3 d,每8 h换一次透析液。透析后,得到包被原[7]。
1.3.3.2 胶体金及金标多肽探针的制备
采用柠檬酸三钠还原法制备胶体金[22]后,取胶体金溶液1mL置于1.5 mL进口安道管中,加入20 μL K2CO3(0.2 mol/L)和10μL多肽(1 mg/mL),混合均匀后,避光静置于4℃冰箱1 h;加入20%BSA溶液和10%PEG 20000溶液来封闭胶体金及稳定金标多肽,静置30 min;之后在4℃、2 000 r/min条件下离心15 min,以除去未能与多肽连接的胶体金,取上清液,在4℃、8 000 r/min条件下离心30 min,得到沉淀(金标多肽),pH7.4 PBS复溶后,4℃冰箱避光保存。
1.3.3.3 量子点-BSA的制备
采用活化酯法偶联羧基化水溶性量子点与BSA[23]。取25 μL量子点溶液于1.5 mL的安道管中,加入硼酸盐缓冲液(pH7.4)配制成的 2 mg/mL EDC 溶液 6 μL,搅拌均匀;加入 30 μL、10 mg/mLBSA 溶液,用硼酸盐缓冲液(pH7.4)将混合溶液的总体积补至 200 μL,将安道管置于摇床上反应3 h;应用超滤离心管在4℃、8 000 r/min的条件下浓缩3次,每次离心15 min,得到的浓缩物用硼酸盐缓冲液(pH7.4)复溶后置于4℃冰箱避光保存。
1.3.3.4 量子点荧光淬灭免疫层析试纸条组装及检测
量子点荧光淬灭免疫层析试纸条[24]组装示意图见图1。

图1 量子点荧光淬灭免疫层析试纸条组装示意图Fig.1 The assembly diagram of QDs fluorescence quenching immunochromatographic strip
如图1所示,硝酸纤维素膜、吸水垫、结合垫和样品垫依次粘贴在PVC背板上。将量子点-BSA、量子点-BSA与包被原混合物分别在硝酸纤维素膜上划线,作为试纸条的C线(质控线)和T线(检测线)。T线上包被原稀释倍数为2倍;T线和C线上量子点-BSA为稀释2倍。在对照组(不添加目标物)和试验组(添加1 mg/L甲磺隆溶液100 μL)中,分别添加等量的金标多肽探针,混合均匀后滴加到试纸条的样品垫处,10 min后,在紫外灯下观察C、T线的荧光强度(每组试验做3组平行,重复3次)。
C线作为质控线来判断试纸条的有效性而一直有荧光,而对照组中的T线由于未添加目标物,其荧光强度应明显低于试验组。这是因为在对照组中,不添加目标物,缓冲液与探针由毛细管作用力向上层析到达T线,从而使T线上的量子点与胶体金发生荧光共振能量转移[25],荧光强度减弱或荧光淬灭;在试验组中加入目标物,探针会先与目标物作用,使层析到T线的探针减少,从而荧光强度相比于对照组要更强。
2 结果与讨论
2.1 基于分子模拟设计多肽
应用分子模拟技术将下载的蛋白分别与甲磺隆小分子进行对接,根据蛋白与配体对接的空腔结构和关键相互作用氨基酸进行多肽的截取及结构的设计。图2为蛋白1T9A和蛋白1T9D分别与甲磺隆的分子对接结果。
如图2所示,在蛋白1T9A中,依据蛋白与配体对接结果设计P1~P4四条多肽;在蛋白1T9D中,依据蛋白与配体对接结果设计出P5~P30共26条多肽。肽链初筛序列及其分子对接能量打分值结果见表1。
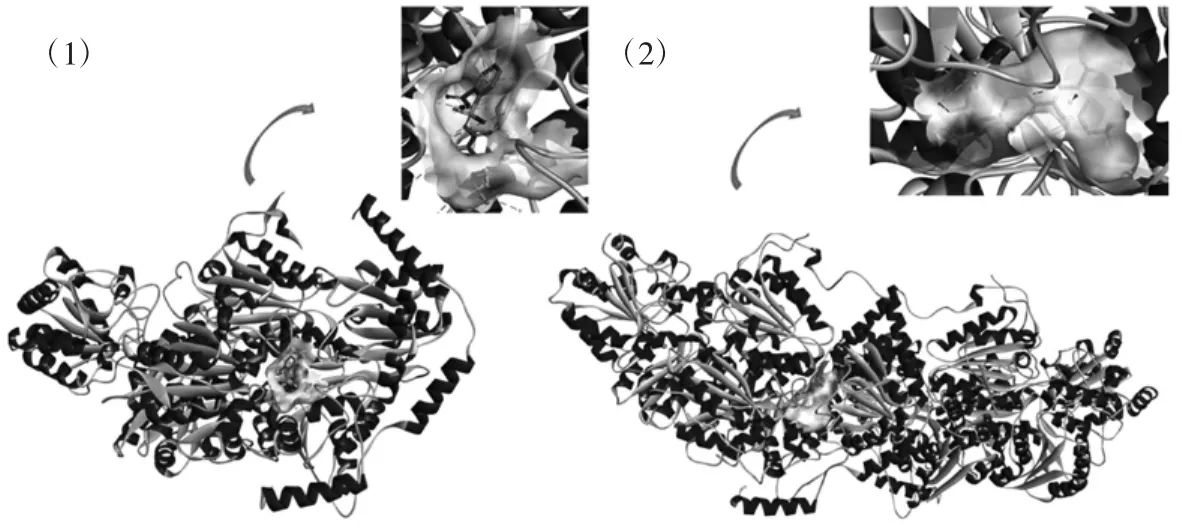
图2 蛋白1T9A和蛋白1T9D与甲磺隆对接的晶体结构及其相互作用示意图Fig.2 Crystal structure and interaction diagram of protein 1T9A and 1T9D docking with metsulfuron-methyl

表1 肽链初筛序列及其分子对接能量打分值结果Table 1 Preliminary screening sequence of peptide chain and results of molecular docking energy score
由表1可知,30条多肽与甲磺隆配体运行CDOCKER,对接结果皆良好。
2.2 运行虚拟氨基酸突变并构建多肽库
为获得亲和力和稳定性更加优异的多肽,运行虚拟氨基酸突变对多肽进一步优化。在表1中选择结合能较好的P1~P4以及P16、P17这6条多肽链进行突变。其中P3、P4、P16三条链突变之后结合能不变,因此保留原有结构。对P1进行多点饱和突变,当L3突变为 W3、N12 突变为 R12、Q16 突变为 W16、A26 突变为 W26,即 DMWGMHGCATARLAVWNADLIIAVGWPFDDR时,结合能为 -44.883 6 kCal/mol;对 P2进行多点饱和突变,当I4突变为Y4、T16突变为W16、E21突变为W21、E22突变为 R22,即 ADLYIAVGARFDDRVWGNISWRQGMVTQWQS时,结合能为-54.568 2 kCal/mol;对P17进行多点饱和突变,当Y10突变为 R10、I13突变为 Y13、N20突变为 W20、V22突变为W22、A30突变为R30,即YPGGAILPVRDAYHNSDKFWFWLPKHEGRGHWAEGYARASGKPGVV时,结合能-53.457 6 kCal/mol。
比较突变前的6条多肽和突变后的3条多肽的结合能,P3>P17>P1>突变后的 P1>P4>P2>P16>突变后的P17>突变后的P2,根据能量越低,多肽越稳定的原则,依次选出突变后的P2、突变后的P17和P16分别命名为S1、S2和S3,结果如表2所示,应用量子点荧光淬灭免疫层析试纸条方法进行实际验证。

表2 肽链初筛序列及其分子对接能量打分值结果Table 2 Preliminary screening sequence of peptide chain and results of molecular docking energy score
2.3 量子点荧光淬灭免疫层析试纸条验证模拟结果
基于胶体金对于量子点的荧光淬灭作用及目标物和包被原之间的竞争关系,建立基于荧光共振能量转移的量子点荧光淬灭免疫层析试纸条,利用紫外灯照射下的对照组和试验组之间的荧光强度差异来进一步验证多肽在实际应用中的可行性。
在其他条件相同的情况下,将3条多肽与胶体金进行偶联,合成3种荧光探针。应用同一批提前制备好的试纸条同时进行试验,进一步验证试验结果与分子模拟结果的一致性,结果如图3所示。

图3 量子点荧光淬灭免疫层析法验证多肽的有效性Fig.3 Verification of the effectiveness of polypeptides by QDs fluorescence quenching immunochromatography
如图3所示,相对于原始组,3条多肽在T线上的荧光强度均有所下降;而相比较对照组,3条多肽在T线上的荧光强度均增强,此结果表明3条多肽均能成功识别目标物,使能够层析到T线的探针减少,使与T线上包被原结合的探针减少,不能够大量猝灭T线上的量子点,导致T线的荧光强度高于对照组。多肽S1制备出的荧光探针T线的荧光强度更亮,说明在其他条件相同的情况下,相比于其他两条链,S1和目标物的识别能力更加优异,使得更多的探针与目标物结合,更少的探针得以进一步层析到T线淬灭量子点。在分子模拟的结果中,S1与目标物的对接结果也更加优异,结合能更低,肽链更加稳定,这表明模拟结果与实际验证结果具有良好的一致性,可以得出分子模拟优化筛选得到的多肽可以作为识别元件应用到实际的检测当中。
3 结论
应用分子模拟技术依据受配体相互作用的空腔结构及关键相互作用氨基酸,创新性的对多肽进行设计,运行虚拟氨基酸突变对设计得到的多肽进行突变,得到对接结果更加优异的30条多肽并且自建多肽库(P1~P30)。依据最终的对接自由能从中初步筛选出S1、S2、S3三条结合能更小、肽链更稳定的多肽,应用量子点荧光淬灭免疫层析试纸条方法进一步验证3条多肽作为识别元件的可应用性以及实际验证结果与分子模拟结果的一致性。验证结果表明分子模拟技术设计出的多肽能够成功识别目标物,并且实际验证结果和模拟结果具有良好的一致性,均是S1的表现更加优异。本试验方法成功优化筛选出可识别甲磺隆目标物的多肽,为今后其他目标物的多肽筛选工作提供参考。
