超声对α-淀粉酶活性和结构特性的影响
2023-01-30陈妍陈复生张丽芬张明珠
陈妍,陈复生,张丽芬,2*,张明珠
(1.河南工业大学粮油食品学院,河南 郑州 450001;2.河南省南街村(集团)有限公司,河南 漯河 462600)
淀粉酶作为一种基本的工业用酶,分为α-淀粉酶、β-淀粉酶和γ-淀粉酶[1]。其中α-淀粉酶是一种应用较为广泛的工业用酶,它可以作用于淀粉和其它多糖的内部α-1-4糖苷键[2],从而产生葡萄糖和麦芽糖等多种物质,目前工业上利用其生产了乙醇、高果糖玉米糖浆、食品、纺织物和洗涤剂等[2]。作为重要的大分子生物催化剂,酶分子具有高效性和特异性,是常用的化学催化剂的良好替代品。此外,酶促反应是在较为温和的条件下进行,所产生的副产物和污染少。因此,近年来,酶分子在制药、化工、生物、食品等行业的应用明显增加[3]。然而,酶分子在极端条件下具有相对较低的稳定性,并且在商业应用中成本颇高[4]。为了改善这些局限性,提高酶活力、稳定性、再利用能力和酶的效率成为了研究的热点。其中,研究多采用超声波处理、微波辐射、高静水压、超临界二氧化碳处理以及蛋白质工程修饰酶分子等方法对酶的特性进行改善[5]。例如,通过对酶分子表面的多聚赖氨酸修饰可以有效提高肌氨酸氧化酶的pH稳定性和热稳定性[6];还有研究者通过改善亚临界和超临界处理条件进而增强了α-淀粉酶的酶活力[7]等。由于生物技术在不断发展和吸引新方法,基于绿色和科学的原则,超声波作为绿色、科学以及高效的物理技术受到越来越多的关注。
超声波是一种音调高于人类听力范围的机械振荡声波,频率范围在20 kHz~10 MHz,根据不同的频率级别,超声波可以在不同的领域发挥重要的用途,例如医学、农业、材料科学、生物以及化学等,为新产品的开发和可持续生产提供技术支撑。超声波作为一种非热物理技术,还因其具有效率高、仪器要求低、经济可行性等优点,在食品工业中的应用越来越受到重视。当超声波通过液体介质时,会产生机械振动、声流和声空化。其中,声空化效应在食品行业中的应用尤为重要。空化现象的形成是由于液体中空穴的形成、生长和内爆崩塌,在此过程中会释放出大量高度局部化的能量,这就使得暴露在超声场的物质受其影响发生性质上的改变。目前,超声波在食品工业中的应用可分为低强度和高强度。其中,低强度超声是使用小振幅的超声波,这不仅会引起物质性质的有利变化,还可以加速某些化学反应和工业过程[8-9]。研究表明,在超声场环境下,酶的催化活性会因连续产生的空化流和气泡受到影响,超声波通过扰动酶的环和结构域来改变酶的三维结构,从而影响酶活力[10]。较低强度和短时间的超声波处理有利于提高酶活力,并且超声波还能在不改变酶结构完整性的情况下,使分子发生有利的构象变化[11],例如低强度超声可以激活β-D-葡萄糖苷酶的活性,使其具有活性位点的α-螺旋结构含量增加,从而使酶活力增强,反之随着超声强度的增加则会抑制其活性[12]。以上研究表明,超声技术可以通过改变酶的构象从而改善其功能并促进酶和底物之间的相互作用,这为酶的修饰提供了新的思路与技术手段。
综上所述,本研究通过探讨超声处理对α-淀粉酶酶活力的影响,并且利用米氏方程、圆二色谱和荧光光谱分析超声对α-淀粉酶动力学参数和分子结构的影响,阐明超声作用下α-淀粉酶酶活力的变化机制,表明超声处理能够提高反应速度和催化效率的潜在优势,为超声在酶促反应中的应用提供参考。
1 材料与方法
1.1 主要试剂
可溶性淀粉、无水葡萄糖、3,5-二硝基水杨酸、磷酸二氢钠、磷酸氢二钠、氢氧化钠(均为分析纯):天津市科密欧化学有限公司;α-淀粉酶(50 U/mg):上海源叶生物科技有限公司。
1.2 主要设备
TU-1901型紫外可见分光光度计:北京普析通用仪器有限责任公司;SCIENTZ-ⅡD型超声波细胞粉碎机、DC-2006型节能型智能恒温槽:宁波新芝生物科技股份有限公司;PHS-3C型精密pH计:上海大普仪器有限公司;XMTD-4000电热恒温水浴锅:北京市永光明医疗仪器有限公司;MOS 450圆二色谱仪:法国比奥罗杰公司;MY17040001荧光分光光度计:安捷伦科技有限公司;GL224-1SCN电子分析天平:赛多利斯科学仪器(北京)有限公司。
1.3 试验方法
1.3.1 样品制备
取50 mL、pH6的磷酸盐缓冲溶液,提前预热至45℃,加入α-淀粉酶使其充分溶解后摇匀,作为试验样品备用。
1.3.2 酶活力测定
参照Souza等[13]的方法并加以修改,绘制葡萄糖标准曲线,用于测定α-淀粉酶酶活力。定义酶活力单位(1 U)为在试验条件下每分钟释放1 μmol还原糖所需的酶量(mg)。将可溶性淀粉溶液作为α-淀粉酶的水解底物,酶解反应时间固定为15 min,反应结束后,立即加入1 mol/L HCl进行灭酶处理。然后加入3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)试剂,在沸水浴煮沸5 min,取出至冷却后,加蒸馏水定容至25 mL。立即用紫外可见分光光度计在540 nm处测定吸光度,根据绘制的葡萄糖标准曲线y=0.594 0x-0.018 1(R2=0.997 8),求得酶活力。
1.3.3 单因素试验
选择超声功率密度(1.90、2.85、3.80、4.75、5.70W/cm3)、超声处理时间(5、15、25、35、45 min)、超声温度(25、35、45、55、65℃)进行单因素试验。以未超声处理的α-淀粉酶的酶活试验为对照,探究各因素对α-淀粉酶酶活力的影响。
1.3.4 酶促动力学试验
以底物浓度分别为 1.6、3.2、4.8、6.4、8.0、9.6 mg/mL的可溶性淀粉溶液作为反应底物,加入超声处理与未处理的α-淀粉酶溶液分别进行水解反应。反应结束后,立即加入1 mol/L HCl灭酶,然后加入DNS试剂,在沸水浴中加热5min,取出冷却后,用蒸馏水定容至25 mL。用紫外可见分光光度计在540 nm处测定吸光度。采用Lineweaver-Burk方程作双倒数曲线来判定超声处理对α-淀粉酶的酶促动力学影响。
Michaelis-Menton方程如下。

Lineweaver-Burk方程如下。
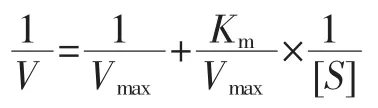
式中:V为初始反应速率,mg/(mL·min);S为底物浓度,mg/mL;Vmax为最大初始反应速率,mg/(mL·min);Km为米氏常数,mg/mL。
1.3.5 圆二色谱测定
参照Yu等[14]的方法并加以修改,在室温(25±1)℃下,利用圆二色谱仪对α-淀粉酶进行光谱扫描。圆二色谱仪以扫描速度为50 nm/min进行扫描,记录α-淀粉酶从190 nm到250 nm的圆二色谱(circular dichroism,CD)变化。CD 数据以平均残基椭圆率[θ]表示,单位为(deg·cm2)/dmol,并利用 CD pro软件计算得出 α-淀粉酶的α-螺旋、β-折叠、β-转角、无规则卷曲含量。以不含α-淀粉酶的磷酸盐缓冲溶液作为空白溶液。
1.3.6 荧光光谱测定
参照Yu等[14]的方法并加以修改,使用荧光分光光度计在室温(25±1)℃下,在激发波长278 nm(狭缝=5 nm)、发射波长300 nm~500 nm(狭缝=5 nm)下测量样品的荧光发射光谱。以不含α-淀粉酶的磷酸盐缓冲溶液作为空白溶液。
1.4 数据处理
数据以平均值±标准差表示。利用SPSS 26.0和Microsoft Excel 2016对试验数据进行处理分析,并采用ANOVA方差分析进行显著性检验(P<0.05)。
2 结果与分析
2.1 超声条件对α-淀粉酶酶活力的影响
超声对α-淀粉酶酶活力的影响见图1。

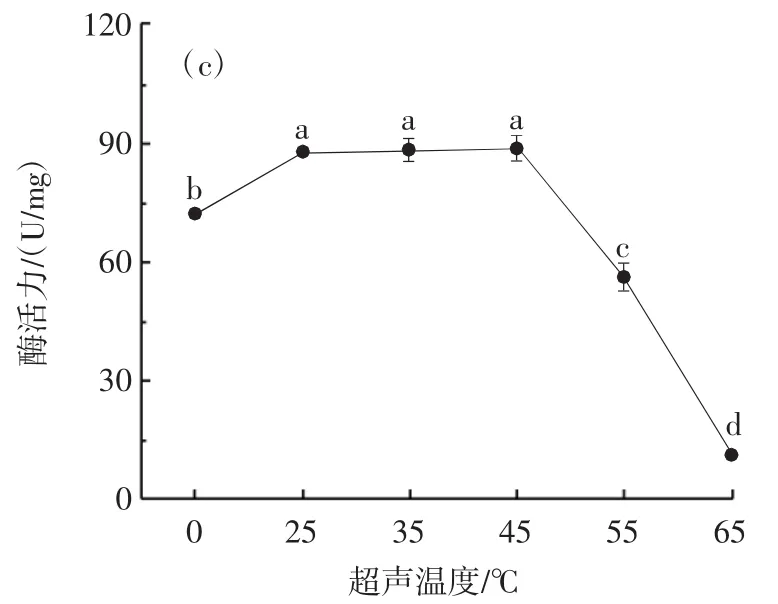
图1 超声波对α-淀粉酶的酶活力的影响Fig.1 Effect of ultrasound on α-amylase activity
由图1(a)可知,超声处理后,随着超声功率密度的增加,α-淀粉酶酶活力整体呈现上升趋势,在超声功率密度为2.85 W/cm3时酶活力达到最高,与未经超声处理的α-淀粉酶酶活力相比提高了14.30%,但当超声功率密度继续增大时,α-淀粉酶酶活力变化差异不显著(P>0.05)。与传统的热变性不同,低强度的超声不会对酶的活性位点造成破坏,这与文献[14]通过探究超声波对木瓜蛋白酶和胃蛋白酶的研究结果一致。超声处理可以通过破坏弱相互作用,如氢键或范德华力等,从而引起酶结构的构象变化,而超声波作用产生的稳定空化气泡振荡所产生的力可以直接作用于酶分子使得酶聚合体分散,并且也能够通过改变酶分子结构使得酶分子活性位点暴露,从而提高酶活力[14]。因此,选择2.85 W/cm3为最佳超声功率密度。
由图1(b)可知,α-淀粉酶酶活力在超声5 min时显著增加(P<0.05),之后随着超声时间的延长趋于稳定。在低频和中等强度的液体超声处理时会形成稳定的空化效应,而稳定的空化气泡崩塌产生的剪切力会改变酶构象,从而导致更多的活性位点暴露。随着超声时间的延长,α-淀粉酶在稳定的空化作用下,结构未被破坏,保持了原有的活性[15]。且超声处理过程中出现的稳定空化现象是α-淀粉酶酶活力增强的原因[16]。因此,选择5 min为最佳超声时间。
由图1(c)可知,随着超声温度的升高,α-淀粉酶酶活力呈先上升后明显下降的趋势,在温度为45℃时活力达到最高。这表明超声波处理可以在低温下刺激α-淀粉酶的活性,低温环境下,超声波所产生的空化效应更好,并且高温会削弱酶的活性,这与Souza等[13]的结论一致,Souza等[13]的研究表明,在最佳的超声温度下可以更有效地破坏如氢键、偶极吸引和范德华力等相互作用,并且空化效应会提高微区温度,形成的局部高温导致蛋白质发生热失活以及蛋白质中的键发生热裂解,对蛋白质的结构与功能造成不利影响[15],继而使得酶活力降低甚至失活。因此,选择45℃为最佳超声温度。
2.2 超声条件对α-淀粉酶的酶促动力学影响
在超声功率密度2.85 W/cm3、超声温度45℃、超声时间5 min的处理条件下,探究超声对α-淀粉酶的酶促动力学影响,与未经超声处理的α-淀粉酶进行对照。Lineweaver-Burk图见图2,根据图2计算获得的Vmax和Km值见表1。

图2 α-淀粉酶的Lineweaver-Burk图Fig.2 Lineweaver-Burk plot of α-amylase

表1 超声处理对α-淀粉酶动力学参数的影响Table 1 Effect of ultrasound treatment on kinetic parameters of α-amylase
由图2和表1可知,与未经过超声处理的α-淀粉酶相比,超声处理后的α-淀粉酶的Vmax增加9.56%,Km降低了23.58%。超声通过提高反应速率、增强酶与底物的结合来促进反应。而超声使得α-淀粉酶Km减小可能是由于超声空化产生的压力、剪切力和温度,使得α-淀粉酶更多的活性位点暴露,使其易于与底物结合,表现出较强的酶促反应能力[17-18]。试验结果与研究者利用超声波技术改善纤维素酶的酶促反应传质速度所得结论相一致,这种现象是超声空化引起的机械效应所产生的结果[10]。
2.3 超声对α-淀粉酶结构的影响
超声处理后的α-淀粉酶的CD光谱分析结果见图3,α-淀粉酶的二级结构含量信息见表2。

图3 超声处理对α-淀粉酶的CD光谱的影响Fig.3 Effect of ultrasound treatment on CD spectra of α-amylase

表2 超声处理对α-淀粉酶的二级结构含量的影响Table 2 Effect of ultrasound treatment on content of secondary structural elements of α-amylase
根据图3可知,CD光谱在190 nm~200 nm呈现正峰谱带,这是α-螺旋与β-折叠结构所形成的重合峰,222 nm和208 nm左右的波谷也显示了α-螺旋结构的存在,同时β-折叠结构在CD光谱中显示为210 nm~220 nm区域呈负峰谱带,205 nm~225nm的CD图谱显示主要为α-螺旋和β-折叠叠加的结果[19]。经过超声处理后,α-淀粉酶的二级结构特征峰的波长没有发生明显位移,但是对应的峰强度发生了变化。并且结合表2可知,与未经超声处理样品相比,α-淀粉酶的α-螺旋和无规则卷曲含量降低,β-折叠的含量增加。分析β-折叠含量的增加可能是由α-螺旋和无规则卷曲结构转化而来。经过超声处理后α-淀粉酶的结构含量变化归因于超声压力变化和湍流等诱导的结构转变[15],从而可能影响了酶的活性位点。超声处理使得α-淀粉酶的结构表现得更具有规律性和柔韧性,同时无规则卷曲含量的降低使其结构从无序变得更加有序,这不仅能够提高酶的活性,同时还提高了酶的稳定性。
荧光光谱能有效地表征蛋白质及其空间构象的变化,通过对蛋白质的发色基团进行监测,可以有效地判定发色基团的物理环境变化以及可能与其发生共价结合的化学基团的性质,其中以色氨酸的荧光光谱变化为主。超声处理α-淀粉酶的荧光光谱分析结果见图4。

图4 超声处理对α-淀粉酶的荧光光谱的影响Fig.4 Effect of ultrasound treatment on fluorescence spectra of α-amylase
蛋白质三级结构的变化可以通过分析蛋白质分子表面的色氨酸残基的荧光强度以及最大吸收波长(λmax)来判定[20-21]。由图4可知,超声处理前后的α-淀粉酶的最大吸收波长未发生明显位移,表明温和的超声场环境并不会破坏蛋白质的空间结构,且有利于维持α-淀粉酶的活性。而超声处理后α-淀粉酶荧光强度降低,可能是由于α-淀粉酶表面色氨酸含量的减少。α-淀粉酶经过超声处理后向外暴露的内部区域数量的增加,掩埋了原本处于分子表面的色氨酸[22],因此结果表现为荧光强度降低。研究结果显示的α-淀粉酶荧光强度降低,与超声波对葡聚糖酶的影响结果一致[23],说明温和的超声处理条件不仅不会破坏酶分子的空间结构,反而使其三级结构更加整齐有序且提高了酶分子的稳定性。低强度的超声处理能够诱导蛋白质分子去折叠,破坏蛋白质分子的疏水相互作用,使得α-淀粉酶的三级结构更加整齐有序,并且导致分子内更多的基团和区域暴露,因此,低强度超声能够提高α-淀粉酶酶活力[14]。
3 结论
研究超声条件对α-淀粉酶的酶活影响的结果表明,与未处理的α-淀粉酶相比,在超声功率密度2.85 W/cm3、超声时间5 min、超声温度45℃条件下,α-淀粉酶的酶活力提高了22.30%。经超声处理后得到的α-淀粉酶的水解反应满足米氏动力学方程,且Km值降低,Vmax值升高。根据圆二色谱和荧光光谱分析结果可知,超声处理使得α-淀粉酶的二级结构中β-折叠含量上升、无规则卷曲含量下降,以及表面色氨酸含量降低,超声处理能够使得酶分子结构更加整齐和具有规律性,空间构象发生了有利转变,说明超声对α-淀粉酶酶促反应具有积极的促进作用。研究结果为超声在酶反应中的应用提供了参考。
