食用菌固态发酵对玉米粉抗氧化活性的影响
2023-01-30仲雪陈晓明王乃娟梁建芬
仲雪,陈晓明,王乃娟,梁建芬*
(1.中国农业大学食品科学与营养工程学院植物源功能食品北京市重点实验室,北京 100083;2.天津市农业科学院,天津 300384;3.农业农村部农产品贮藏保鲜重点实验室,天津 300384;4.浙江舟富食品有限公司,浙江 舟山 316200)
玉米的种植面积和总产量与小麦和水稻相当,它们并称三大粮食作物。玉米籽粒含有约72%淀粉、10%蛋白质、4%脂肪和14%水分,可作为人类膳食碳水化合物、蛋白质的重要来源,还可提供维生素B、维生素E和人体必需的矿物质以及植物活性物质(如木酚素、酚酸、类胡萝卜素、植物甾醇、皂苷等)[1-2]。
玉米作为食品原料存在营养品质不均衡和加工特性不能满足要求的问题。近年来,研究人员采用微生物发酵技术,在改善谷物营养与原料加工特性方面开展了大量研究。利用谷物原料自身携带及环境中的微生物自然发酵,可以增加稻米、小米、燕麦和玉米中的赖氨酸含量,提高谷物的蛋白质品质[3]。米根霉和乳酸菌混合固态发酵燕麦,在提高其总酸含量、必需氨基酸指数和生物价的同时,还会使发酵后的燕麦总多酚含量和体外抗氧化能力明显提高、可溶性蛋白和氨基态氮明显增加、蛋白质水解度提高[4]。近年来,很多研究者将重点关注到发酵处理对谷物抗氧化活性的影响,研究内容涉及谷物基质、发酵剂及发酵条件的作用效果等多个方面。Xu等[5]选择Agaricus bisporus AS2796、Helvella lacunosa X1和Fomitiporia yanbeiensis S.Guo&L.Zhou 3种食用真菌作为发酵剂,以小麦、水稻、燕麦、玉米、小米、藜麦、荞麦、大豆、豌豆和高粱作为谷物发酵基质进行固态发酵。研究发现,处理后的谷物样品的抗氧化性能均明显优于未接种处理的谷粒原料。A costa-Estrada等[6]的研究发现,米曲霉、珍珠平菇、蓝色平菇和猴头菌4种食用菌固态发酵处理可提高玉米副产品中的游离酚类化合物和可溶性膳食纤维的含量,同时,产品的抗氧化能力也会增强。Zhai等[7]采用巴西蘑菇和双孢蘑菇在玉米粉上固态发酵。结果表明,真菌固态发酵提高了玉米蛋白质营养价值、游离多酚含量和抗氧化性能。
综合分析已有的研究结果和玉米粉特点,本研究选取白灵菇、猴头菇、灰树花、香菇和羊肚菌5种食用菌为发酵剂,采用固态发酵处理玉米粉,筛选可在玉米粉基质上生长良好且产品抗氧化活性明显改善的食用菌,进一步分析产品的总可溶性酚、总黄酮和还原糖等化学组分的含量,研究抗氧化活性和活性物质的相关性,为改善玉米营养和食用菌资源的扩大利用提供参考。
1 材料与方法
1.1 材料与试剂
白灵菇(Pleurotus nebrodensis)、猴头菇(Hericium erinaceus)、灰树花(Grifola frondosa)、香菇(Lentinus edodes)、羊肚菌(Morchella esculenta):天津市农业科学院提供;玉米粉(水分含量11.65%、过100目筛):金沙河集团有限公司;马铃薯葡萄糖肉汤、马铃薯葡萄糖琼脂培养基:北京酷来搏科技有限公司;1,1-二苯基-2-苦基肼(1,1-diphenyl-2-picrylhydrazyl,DPPH):梯希爱(上海)化成工业发展有限公司;2,2’-联氨-双(3-乙基苯并噻唑啉-6-磺酸)二胺盐[2,2'-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS]、没食子酸标准品、磷酸二氢钾:上海麦克林生化科技有限公司;奎诺二甲基丙烯酸酯(Trolox):上海阿拉丁生化科技股份有限公司;芦丁标准品、3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS):北京索莱宝科技有限公司;福林酚试剂:北京博奥拓达科技有限公司;无水硫酸镁、维生素B1:上海源叶生物科技有限公司;试验所用试剂均为分析纯。
1.2 仪器与设备
超声波清洗机(BXXW-220DC):北京博宇宝威实验设备有限公司;恒温振荡器(THZ-98C)、电热恒温培养箱(DHP-9162)、电热鼓风干燥箱(DHG-9123A):上海一恒科学仪器有限公司;台式高速冷冻离心机(TGL-16A):长沙平凡仪器仪表有限公司;紫外-可见分光光度计(754):上海菁华科技仪器有限公司;超级洁净工作台(BCN-1360):北京东联哈尔仪器制造有限公司。
1.3 方法
1.3.1 食用菌的活化与扩大培养
加富马铃薯葡萄糖琼脂培养基(potato dextrose agar,PDA)配制:46 g马铃薯葡萄糖琼脂培养基、1.5 g硫酸镁、1.5 g磷酸二氢钾、30 mg维生素B1、1 L水。
活化:PDA倒平板,用接种针从斜面培养基中挑取一小块菌块,菌丝向下接种于平板正中央,以保证菌丝生长均匀。每个菌株接种3个平板,25℃培养10 d。
扩大培养:PDA倒平板,选取生长状况较好的活化菌株,在菌丝边缘打孔(内径7 mm)得到菌块,挑取菌块,将菌丝向下接种于平板正中央,25℃培养13 d。
1.3.2 发酵产物的制备
发酵基质的制备:将25 g玉米粉装入三角瓶中,密封,灭菌(温度121℃、时间20 min),冷却至室温25℃。在超净工作台,按照料水比1∶1(g/mL)向三角瓶中加无菌水并搅拌均匀。
发酵产物的制备:在长满菌丝的平板外缘均匀打圆孔(内径7 mm),用接种针挑取5个菌块菌丝向下均匀接种于玉米粉培养基质上,25℃恒温培养。
每发酵7 d取出3瓶发酵样品,将样品60℃热风烘干,粉碎过60目筛,-20℃保存备用。以不接菌块的玉米粉作为对照(0 d)。
1.3.3 菌丝生长情况评分
记录菌落形态、菌丝萌发、表面生长情况与满瓶情况,参考罗莹等[8]和化雪艳等[9]的方法对菌丝生长情况进行评分,评分标准见表1。

表1 菌丝长势评分标准Table 1 Scoring criteria for mycelial growth
1.3.4 菌丝体核酸含量的测定
参照魏培莲等[10]的方法进行核酸含量的测定。
菌丝体的获得:液体培养得到的鲜湿菌丝于热风干燥箱中60℃烘至恒重,得到干菌丝,研碎得到菌丝粉,置于干燥器中备用。
核酸提取及含量测定:称取不同质量的菌丝粉,加入25 mL 5%三氯乙酸溶液,80℃水浴搅拌25 min,取出后冰浴,经离心处理(8 000 r/min、4℃、15 min)后取上清液,稀释适当倍数(羊肚菌稀释10倍,其他稀释5倍),以5%三氯乙酸溶液作空白对照,于260 nm处测定上清液的吸光度。
标准曲线绘制:以菌丝体质量为横坐标,吸光度为纵坐标绘制菌丝质量-核酸紫外吸收标准曲线,具体见表2。

表2 菌丝体质量与核酸紫外吸收标准曲线Table 2 Standard curve of mycelium mass and nucleic acid UV absorption
1.3.5 发酵产物菌丝量测定
称取0.25 g(精确至0.001 g)干燥的发酵培养物,按照1.3.4提取核酸并测定260 nm下的吸光度,利用表2的标准曲线换算为发酵产物的菌丝体质量。
1.3.6 发酵产物的抗氧化组分的提取
准确称取1 g(精确至0.001 g)样品,置于50 mL离心管中,加入10 mL 80%乙醇,超声波辅助提取40 min,提取产物离心(4 000 r/min、10 min)处理,收集上清液并再次提取残渣,提取物再次离心,将两次得到的上清液合并,用80%乙醇定容至25 mL,得到发酵产物的抗氧化组分的提取液。
1.3.7 DPPH自由基清除能力测定
参考Xu等[11]的方法并作调整。在0.5 mL提取物中加入3.5 mL 40 mg/L DPPH溶液,避光静置30 min,在517 nm处测定吸光度。结果以每克干基样品中含有的Trolox当量表示(μmol TE/g DW)。
1.3.8 ABTS+自由基清除能力测定
参考Zhang等[12]的方法进行测定。结果以每克干基样品中含有的Trolox当量表示(μmol TE/g DW)。
1.3.9 铁离子还原能力测定
参考李建立等[13]的方法进行测定,结果以每克干基样品中含有的Trolox当量表示(μmol TE/g DW)。
1.3.10 总可溶性酚含量的测定
采用Akpabli-Tsigbe等[14]的方法进行总可溶性酚含量的测定,总可溶性酚含量表示为每克干基样品中没食子酸当量毫克数(mg GAE/g DW)。
1.3.11 总黄酮含量的测定
总黄酮含量采用氯化铝比色法进行测定,参考曾子聪[15]的方法进行测定,总黄酮含量以每克干基样品中含有的毫克芦丁当量表示(mg RT/g DW)。
1.3.12 还原糖含量测定
参考樊晓辉等[16]的方法,采用3,5-二硝基水杨酸法测定。还原糖含量以每克干基样品中含有的毫克葡萄糖当量表示(mg/g DW)。
1.4 数据处理与分析
数值以平均值±标准差表示,采用SPSS25.0软件进行显著性分析和相关性分析,以P<0.05代表存在显著性差异,具有统计学意义。采用Origin 2018软件作图。
2 结果与分析
2.1 食用菌在玉米粉基质上的生长情况
不同食用菌在玉米粉基质上进行固态发酵,其过程中生长的外观及菌丝长势评分见图1和表3。

图1 食用菌发酵玉米粉期间菌丝生长状况Fig.1 Mycelial growth status during the fermentation of corn flour by edible fungi
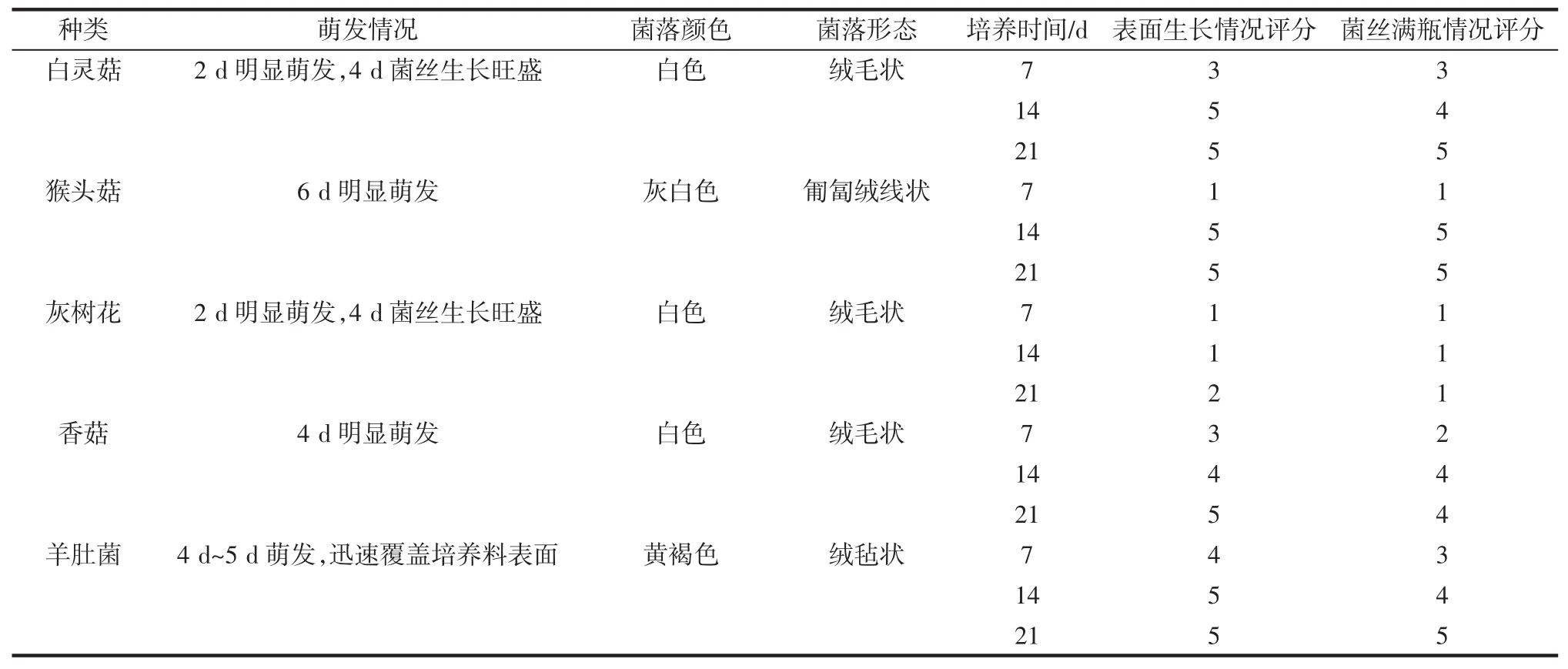
表3 食用菌发酵玉米粉的菌丝生长情况及评分Table 3 The status and score of mycelial growth during the fermentation of corn flour by edible fungi
综合图1和表3可知,白灵菇、灰树花和香菇3种食用菌在接种后的4 d内萌发,前期快速萌发,生成白色绒毛状菌丝,羊肚菌、猴头菇萌发相对缓慢。对比表面生长和满瓶情况评分可以看出,羊肚菌菌丝长势最快,7 d内迅速覆盖培养基质表面并不断向内部延伸,呈黄褐色绒毡状,在14 d后菌丝生长呈满瓶状态。猴头菇为灰白色匍匐绒线状菌丝,前期长势评分最低,14 d~21 d长势评分最高,说明猴头菇接种后起初生长缓慢,7 d~14 d内生长迅速,在14 d后菌丝覆盖培养基表面并穿透玉米粉基质底部。灰树花菌丝生长速度最慢,菌丝长势表面及满瓶情况评分均最低,在发酵21 d时仍未覆盖基质的表面。白灵菇、香菇生长状况接近,发酵14 d后菌丝长势表面及满瓶情况评分为4分及以上,菌丝长势均匀、浓密,基本覆盖培养基表面,且基本达到满瓶状态。
菌丝生物量也是表征食用菌生长情况的重要指标,核酸含量同菌丝生物量线性相关,发酵产物的核酸含量是量化真菌固态发酵产物的菌丝生物量的可靠手段[17]。发酵期间的菌丝质量情况如图2所示。

图2 食用菌发酵玉米粉期间菌丝质量变化Fig.2 Changes in mycelial biomass of edible fungi fermented corn flour products
由图2可知,发酵14 d后,猴头菇菌丝质量最大,其次是羊肚菌>白灵菇>香菇>灰树花。猴头菇前7 d生长相对较快,但菌丝质量低于羊肚菌,7 d~21 d生长迅速,在发酵14 d时生长速率及菌丝质量超过羊肚菌,这一结果与菌丝生长情况的外观结果一致(图1和表3)。化雪艳等[9]在利用猴头菇固态发酵杜仲叶渣和杜仲皮试验中也发现猴头菇在菌丝萌发阶段生长缓慢,但菌丝满瓶后,快速生长,这与本研究中猴头菇菌丝的生长趋势一致。5种食用菌的生长均基本符合丝状真菌生长曲线[18]。
综合菌种的萌发、菌丝的生长和菌丝质量变化,白灵菇、香菇固态发酵玉米粉的适宜时间为7 d,羊肚菌为14 d,猴头菇的时间应不少于21 d,灰树花菌丝生长速度较慢,不适宜用于玉米粉发酵处理。
2.2 食用菌固态发酵处理的玉米粉抗氧化能力分析
2.2.1 DPPH自由基清除能力
食用菌发酵玉米粉产物DPPH自由基清除能力变化见图3。
补偿来源:电厂和用户分担的模式,其中电厂限于在市场竞争中占据资源和政策优势的电厂,例如优先发电厂。分担的方式可以根据优先发电厂的承受能力确定补贴金额,剩余部分由用户根据枯水期电量承担。

图3 食用菌发酵玉米粉产物DPPH自由基清除能力变化Fig.3 DPPH radical scavenging activity of corn flour fermented with edible fungi
由图3可知,发酵21 d后,猴头菇对玉米粉的DPPH自由基清除能力的改善程度最高,其次是羊肚菌、白灵菇。猴头菇和白灵菇发酵21 d时样品的DPPH自由基清除能力最强,分别较发酵0 d提高了8.08倍和1.02倍,羊肚菌发酵14 d时DPPH自由基清除能力最强,较0 d提高了4.91倍。Xu等[5]在研究食用真菌固态发酵小麦、水稻、燕麦、玉米、小米、藜麦、荞麦、大豆、豌豆和高粱时也发现,各种发酵谷物的DPPH自由基清除能力明显优于未接种处理的谷粒原料。灰树花和香菇发酵产物的DPPH自由基清除能力在发酵过程中有降低的情况,表明灰树花和香菇的发酵处理对玉米粉的DPPH自由基清除能力无改善效果。Guimarães等[19]的研究也发现了类似的结果,采用7种担子菌发酵处理麻风树饼粕和棉籽饼后,发现产品的DPPH自由基清除能力降低,并推测这种降低可能与真菌产生的氧化酶有关。
2.2.2 ABTS+自由基清除能力
食用菌发酵玉米粉产物ABTS+自由基清除能力变化见图4。

图4 食用菌发酵玉米粉产物ABTS+自由基清除能力变化Fig.4 ABTS+radical scavenging activity of corn flour fermented with edible fungi
由图4可知,与DPPH自由基清除能力类似,猴头菇发酵对玉米粉的ABTS+自由基清除能力的改善程度最高,其次是羊肚菌、灰树花、香菇和白灵菇。猴头菇发酵21 d时产物的ABTS+自由基清除能力最强,较0 d提升了1.61倍。羊肚菌发酵产物的ABTS+自由基清除能力在发酵14 d达到最大值,较0 d提升了1.12倍。灰树花、白灵蘑和香菇发酵7 d时产物的清除能力最强,分别较 0 d 提升了 0.56、0.58、0.40 倍。Song等[20]利用桑黄菌固态发酵处理的玉米产物的ABTS+自由基清除能力也明显提升。
2.2.3 铁离子还原能力
食用菌发酵玉米粉产物铁离子还原能力变化见图5。

图5 食用菌发酵玉米粉产物铁离子还原能力变化Fig.5 Ferric reducing antioxidant power of corn flour fermented with edible fungi
由图5可知,5种食用菌处理对玉米粉还原能力的改善效果依次为羊肚菌>猴头菇、灰树花>白灵菇、香菇。羊肚菌发酵14 d时玉米粉产品的还原能力最强,较0 d提高了1.59倍。猴头菇和灰树花发酵产物的铁离子还原能力在发酵7 d时达到最大值(分别是对照的1.92倍和1.84倍),在14 d时明显下降,发酵21 d时,还原能力明显提高。研究发现双孢蘑菇固态发酵玉米产物提取液的还原力随发酵时间的延长而明显增加[21],而Zhai等[22]利用姬松茸固态发酵的糜米产物的还原能力随发酵时间的延长也呈现先升后降再升的趋势。
2.3 食用菌固态发酵处理的玉米粉提取物活性物质含量分析
2.3.1 总可溶性酚含量
食用菌发酵玉米粉产物总可溶性酚含量测定结果见图6。

图6 食用菌固态发酵玉米粉产物中总可溶性酚含量变化Fig.6 The total soluble phenolic content of corn flour fermented with edible fungi
2.3.2 总黄酮含量
食用菌发酵玉米粉产物总黄酮含量测定结果见图7。

图7 食用菌固态发酵玉米粉产物中总黄酮含量变化Fig.7 The total flavonoid content of corn fermented with edible fungi
由图7可知,除猴头菇和灰树花发酵7 d时,总黄酮含量高于未发酵玉米粉外,其他菌株发酵不同时间均未增加发酵产物的总黄酮含量。在利用米根霉3.1175和米根霉3.2751固态发酵玉米的试验中也监测到发酵前后的总黄酮含量没有显著性差异,且米根霉3.2751发酵玉米组总黄酮含量略低于未发酵玉米[24]。
2.3.3 还原糖含量
食用菌发酵玉米粉产物提取液中还原糖含量测定结果见图8。

图8 食用菌发酵玉米粉提取液还原糖含量变化Fig.8 The reducing sugar content of extracts of fermented corn flour
由图8可知,除猴头菇外,其他4种食用菌发酵产物80%乙醇提取液中还原糖含量在固态发酵后均有较大提高,说明在发酵过程中可能产生高活性的α-淀粉酶,使相当比例的淀粉转化为糊精和还原糖。猴头菇和羊肚菌发酵产物提取液中还原糖含量的变化相对较小。可能是因为羊肚菌和猴头菇菌丝生长快,在发酵过程中淀粉虽然可以降解为还原糖,但还原糖迅速被菌丝消耗,因此还原糖的变化不明显[22]。
2.4 食用菌固态发酵处理的玉米粉提取液中活性物质含量与抗氧化能力的相关性分析
利用相关分析研究各食用菌发酵处理产物的提取物中总可溶性酚、总黄酮和还原糖含量与DPPH自由基、ABTS+自由基清除能力和铁离子还原能力之间的相关关系,使用Pearson相关系数表示相关关系的强弱情况,具体结果见表4。

表4 食用菌发酵产物抗氧化活性与提取液活性物质含量相关系数Table 4 Correlation coefficient between antioxidant capacity and active components in extract of fermented corn flour
由表4可知,白灵菇和灰树花发酵产物的ABTS+自由基清除能力和铁离子还原能力,猴头菇发酵产物的DPPH自由基清除能力和ABTS+自由基清除能力以及羊肚菌发酵产物的3种抗氧化指标与总可溶性酚含量显著正相关。综合5种食用菌发酵产物的抗氧化能力和总可溶性酚含量之间的关系,总可溶性酚与DPPH自由基清除能力、ABTS+自由基清除能力和铁离子还原能力之间全部呈现出极显著的正相关关系。猴头菇发酵产物的DPPH自由基清除能力和ABTS+自由基清除能力及羊肚菌发酵产物的3种抗氧化指标与总黄酮含量显著负相关。不同发酵产物提取物在还原糖含量与抗氧化指标的相关性方面的表现差异较大,其中羊肚菌发酵产物的3种抗氧化能力与提取液中还原糖含量均为显著的正相关关系。
不同食用菌发酵产物的抗氧化活性与活性物质含量之间的相关关系不同,可能是因为产物所含抗氧化化合物的类型以及它们的浓度不同[25]。酚类化合物具有较强的抗氧化活性,其含量是评价植物抗氧化活性的标准之一[26]。尽管总体上总可溶性酚含量与抗氧化活性之间呈现正相关关系,但有时发酵产物总可溶性酚含量的大小与抗氧化活性强弱并不完全对应,同时不同产物的总黄酮和还原糖含量与抗氧化指标相关关系各异。一方面可能是因为活性物质的稳定性和抗氧化活性会受到许多因素的影响,例如酚类化合物可能受酶降解和氧化的影响[6,27]。另一方面,产物中可能存在其他抗氧化成分。例如,菌丝体中可能存在的类胡萝卜素、维生素C和维生素E等抗氧化物[28-29]和固态发酵过程中可能产生麦角硫氨酸等物质[30]。从图7可以发现提取物中的总黄酮含量较少,在提取物的抗氧化能力上起到的作用较小[31]。同时,提取液中还原糖含量与其抗氧化能力的大小并不一致,说明还原糖对提取液抗氧化能力的贡献较小。
3 结论
本研究的结果表明,在5种食用菌种中,猴头菇和羊肚菌菌丝在玉米粉基质上生长状况良好,对玉米粉的抗氧化活性改善效果较佳,猴头菇和羊肚菌在玉米粉基质上的适宜发酵时间分别为21 d和14 d。
5种食用菌固态发酵处理产物的80%乙醇提取物中总可溶性酚、总黄酮和还原糖的含量以及活性物质含量与其抗氧化活性之间的相关性结果表明,5种食用菌固态发酵处理玉米粉均显著提高了产物的总可溶性酚含量,但不同食用菌发酵产物的抗氧化活性和各活性物质含量之间的相关关系表现不一致。猴头菇和羊肚菌固态发酵产物的总可溶性酚含量与抗氧化指标之间均呈现一定的正相关关系,猴头菇发酵产物的DPPH自由基、ABTS+自由基清除能力和羊肚菌发酵产物的3种抗氧化能力大小与总黄酮含量显著负相关,羊肚菌发酵产物的3种抗氧化能力与提取液中还原糖含量显著正相关。
