NLRP3炎症小体参与运动改善胰岛素抵抗的机制研究进展①
2023-01-19胡淑娟龙佩林李先辉汪献旺吉首大学体育与科学学院吉首416000
胡淑娟 龙佩林 陈 平 李先辉 龚 权 汪献旺(吉首大学体育与科学学院,吉首 416000)
胰岛素抵抗(insulin resistance,IR)是2型糖尿病(type 2 diabetes mellitus,T2DM)最重要的发病机制,伴随糖尿病发生发展的全过程。T2DM的主要病理特征表现为血糖水平升高,靶器官(如肝脏、骨骼肌、脂肪组织等)对胰岛素敏感性降低引发IR[1]。研究发现,慢性炎症是导致T2DM的重要病理生理因素,主要表现为多种炎症因子水平升高,包括Nod样受体蛋白3(Nod-like receptor protein 3,NLRP3)炎症小体、IL-1β等炎症细胞因子。其中,NLRP3炎症小体在炎症、胰岛素信号传导及IR中起核心作用,与IR值呈正相关[2]。因此,调控NLRP3炎症小体是改善IR的重要因素。研究显示,运动可抑制NLRP3炎症小体,激活磷脂酰肌醇-3-激酶(phosphatidylino‐sitol 3-kinase,PI3K)/蛋白激酶B(protein kinase B,Akt)信号通路,改善糖尿病诱导的炎症及IR,参与葡萄糖稳态调节,可能是缓解T2DM的重要机制[3]。因此,《中国2型糖尿病防治指南(2020年版)》建议预防和改善T2DM需要改变不良生活方式,坚持体育锻炼[4]。但运动如何调控NLRP3炎症小体活性介导不同靶组织的IR信号及分子调控机制尚缺乏系统及深入的研究。本文梳理了NLRP3炎症小体在IR中的作用,并总结了不同运动方式对NLRP3炎症小体的影响,从胰腺、脂肪、肝脏及骨骼肌等方面综述运动改善IR的分子机制研究进展,以期为代谢性疾病的运动干预提供理论支持。
1 NLRP3炎症小体
NLRP3炎症小体是一种多蛋白复合物,负责激活炎症反应,在先天免疫和炎症相关疾病发生过程中具有重要作用。NLRP3炎症小体一方面可识别病毒、细菌等病原微生物,辅助抵御外来威胁;另一方面可识别内源危险信号,如胆固醇结晶、尿酸盐结晶、高迁移率族蛋白B1、细胞外碎片、细胞外囊泡和游离脂肪酸(free fat acid,FFA),在消除机体异常状态过程中发挥重要作用[5]。NLRP3炎症小体是由NLRs(NOD-like receptor,NLR)家族成员核心蛋白NLRP3、凋亡相关斑点样蛋白(apoptosis-associated speck-like protein,ASC)和半胱天冬氨酸酶(Cas‐pase-1)组成的多蛋白复合体,是目前结构和功能最为明确、机制最清楚的炎症小体[6]。NLRP3炎症小体激活分为两步,首先核因子κB(nuclear factor kap‐pa-B,NF-κB)激活NLRP3和前IL-1β表达。随后通过活性氧(reactive oxygen species,ROS)、溶酶体损伤或细胞溶质钾离子流出触发NLRP3炎症小体形成[7]。NLRP3炎症小体激活后进一步活化Caspase-1,激活并分泌IL-1β和IL-18,诱发机体炎症反应[8]。
2 NLRP3炎症小体与IR
PI3K/Akt信号通路可调节代谢。PI3K/Akt信号通路阻滞是IR及T2DM发生的基本机制之一[9]。NLRP3炎症小体是慢性炎症的核心因素,与胰岛素信号、糖耐量及IR密切相关。研究发现,NLRP3炎症小体、Caspase-1和IL-1β表达及活性均与IR和T2DM进展相关[3]。NLRP3炎症小体由多种危险相关分子模式触发,与细胞表面受体结合激活促炎途径,诱导Caspase-1、IL-1β、IL-6和TNF-α等促炎细胞因子产生,进一步干扰胰岛素信号,导致葡萄糖摄取失败和IR,引发T2DM[10]。代谢信号分子如葡萄糖、FFA、饱和脂肪酸(saturated fatty acid,SFA)及胰岛淀粉样蛋白(islet amyloid polypeptide protein,IAPP)沉积等导致ROS过量产生,并诱导硫氧还蛋白相互作用蛋白(thioredoxin interacting protein,TXNIP)从硫氧还蛋白(thioredoxin,TRX)中分离,使其与NLRP3炎症小体结合[11-12]。NLRP3炎症小体活化后分泌IL-1β,激活c-Jun N-末端激酶(c-Jun N-ter‐minal kinase,JNK),诱导胰岛素受体底物1(insulin receptor substr substrate 1,IRS-1)丝氨酸磷酸化,抑制Akt蛋白激酶表达,抑制胰岛素敏感组织中胰岛素/PI3K/Akt信号通路,导致IR(图1)[13-14]。同时,T2DM患者血清及脂肪组织检测到NLRP3、ASC、Caspase-1和IL-1β蛋白表达显著增加,提示T2DM患者体内NLRP3炎症小体大量活化[15]。而NLRP3炎症小体活化可作用于机体胰腺、脂肪组织、肝脏、骨骼肌等组织。胰腺中NLRP3炎症小体激活可降低β细胞功能,导致β细胞功能障碍,促进IR[16]。脂肪组织中,活化的NLRP3炎症小体加重脂肪组织炎症,抑制脂肪酸氧化,增加脂肪分解,引发IR[17]。肝脏组织中,激活的NLRP3炎症小体可降低胰岛素敏感性,增加肝脏脂肪变性[18]。骨骼肌中,NLRP3炎症小体可降低葡萄糖摄取和葡萄糖转运蛋白4(glucose transporter 4,GLUT4)表达,并抑制其向浆膜转移,导致IR[19]。综上,NLPR3炎症小体在介导IR中发挥重要作用,因此,调节NLRP3炎症小体将有助于改善IR。
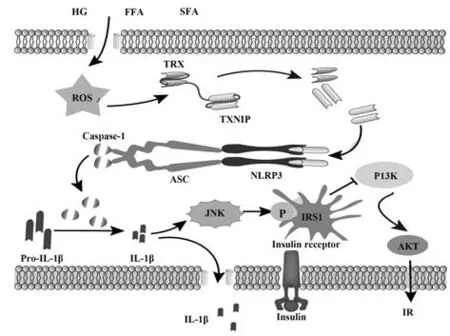
图1 NLRP3炎症小体在IR中的作用机制Fig.1 Mechanism of NLRP3 inflammasome in IR
3 运动与NLRP3炎症小体
运动与炎症小体活动的关联性在国内外备受研究者关注,研究结果显示,运动是调控NLRP3炎症小体的一种重要非药物方式,在改善IR及T2DM中发挥积极作用。但不同运动方式(如急性运动、抗阻运动、有氧运动、高强度间歇运动等)对NLRP3炎症小体表达的影响不同。研究发现,急性运动对NLRP3炎症小体活性的影响主要取决于运动强度[20-21]。KHAKROO等[20]研究发现,急性中等强度运动对健康青年男性外周血单个核细胞中的NLRP3炎症小体、IL-1β及IL-18活性无影响,而急性高强度运动则可激活NLRP3炎症小体、IL-1β及IL-18。COMASSI等[21]研究也表明单次极限运动可增加未经训练男性的血液淋巴单核细胞中NLRP3、Caspase-1和IL-1β表达,而训练的个体中NLRP3、Caspase-1和IL-1β表达降低或不受影响。提示一次性急性运动及急性高强度运动均可促进NLRP3炎症小体及相关因子活化,并与运动强度有关。
慢性运动与NLRP3炎症小体研究中,不同形式的慢性中等强度运动均可抑制NLRP3炎症小体及相关因子表达[20,22]。研究证实,4周以上跑台运动能显著抑制鼠类脂肪组织、肝脏、海马中NLRP3炎症小体过度激活[22-24]。慢性游泳运动和自主车轮运动也能抑制NLRP3炎症小体活化[25-26]。此外,研究显示,抗阻训练及慢性高强度间歇运动同样抑制NLRP3炎症小体激活[6,22]。人体研究也发现,慢性运动可显著降低血清中NLRP3和IL-1β、IL-18水平,抑制ASC、Caspase-1激活,改善糖尿病诱导的炎症,降低IR,并参与葡萄糖稳态调节[20]。如ZAIDI等[27]发现,T2DM患者经过1年的运动训练,促炎标志物水平降低,尤其是IL-18水平明显降低。另有研究表明,8周有氧运动可降低糖尿病大鼠前额皮质NF-κB及NLRP3活性,增强PI3K/Akt活性,通过抑制炎症信号通路改善胰岛素信号通路[28]。可见,中等强度的慢性运动可通过抑制NLRP3炎症小体过度激活改善胰岛素敏感性,从而缓解IR。提示运动强度与急性运动对NLRP3炎症小体活性的影响密切相关,而不同形式慢性中等强度运动可抑制NLRP3炎症小体表达。此外,运动可通过抑制NLRP3炎症小体增强PI3K/Akt活性改善IR。但目前运动对NLRP3炎症小体的影响研究中动物实验居多,缺少人体实验,若从人体角度进行更深入的研究可为运动调控NLRP3炎症小体促进机体健康提供更科学的依据。
关于运动调控NLRP3炎症小体的机制研究相对不足。研究表明,运动调控NLRP3炎症小体可能与改善线粒体功能、减少ROS产生及抑制NF-κB表达等有关[23,29-30]。2011年,ZHOU等[31]首次报道线粒体参与NLRP3炎症小体激活。研究发现,线粒体来源的分子包括mtDNA、mtROS、心磷脂及过多Ca2+等均可活化NLRP3炎症小体[32]。而慢性中等强度运动促进线粒体生物生成,增强抗氧化能力,抑制NLRP3炎症小体过度激活[29]。慢性中等强度运动可改善线粒体功能,减少mtROS产生,抑制NLRP3炎症小体活化,减轻炎症反应。此外,ROS过量产生及NF-κB可激活NLRP3炎症小体,而运动可抑制ROS过量产生及NF-κB表达[7,23,30,33]。由于NLRP3炎症小体的激活机制较为复杂,而运动对其机制的影响研究较为有限。若进一步探讨运动对NLRP3炎症小体的影响,可对运动调控NLRP3炎症小体的机制进行更完整的阐述。提示运动调控NLRP3炎症小体可能与运动改善线粒体功能,降低ROS及NF-κB表达有关。
4 NLRP3炎症小体在运动改善IR靶器官组织中的作用机制
IR和炎症是T2DM的基本病理事件和潜在特征,IR发生的靶组织主要有胰腺、脂肪组织、肝脏和骨骼肌。实验证实,破坏小鼠肝脏、骨骼肌或脂肪组织中的胰岛素信号会引发IR,并可能导致糖尿病[34]。运动是预防及改善T2DM的首选方法,可降低T2DM发生率,并通过调控NLRP3炎症小体改善胰腺、脂肪组织、肝脏和骨骼肌IR。
4.1 改善β细胞功能 β细胞功能下降或障碍是T2DM发病的重要原因。T2DM患者表现为胰腺β细胞炎症、IR及NLRP3、IL-1β等炎症因子表达增加[35]。β细胞中的NLRP3炎症小体可感知缺氧、ER应激和高血糖(hyperglycemia,HG),导致胰岛炎症和β细胞功能障碍[16]。因此,抑制NLRP3及IL-1β活性可提高β细胞功能,有效增强T2DM患者血糖控制,改善IR。研究表明,运动可有效抑制NLRP3炎症小体活化,改善IR及β细胞功能。HEIS‐KANEN等[36]发现2周运动训练可改善糖尿病前期或T2DM血糖及β细胞功能,有效减少胰腺内异位脂肪。PAULA等[37]发现8周跑台训练可提高糖尿病啮齿动物β细胞存活率,减轻β细胞损失,改善β细胞分泌功能。YUAN等[38]研究表明,阻力训练能较少氧化应激、内脏脂肪及相关炎症标志物,增强线粒体氧化能力,增加有效β细胞数量,改善β细胞功能。
IAPP沉积、HG和FFA均能激活NLRP3炎症小体[39]。TXNIP可通过ER应激引起NLRP3炎症小体激活[40]。ROS增加可导致NLRP3炎症小体活化,通过ROS/TXNIP/NLRP3通路参与β细胞炎症反应[16]。活化后的NLRP3炎症小体直接或间接抑制PI3K/Akt信号通路损害胰岛素敏感性,导致IR(图2A)。研究表明,运动可降低TXNIP、ROS及NLRP3表达,减少β细胞炎症,改善β细胞功能。ROSA等[24]发现,4周跑步训练可降低TXNIP表达,抑制TXNIP和NLRP3炎症通路激活。YANG等[23]研究证明,12周跑台训练显著降低高脂饮食小鼠NLRP3炎症小体表达,抑制ROS过量产生。LI等[30]研究发现,4周跑台运动可激活糖尿病大鼠PI3K/Akt信号通路,抑制NLRP3/IL-1β信号通路,减少炎症状态。运动也可通过激活IRS-1/PI3K/Akt途径增强T2DM患者胰岛素敏感性,改善β细胞功能[8]。可见,运动可抑制NLRP3炎症小体及相关蛋白表达,降低β细胞炎症及提高β细胞功能,改善IR。
4.2 减少脂肪组织炎症NLRP3炎症小体及IL-1β在脂质代谢和脂肪组织功能中起重要作用,过度激活可引发脂肪组织炎症[41]。研究发现,T2DM患者脂肪组织中NLRP3、Caspase-1和IL-1β水平均显著升高[42]。脂多糖(lipopolysaccharide,LPS)、棕榈酸(palmitic acid,PA)、神经酰胺(ceramide,Cer)、SFA、HG、IAPP、ER应激、同型半胱氨酸(homocysteine,Hcy)、ROS过量等均能激活脂肪组织NLRP3炎症小体[3,17,33,43-47]。另 外,抑 制 腺 苷 酸 活 化 蛋 白 激 酶(AMP-activated protein kinase,AMPK)可提高烟酰胺腺嘌呤二核苷酸磷酸氧化酶(nicotinamide adenine dinucleotide phosphate,NADPH)表 达 促 进ROS产生,从而活化NLRP3炎症小体[48]。过氧化物酶体增殖物激活受体(peroxisome proliferator-activated re‐ceptor γ,PPARγ)在脂肪细胞发育和葡萄糖稳态中起重要作用。抑制PPARγ激活可促进NF-κB信号传导,激活NLRP3炎症小体,促进脂肪组织炎症[49]。NLRP3炎症小体活化后一方面可产生IL-1β,抑制IRS-1/PI3K/Akt信号,诱导脂肪组织炎症,导致IR[10];一方面可诱导Caspase-1激活,引发IR;另一方面增加IL-18和IFN-γ表达,导致IR(图2B)[3]。
运动可通过减少脂肪组织中NLRP3及相关炎症因子表达,缓解脂肪组织炎症改善IR。夏书宇[50]发现,10周跑台运动可提高高脂饮食大鼠脂肪组织PPARγ及 脂 联 素 表 达,降 低TNF-α水 平,通 过PPARγ/脂联素/TNF-α减少脂肪积累。VANDAN‐MAGSAR等[3]首次报道在T2DM患者皮下脂肪组织中,热量限制联合运动显著降低了体重和脂肪细胞体积,改善了胰岛素敏感性,显著抑制了IL-1β和NLRP3 mRNA表达。此外,降低IL-1β和NLRP3表达与血糖降低和胰岛素抵抗指数改善呈正相关。LEE等[26]发现,训练过的肥胖小鼠脂肪组织中NLRP3水平降低,伴随血浆IL-18水平降低。MARDARE等[22]证实10周抗阻训练和耐力训练均能降低Cer表达,抑制NLRP3炎症小体,提高葡萄糖耐受能力,且在抗阻训练中更为明显,耐力训练则降低IL-18更为明显,提示不同运动方式对脂肪组织炎症的影响存在差异。可见,NLRP3炎症小体及相关蛋白在运动降低脂肪组织炎症中扮演重要角色。
4.3 降低肝脏脂肪变性 肝脏IR由脂肪变性驱动,脂肪变性抑制肝脏葡萄糖产生及降低糖原合成能力,使肝脏中脂质合成增多[51]。最近研究发现,T2DM患者肝脏中NLRP3、IL-1β和IL-18基因表达显著增加[41]。NLRP3炎症小体过度激活降低胰岛素敏感性,增加肝脏脂肪变性[18]。肝脏是循环Cer的主要来源,Cer可激活NLRP3炎症小体[49]。SFA可通过Toll样受体4(Toll-like receptors,TLR-4)激活NF-κB通路,并引发NLRP3炎症小体活化[52]。肝脏脂肪变性也可激活NF-κB,促进NLRP3、IL-1β及IL-6分泌,引起肝脏IR[53]。PA引发AMPK失活,增加线粒体ROS,活化NLRP3炎症小体[54]。NLRP3炎症小体激活后一方面促进IL-6分泌,直接引发IR[41];另一方面产生IL-1β,抑制胰岛素受体底物(IRSs)磷酸化及PI3K表达,导致肝脏IR(图2C)[1,55]。

图2 运动抑制NLRP3炎症小体改善IR的可能机制Fig.2 Possible mechanism by which exercise inhibits NLRP3 inflammasome to improve IR
运动可降低三酰甘油水平,减少NLRP3表达及肝脏脂肪变性改善IR。如DINIZ等[56]发现,8周有氧训练可激活AMPK,减轻肥胖小鼠肝脏脂肪变性和炎症,改善IR。三酰甘油是肝脏脂肪变性的重要因素,而运动可激活AMPK信号降低肝脏中三酰甘油 和SFA水 平,改 善 肝 脏 脂 肪 变 性 及 炎 症[51,57]。YANG等[23]研究证明,12周跑台训练显著降低高脂饮食小鼠肝细胞NLRP3炎症小体表达,抑制ROS过量产生,有效改善肝脏脂肪变性。MACHADO[58]发现,即使在没有减肥的情况下,运动也能减少肝脏脂肪,对肝脏有独立的抗脂肪生成作用。总之,运动能够降低ROS、NLRP3等促炎因子水平,缓解肝脏炎症,减少肝脏脂肪变性,改善IR。
4.4 提高骨骼肌葡萄糖摄取 约80%葡萄糖摄取发生于骨骼肌,其代谢紊乱直接影响葡萄糖代谢和机体胰岛素敏感性。肌肉分泌炎症递质及骨骼肌葡萄糖摄取减少与IR发展有关[59]。机体存在IR时,骨骼肌中NLRP3炎症小体、IL-1β和GSDMD蛋白含量增加,主要机制为肌肉中GLUT4蛋白表达减少[19,60]。研究证明,SFA和FFA增加TLR-4及NF-κB活性,促进肌细胞中TNF-α释放,引发单核细胞趋化蛋白1(monocyte chemotactic protein-1,MCP-1)增加,抑制骨骼肌IRS-1/PI3K/Akt传导信号,降低胰岛素敏感性[61-63]。值得注意的是,TNF-α在肌细胞中可直接引起葡萄糖摄取受损和IR[64]。另外,NF-κB活化驱动TNF-α分泌,激活NLRP3炎症小体,降低葡萄糖转运活性[65]。骨骼肌中脂滴相关蛋白(perili‐pin 2,PLIN2)也能激活NLRP3炎症小体[66]。NLRP3炎症小体活化后一方面直接减弱骨骼肌胰岛素信号转导,增加骨骼肌IR(图2D、E)[67];另一方面分泌IL-1β,抑制PI3K/Akt信号,减少GLUT4表达,产生IR[10]。
研究发现,中低强度有氧运动能有效抑制T2DM大鼠骨骼肌NF-κB表达,降低氧化应激反应,从而抑制骨骼肌炎症[68]。另外,运动对骨骼肌NLRP3炎症小体的影响与运动强度及运动时间有关。研究表明,长时间中等强度运动能抑制大鼠骨骼肌NLRP3炎症小体活化,而低强度和中等强度的急性运动均增加小鼠骨骼肌NLRP3基因表达,高强度急性运动则显著下调NLRP3 mRNA表达[69-70]。另外,耐力运动和阻力运动均能增加肌肉GLUT4浓度及骨骼肌细胞中GLUT4蛋白表达,促进其向细胞膜移位,增强骨骼肌葡萄糖摄取和转运能力,提高PI3K活性[71]。YU等[72]也证明慢性有氧运动通过调节PI3K/Akt途径增加骨骼肌胰岛素敏感性,同时上调GLUT4。因此,运动可增加骨骼肌中PI3K、GLUT4表达,抑制NLRP3、IL-1β等炎症因子表达,增强骨骼肌葡萄糖摄取和转运能力,改善IR。
5 小结与展望
综上,NLRP3炎症小体是代谢炎症的重要调节因子,调控NLRP3炎症小体是改善IR的有效途径。运动干预是一种简单易行且无副作用的非药物辅助手段,可通过改善β细胞功能、减少脂肪组织炎症、降低肝脏脂肪变性、提高骨骼肌葡萄糖摄取能力等途径降低炎症,改善机体IR,延缓T2DM发展。提示运动调控NLRP3炎症小体可能是延缓代谢性疾病发病的重要靶点。
此外,目前对NLRP3炎症小体、T2DM与运动的关系研究仍有诸多问题未得到有效解决:①不同运动形式对NLRP3炎症小体的影响及差异性仍不明确;②NLRP3炎症小体对代谢性疾病作用的具体分子机制仍需完善;③运动时NLRP3炎症小体及相关蛋白表达与IR的相互作用机制有待阐明;④运动调控NLRP3炎症小体与其他组织IR的分子机制等问题尚未阐明。探索与完善这些问题将为阐明NLRP3炎症小体与运动的关系及其在防治代谢性疾病的作用研究提供新的依据。