抗人B7-H4嵌合抗体的制备及鉴定①
2023-01-19范振军张文婷张俊爱赵祖国徐军发
范振军 张文婷 张 丽 张俊爱 赵祖国 徐军发
(广东医科大学医学技术学院检验医学研究所,东莞 523808)
B7-H4的mRNA在正常细胞中广泛存在,但在正常细胞表面上的表达被限制[3]。B7-H4通过抑制T细胞增殖、细胞因子分泌和细胞周期,负向调节T细胞免疫应答,促进免疫逃逸[4-7]。B7-H4在肿瘤、炎症和自身免疫性疾病中异常表达。B7-H4在肿瘤的发生和发展中起着极其重要的作用,包括细胞增殖、侵袭、转移、抗凋亡等[8-12]。B7-H4蛋白广泛表达肾细胞癌、尿路上皮癌、前列腺癌、乳腺癌、肺小细胞癌、胃癌、胰腺癌、宫颈癌、卵巢癌,且与肿瘤大小、癌症分期、转移、进展、疾病预后不良、存活率降低和/或T细胞浸润减少相关[13-21]。此外,B7-H4还具有很多其他免疫学功能,在保护ConA诱导的肝免疫损伤、维持母体对胎儿的免疫耐受、抗1型糖尿病(T1D)和胰岛β细胞移植等方面均扮演重要角色[22-24]。
本研究采用人恒定区与鼠单抗可变区嵌合,获得人鼠嵌合的人源化单抗,并研究单抗的结合活性,体外阻断B7-H4抑制T细胞增殖的作用,以及应用肽合成对抗体进行表位分析,确定了抗体的大致结合表位,探讨单抗发挥生物学功能的分子机制,为抗体药物研发奠定基础。
1 材料与方法
1.1 材料
1.1.1 主要试剂1640培养基、胎牛血清、F12培养 基(Gibco);LipofectamineTM3000、Trizol(Invitro‐gen);HRP-羊抗鼠、HRP-羊抗兔、HRP-羊抗人、Pro‐teinA/G(索莱宝);重组人B7-H4、重组人B7-H4 Fc融合蛋白(义翘神州);cDNA逆转录试剂盒、高保真Taq酶、T4连接酶、限制性内切酶(TaKaRa);CD3+T细胞磁珠分离试剂盒(Easysep);抗CD3、抗CD28(Biogem);人淋巴细胞分离液(天津灏洋);CCK-8试剂盒(日本株式会社);兔抗B7-H4多抗(Santa Cruz);CM5芯片(BIACORE)。
1.1.2 细胞株及质粒pMD19-T质粒、DH5α感受态细胞、DE3大肠杆菌(TaKaRa);pET30a(+)质粒(Novagen);pFUSE2-CLIg-hk质粒、pFUSE-CHIg-hG1质粒(InvivoGen);CHO-K1细胞系(ATCC)。
1.2 方法
1.2.1 抗体可变区基因扩增 复苏保存的抗人B7-H4杂交瘤细胞株21E7,收集1×107个细胞,加入1 ml Trizol裂解液提取RNA,并逆转录成cDNA。针对抗体重链、轻链信号肽和FR4框架区分别设计特异性引物(表1),PCR扩增可变区基因,并回收试剂盒收集目的片段。将重、轻链片段分别连接在pMD19-T载体上,转化DH5α感受态细胞,涂在X-gal琼脂平板上。次日挑选白斑菌落,进行PCR验证。菌落PCR验证正确的菌落送生工测序。将测序序列在Signal5.0进行信号肽分析,在IMGT网站进行抗体基因比对。
空调净化速度挑战超凡速算、洗衣机单角斜立画框挑战平衡大师……11月24日,“2018海尔挑战盛典暨感恩月启动仪式”在央视影视基地启动,作为央视第四季《挑战不可能》栏目的战略合作伙伴,海尔以全球领先的原创科技实力不断挑战,检验提高企业为用户创造“新可能”的能力,用更好的产品、科技、服务感恩回馈全球10亿用户。

表1 可变区扩增引物Tab.1 Variable region amplification primer
1.2.2 构建嵌合表达载体 根据目的基因的序列,结合载体上下游酶切位点,设计扩增目的基因的正向、反向引物(表2),并引入相应的酶切位点序列。引物由上海生工合成。重链质粒与目的基因和轻链质粒与目的基因分别进行双酶切并回收酶切片段,T4连接酶16℃连接过夜。转化DH5α,挑选单个菌落进行菌落PCR,将菌落PCR验证正确的单菌落,扩大培养,提取质粒,进行酶切验证。
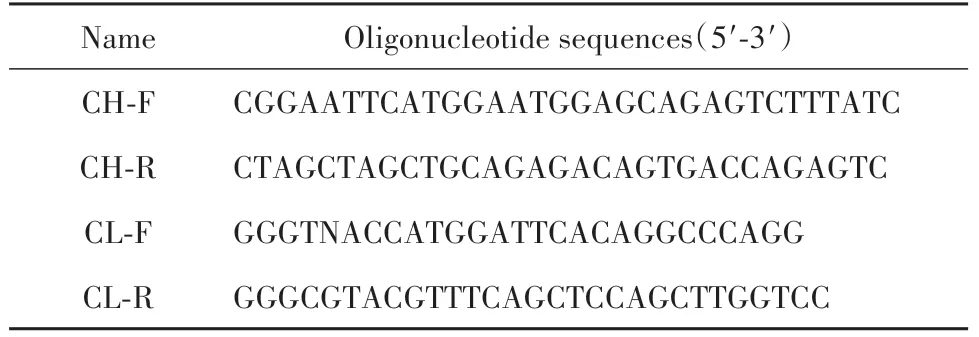
表2 二次PCR扩增引物Tab.2 Secondary PCR amplification primer
1.2.3 转染CHO-K1细胞株,筛选稳转株并评估不同传代次数分泌抗体能力 转染前1 d将CHO细胞接种于6孔板,在含10%FBS、1%双抗的F12培养基,37℃、5%CO2下培养。待细胞80%融合,加入2µg重链质粒和3 µg轻链质粒,加入LipofectamineTM3000 Transfection Reagent共转染CHO-K1细胞系,48 h后 更 换 培 养 基,加 入5 µg/ml Blasticidin和200 µg/ml Zeocin维持21 d筛选稳转株。通过抗生素筛选出稳转株进行传代培养,48 h收集上清,更换培养基。收集原代、第三代、第五代、第七代、第十代上清,将其稀释50倍、100倍、200倍、400倍、800倍、1 600倍,检测不同代数OD值变化。
1.2.4 人源化嵌合单抗纯度鉴定 大量收集培养上清,12 000 r/min、4℃离心10 min,弃沉淀,采用0.45µm滤膜过滤除去细胞杂质。上清通过Protein A/G亲和层析柱收集洗脱液。取收集产物小样用于SDS-PAGE检测纯化抗体纯度,其余在PBS缓冲液中4℃透析过夜,冻干浓缩,复溶,BCA检测浓度。
1.2.5 间接ELISA检测人源化嵌合单抗与B7-H4的结合活性 使用包被液将人B7-H4抗原稀释至0.5 µg/ml,每孔100 µl加至酶标板,4℃包被过夜。除去包被液,PBST洗涤3次,每次3 min,加入200µl 5%BSA,37℃封闭2 h。除去封闭液,洗涤同上。用PBST稀释人源化单抗CH7和鼠源单抗21E7,浓度依次为1 000、500、250、125、62.5、31.25、20.833、
13.889 、9.259、6.173、4.115、2.743、1.829、1.219、0.813、0.542 ng/ml,分别取100 µl加入酶标板中,37℃孵育1 h。除去一抗,洗涤同上。人源化单抗组加入100 µl羊抗人IgG二抗稀释液,鼠源单抗组加入100µl羊抗鼠IgG二抗,37℃孵育1 h。除去二抗,洗涤同上,每孔加入100µl TMB显色底物,避光10 min,加入50 µl终止液,立即在酶标仪中测定450 nm处吸光值(OD)。
1.2.6 离子表面共振(SPR)检测单抗与B7-H4的亲和力 将人B7-H4重组蛋白,偶联在anti-His anti‐body的CM5芯片上,在PBS-P+缓冲液中的传感器表面捕获抗体。使用连续稀释浓度(250、125、62.5、31.25、15.625、7.812 5 nmol/ml)测试抗体。结合阶段的流动持续时间为120 s,结合60 s,解离持续时间为300 s,Gly1.5再生30 s。使用BIAcore评估软件计算结合率(Ka)、解离率(Kd)和亲和力常数(KD)。
1.2.7 人源化单抗体外阻断B7-H4抑制T细胞增殖 从健康志愿者外周血分离出PBMCs,用CD3阳性分磁珠分选出T细胞,接种1×105个细胞到预先包被激发型抗CD3(5 µg/ml)和抗CD28(2 µg/ml)的96孔板中,分别加入人B7H4-FC融合蛋白(5µg/ml)、人源化单抗(10µg/ml)或两者混合物。每组设3个复孔,培养72 h后加入CCK-8检测细胞增殖情况。
1.2.8 抗原表达及肽段合成 将B7-H4胞外功能域的IgV(29~154)和IgC(155~258)两个肽段分别构建pET30a-IgV和pET30a-IgC原核表达载体。质粒转化DE3大肠杆菌,37℃摇菌,当OD值达到0.6时,不加或加入1 mmol/ml的IPGT诱导,继续培养6 h。4℃、10 000 r/min,离心15 min,收集菌体。超声破碎细菌,10 000 r/min,20 min,4℃离心,分别收集上清与沉淀。配置12.5%的分离胶,取15 µl上样,分别与抗His抗体和人源化单抗CH7 4℃孵育过夜,TBST洗涤3次,每次10 min,5%脱脂奶粉封闭1 h,TBST洗涤3次,每次10 min,加入相应二抗孵育1 h,TBST洗涤3次,每次10 min,加入TMB显影剂,于曝光仪曝光。将IgC域分成4个肽段,S1(159~178 aa:YNASSETLRCEAPRWFPQPT)、S2(182~207 aa:ASQVDQGANFSEVSNTSFELNSENVT)、S3(211~227 aa:VSVLYNVTINNTYSCMI)、S4(233~253 aa:KATGDIKVTESEIKRRSHLQL),交由上海吉尔生化合成肽段,用肽段包被酶标板,分别加入人源化嵌合单抗和兔多抗检测。
1.2.9 三维建模及分子对接 从UniProt数据库中下载AlphaFold预测B7-H4的三维结构。使用Ro‐setta软件对抗体可变区开始进行建模,使用Pro‐check对三维模型进行评估。使用Discovery Studio软件中的ZDOCK程序对抗原抗体进行对接,以相互作用主要在抗原233~253aa且打分最靠前的POSE作为最终结果。
1.3 统计学处理 采用Graph Pad Prism 8.0软件进行t检验,P<0.05为差异有统计学意义。
2 结果
2.1 杂交瘤可变区基因扩增及序列分析 从杂交瘤21E7中扩增出了重链和轻链可变区基因,片段大小400 bp左右(图1A)。目的基因与T载体连接,分别构建了T-VH重链可变区T载体和T-VL轻链可变区T载体。单菌落PCR扩增出了一致大小的片段(图1B、C)。如图2A、B所示,重链基因前面57个碱基为信号肽,编码19个氨基酸;轻链基因前面50个碱基为信号肽,编码20个氨基酸。重链可变区全长354个碱基,功能性重链V基因属于鼠IGHV1-54*03(F)家族,匹配率为97.22%,J基因属于鼠IGHJ3*01F家族,D基因属于鼠IGHD2-4*01F家族。轻链可变区全长336个碱基。功能性轻链V基因属于鼠IGKV8-21*01(F)家族,匹配率为97.31%,J基因属于鼠IGKJ5*01F家族(图2C)。
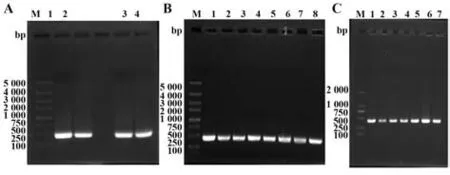
图1 杂交瘤可变区基因扩增Fig.1 Amplification of variable region gene from hybridoma
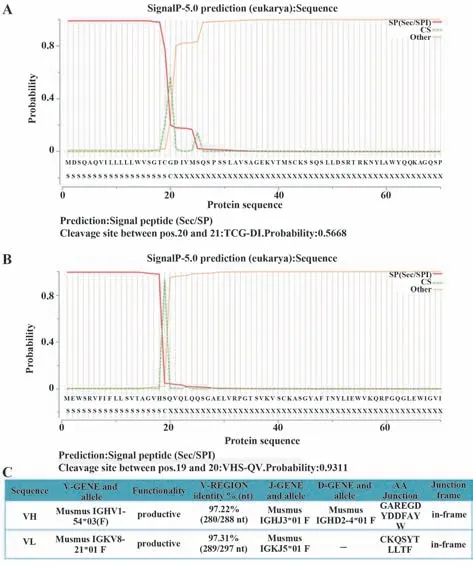
图2 抗体可变区序列分析Fig.2 Sequence analysis of variable region of antibody
2.2 嵌合表达载体的构建pFUSE-CHIg-hG1质粒带有人IgG1恒定区,而pFUSE-CLIg-hk质粒带有人κ链恒定区,与相应的抗体可变区基因连接,构建了表达人鼠嵌合重链的载体pFUSE-mVH-hCH,表达人鼠嵌合轻链的载体pFUSE-mvl-hCL。菌落PC(图3A)、酶切实验(图3B),均证实片段大小与扩增片段大小一致,证明人鼠嵌合表达载体构建成功。
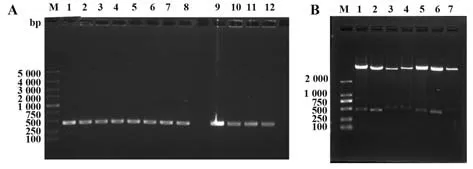
图3 嵌合表达载体的构建Fig.3 Construction of chimeric expression vectors
2.3 稳转株不同传代次数分泌抗体的能力评价利用载体上的抗性基因Blasticidin和Zeocin筛选出稳定表达抗人B7-H4人鼠嵌合抗体的细胞株并命名为CH7。传代培养10次后,培养上清效价无显著性差异(图4),说明稳转株能稳定分泌抗体,随着传代次数增加其分泌抗体的能力未发生改变。
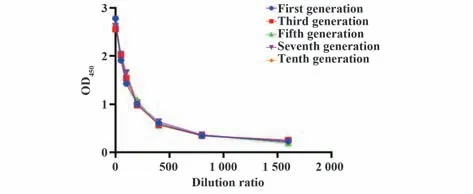
图4 稳转株不同传代次数分泌抗体的能力Fig.4 Ability of stable strain to secrete antibody at different times of passage
2.4 人源化单抗纯度鉴定及BCA测定浓度 使用SDS-PAGE对抗体的纯度鉴定结果可以看出人源化抗体在SDS-PAGE胶上分成两条清楚的条带,分子量分别在50 kD和25 kD附近,并没有明显的杂带(图5),说明成功得到了纯化抗体,且抗体纯度和完整性良好。冻干复溶后,BCA法测得人源化单抗浓度为1.82 mg/ml。

图5 SDS-PAGE鉴定纯化后抗体纯度Fig.5 Purity of purified antibody was determined by SDS-PAGE
2.5 嵌合单抗与人B7-H4的结合活性 间接ELISA测定嵌合单抗CH7与B7-H4的结合活性(图6)。表明使用ELISA测定人源化单抗CH7与鼠源单抗21E7的效价,嵌合单抗在稀释到9.259 ng/ml时,OD>1,效价为1.97×105左右,与鼠源亲本效价相差不大。SRP结果显示,嵌合单抗亲和力为3.72×10−9kD,鼠抗为1.52×10−9kD,嵌合单抗具有很好的结合活性(图7)。ELISA和SPR的结果均表明嵌合单抗可以与人B7-H4进行很好地结合,且保留了鼠源亲本单抗的大部分活性。
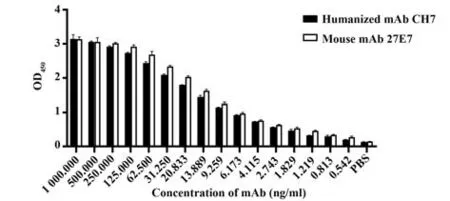
图6 ELISA检测单抗效价Fig.6 Detection of titer of monoclonal antibody by ELISA
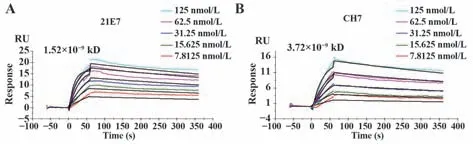
图7 SPR测定单抗的亲和力Fig.7 SPR assays affinity of monoclonal antibodies
2.6 嵌合单抗体外阻断B7-H4抑制T细胞增殖如图8所示,人外周血T细胞在激发型单抗CD3和CD28体外激发培养体系中加入B7-H4 Fc融合蛋白后,明显抑制了T细胞体外增殖作用(P<0.01);加入嵌合单抗后显著逆转了B7-H4介导的T细胞增殖抑制效应(P<0.05),说明嵌合单抗在体外具有一定阻断B7-H4对T细胞增殖抑制的作用。
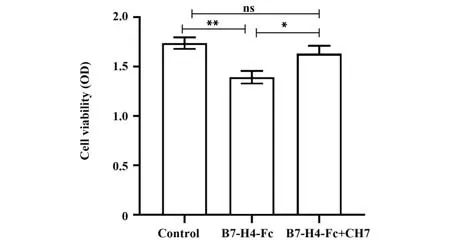
图8 T细胞增殖抑制实验Fig.8 T cell proliferation inhibition assay
2.7 嵌合单抗体表位验证 实验证明嵌合单抗可以用于Western blot(图9A),因此,为了进一步弄清楚单抗在阻断B7-H4抑制T细胞增殖的作用分子机制,分别表达了包含人B7-H4的胞外V结构域(29154 aa)和包含胞外C结构域(155~258 aa)的蛋白(图9B)。pET30a载体上带有His标签,用抗His抗体孵育表达产物,证实成功表达了这两段抗原,且是在包涵体中表达(图9C)。用嵌合单抗孵育抗原发现,只有胞外C结构域出现条带,说明单抗结合位点在胞外C结构域中(图9D)。将胞外C结构域分成四段肽,合成肽并用于包被酶标板,ELISA检测发现S1、S2、S4均能与商品化兔多抗结合,而S3不能结合。嵌合单抗只与S4结合,证明单抗结合表位在S4中(图9E)。
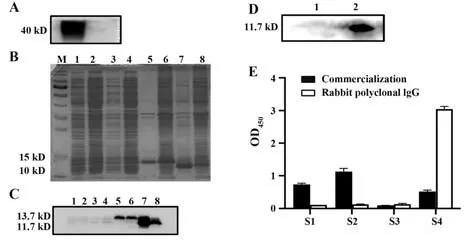
图9 抗体表位分析Fig.9 Antibody epitope analysis
2.8 生物信息学建模 抗体建模通过Rosetta从头开始建模,Ramachandran plot表明在允许区域内占99%,因此模型较理想。抗体可变区模型表明可变区得CDR区具有β折叠片层和环结构,所有CDR区域的环结构由大量的疏水性氨基酸组成,重链和轻链之间的CDR区域形成疏水性空腔。从UniProt数据库下载AlphaFold预测B7-H4的结构,使用Dis‐covery Studio软件中的ZDOCK程序对抗原抗体进行对接。对接显示,轻链CDR2环上Ser-58L2与Arg-247,Arg-60L2与Arg-247,Arg-60L2与Ser-249形成了氢键;重链CD3环上的Asp-101H3与Met-235,Tyr-102H3与PRO-236形成了氢键。同时存在大量疏水性氨基酸(Leu-33H1、Ile-34H1、Val-50H2、
Ile-51H2、Pro-53H2、Phe-105H3、Ala-106H3、Leu-29L1、Ala-40L1、Trp-56L2、Val-57L2、Leu-100L3)形成疏水性凹槽,推动B7-H4分子与之紧密结合。对接结果表明,抗原与抗体的相互作用依赖于氢键和疏水作用,见附图1(www.immune99.com)。
3 讨论
免疫检查点阻断是激活抗肿瘤免疫的有效策略之一,近年来PD-1/PD-L1免疫疗法在多种恶性肿瘤的治疗中取得了显著成效,并获得2018年诺贝尔医学与生理学奖[25]。但仍存在部分患者治疗无效以及不良事件,其治疗效果及治疗安全性仍需进一步探讨[26-27]。B7-H4是一种免疫检查点配体,表达于肿瘤和APCs表面,抑制T细胞活化和增殖,在抗肿瘤免疫反应的负调控中发挥重要的作用[3]。B7-H4信号被认为是肿瘤细胞逃避T细胞介导杀伤的重要机制。因此,靶向肿瘤相关的B7-H4可能为增强抗肿瘤反应提供一种新的治疗策略。FPA150是首个具有增强ADCC效应的B7-H4阻断抗体,目前正在进行的临床试验已证明其良好安全性[28]。
本实验室多年来关注B7-H4靶点研究,制备了高亲和力的鼠单抗。为降低抗鼠抗体(HAMA)反应,本研究采用人IgG1恒定区取代了鼠恒定区。IgG1靶向于肿瘤细胞,具有更强的CDC和ADCC效应,稳定性更好。利用轻链和重链的真核表达质粒共转染了CHO-K1细胞系,经过抗生素筛选,获得了能稳定表达抗B7-H4人源化单克隆抗体的CHO细胞株。间接ELISA和SPR证实了嵌合抗体具有很高的结合活性,保留了鼠源亲本绝大部分活性。B7-H4-Ig抑制了T细胞的增殖,而当加入人源化嵌合抗体CH7时,这种抑制作用被抵消了。人源化嵌合抗体CH7通过阻断B7-H4促进了T细胞的活化与增殖,显示出用于肿瘤治疗的潜力。本课题分段表达了抗原,确定抗体与IgC域结合,之后把IgC域分成了四段多肽,ELISA结果确定抗体与233~253 aa发生作用,因而可以更精准地模拟抗原抗体如何发生作用。分子模拟证明了抗体主要通过氢键和疏水作用力与B7-H4结合,氢键主要形成于Arg-247、Ser-249上,与实验结果相互印证。抗体建模和分子对接,解释了抗体的生物活性机理,为下一步治疗提供基础。
总之,本研究初步证实了人源化单抗CH7在体外可以阻断B7-H4抑制T细胞增殖抑制作用。后续工作中,将进一步人源化,对体内阻断作用进行探索,观察体内外对肿瘤细胞株生长的抑制作用。