高钾血症和肾素-血管紧张素-醛固酮系统抑制剂治疗与急性心力衰竭合并肾功能不全患者预后的相关性分析
2023-01-12骈溶亮刘朝阳仝国栋谭磊
骈溶亮,刘朝阳,仝国栋,谭磊
安阳市第五人民医院,安阳 455000
心力衰竭(heart failure,HF)是由各种心脏结构或功能性疾病导致心室重构和(或)射血功能受损,心排血量不能满足机体组织代谢需要,以肺循环和(或)体循环淤血、器官和组织血液灌注不足为临床表现的一组综合征。神经体液调节机制[如肾素-血管紧张素-醛固酮系统(renin-angiotensinaldosterone system,RAAS)激活]及利钠肽、精氨酸升压素等体液因子分泌增加是HF的重要病理生理机制。在欧洲心脏病学会(European Society of Cardiology,ESC)发布的《2021年ESC急慢性心力衰竭诊断与治疗指南》(2021 ESC guidelines for the diagnosis and treatment of acute and chronic heart failure)[1]中,RAAS抑制剂包括血管紧张素转化酶抑制剂(angiotensin converting enzyme inhibitors,ACEI)或血管紧张素Ⅱ受体 阻 断 剂(angiotensin Ⅱ receptor blockers,ARB)、醛固酮受体拮抗剂(mineralocorticoid receptor antagonists,MRA), 在 HF的 治 疗中仍占据重要地位。高钾血症是ACEI、ARB和MRA等药物的常见不良反应之一,HF恶化导致的再入院常与导致低钾血症的利尿剂强化治疗和RAAS抑制剂的剂量调整密切相关。有研究表明,高钾血症与HF患者预后较差相关,血钾水平与死亡率之间呈 U 形关联[2-4]。在慢性HF患者中,高钾血症与MRA或ACEI/ARB剂量过高有关[5-7]。然而,目前鲜有关于高钾血症和RAAS抑制剂治疗与急性HF合并肾功能不全患者全因死亡率及获益情况的证据,故本研究对此进行探讨,以期为临床合理用药提供参考。
1 资料与方法
1.1 一般资料
回顾性选取2017年1月~2021年8月本院收治的600例急性HF合并肾功能不全患者为研究对象,其中男性399例,女性201例。
纳入标准:①符合《2021年ESC急慢性心力衰竭诊断与治疗指南》[1]中急性HF的判定标准,且其药物治疗方案中包含RAAS抑制剂的患者。②符合轻中度肾功能不全的诊断标准[8](肌酐清除率为20~80ml/min)者。③B型利钠肽(B type natriuretic peptide,BNP)或N端B型利钠肽(N-terminal B-type natriuretic peptide,NT-BNP)升高者[1]。④年龄>18岁者。排除标准:患有未控制的高血压、未控制的糖尿病、急性冠脉综合征、严重肝肾功能不全、严重感染、肿瘤等终末期疾病者、临床资料不完整者等。
1.2 研究方法
通过查阅患者病历,收集并记录人口统计学特征、相关检查和实验室数据。人口统计学特征包括性别、年龄、体重指数(body mass index,BMI)、吸烟、饮酒、入院时心率和潜在疾病;实验室数据包括血钾、血钠、血氯、白细胞计数、红细胞计数、血红蛋白、血小板计数、血脂、肝肾功能等。从入院(<24h)到出院或直到第5天,每天测量患者血钾水平,根据血钾水平[9]将患者分为高钾血症组(住院期间至少1次监测血钾水平>5.5mmol/L,n=205)、正常血钾组(在院期间所测量的血钾水平为3.5~5.5mmol/L,n=281)和低钾血症组(在院期间至少1次监测血钾水平<3.5mmol/L,n=100)。另有14例患者在住院期间因治疗方案改变先后出现低钾血症和高钾血症,因此未纳入分析。患者出院后进行电话或门诊随访180天,本研究的主要终点是全因死亡,次要终点是因HF再入院。
1.3 统计学方法
采用IBM SPSS 25.0统计软件对数据进行分析。符合正态分布的计量资料以±s表示,组间分析采用独立样本t检验或秩和检验;计数资料以n(%)表示,组间分析采用χ2检验或Fisher精确概率法。在调整对终点事件有影响的混杂因素后,采用多因素Logistic回归分析评估临床指标与高钾血症的相关性,并分析RAAS抑制剂剂量变化对急性HF合并肾功能不全患者全因死亡和因HF再入院的影响。P<0.05为具有统计学差异。
2 结果
2.1 基线资料
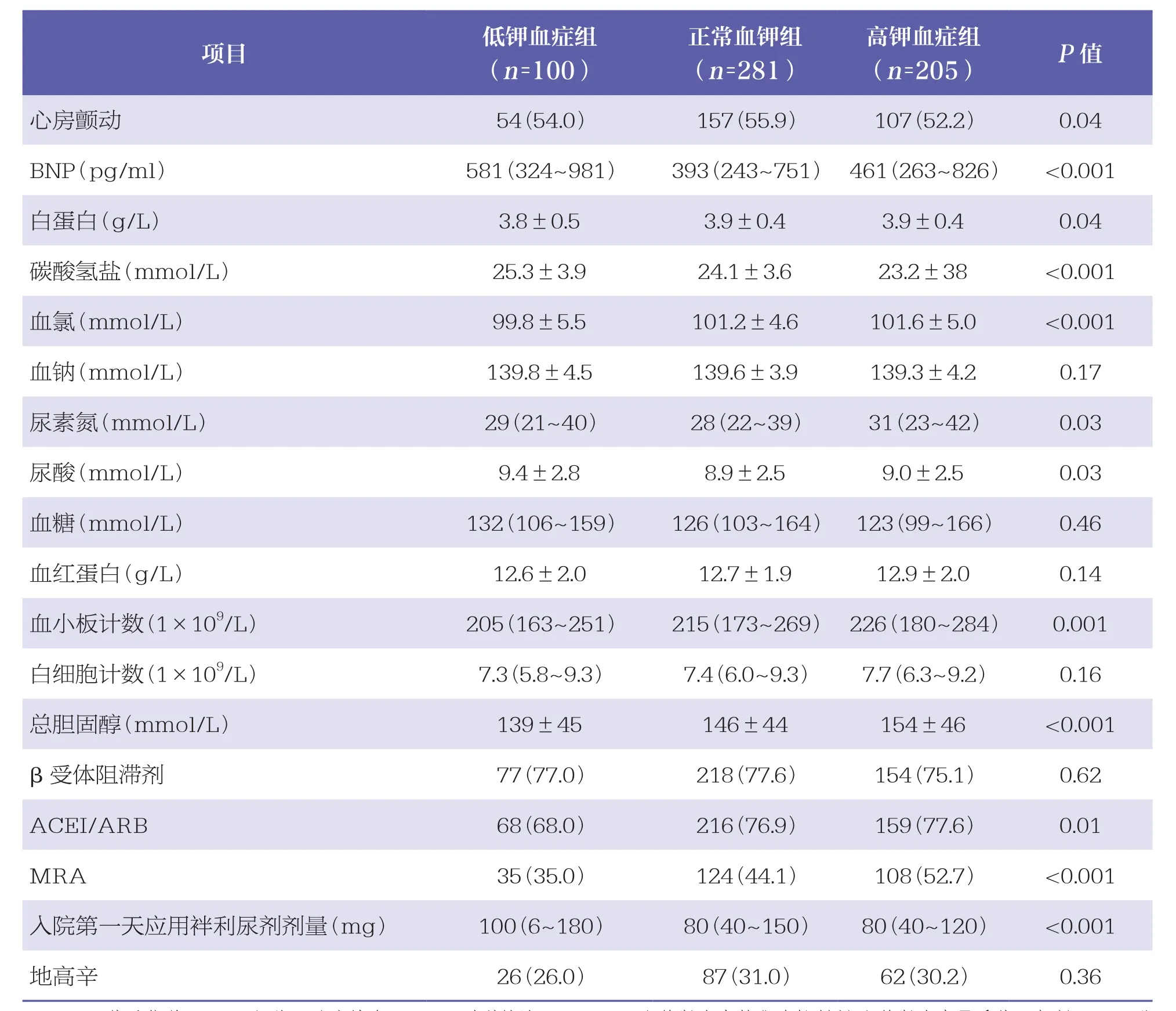
本研究中,100例患者发生低钾血症,205例患者发生高钾血症。在本研究中,高钾血症组患者的平均年龄略低于低钾血症组和正常血钾组,且HF症状较轻,心率更快,血氯、尿素氮、总胆固醇、血小板计数等指标水平均较高,心房颤动发生率更低,住院前更常服用RAAS抑制剂,住院期间接受袢利尿剂的剂量较低(P<0.05),但3组患者肾功能水平比较无统计学差异(P>0.05),见表1。多因素Logistic回归分析结果显示,急性HF患者住院期间发生高钾血症的风险与是否使用MRA、袢利尿剂用药剂量有关,而与使用ACEI/ARB无关,见表2。
表1 患者基线资料 ±s,n(%)

表1 患者基线资料 ±s,n(%)
项目 低钾血症组(n=100)正常血钾组(n=281)高钾血症组(n=205) P值年龄(岁) 70.5±12.5 70.7±11.1 68.8±11.2 0.01男性(例) 62(62.0) 195(69.4) 134(65.4) 0.07女性(例) 38(38.0) 86(30.6) 71(34.6) 0.06 BMI(kg/m2) 28.6±6.4 29.1±6.3 28.3±5.6 0.07估计肾小球滤过率(ml/min·1.73m2) 48.4±18.8 49.1±18.6 47.9±20.4 0.53 NYHA心功能分级 0.17Ⅱ级 19(19.0) 47(16.7) 31(15.1)Ⅲ级 49(49.0) 145(51.6) 98(47.8)Ⅳ级 34(34.0) 87(31.0) 76(37.1)收缩压(mmHg) 125.2±19.6 124.7±17.3 124.7±16.8 0.93心率(次/分) 80.1±16.2 79.7±15.2 81.9±15.6 0.03端坐呼吸 84(84.0) 246(87.5) 172(83.9) 0.1心绞痛 23(23.0) 59(20.1) 59(28.8) 0.001水肿或颈静脉压升高 37(37.0) 84(29.9) 56(27.3) 0.02既往因HF入院 52(52.0) 141(50.2) 103(50.2) 0.85心肌梗死 45(45.0) 142(50.5) 105(51.2) 0.28高血压 75(75.0) 229(81.5) 163(79.5) 0.14高血脂 50(50.0) 147(52.3) 89(43.4) 0.01吸烟 19(19.0) 63(22.4) 36(17.6) 0.08慢性阻塞性肺疾病 19(19.0) 55(19.6) 40(19.5) 0.99糖尿病 44(44.0) 126(44.8) 96(46.8) 0.64
续表
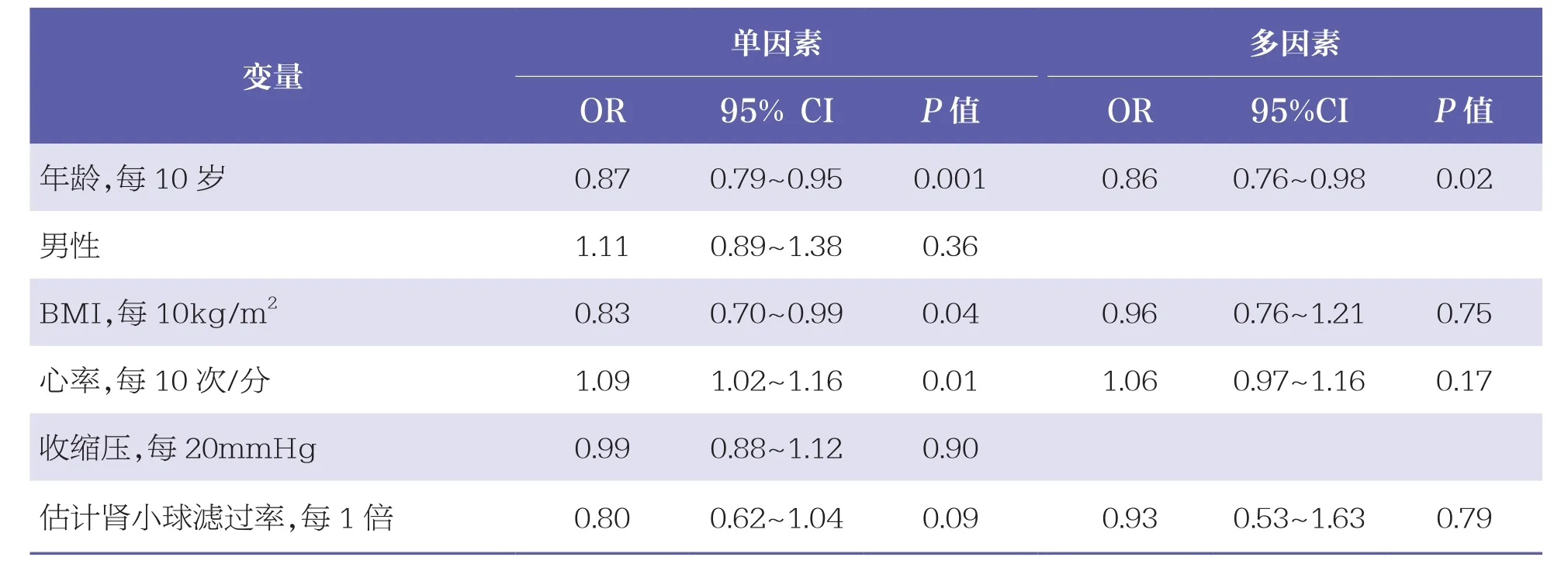
表2 影响高钾血症的临床指标

续表
2.2 高钾血症、RAAS抑制剂治疗与随访终点的关系
在180天随访中,共有100例患者发生全因死亡,158例患者因HF再入院,但未观察到低钾血症或高钾血症与主要终点或次要终点之间存在关联(P>0.05)。与RAAS 抑制剂恒量或加量的患者相比,住院期间减量或停用 ACEI/ARB的患者发生全因死亡(OR=1.97,95% CI:1.40~2.75,P<0.001)和因HF再入院(OR=1.73,95% CI:1.15~2.61,P=0.008)的风险更高,见表3。
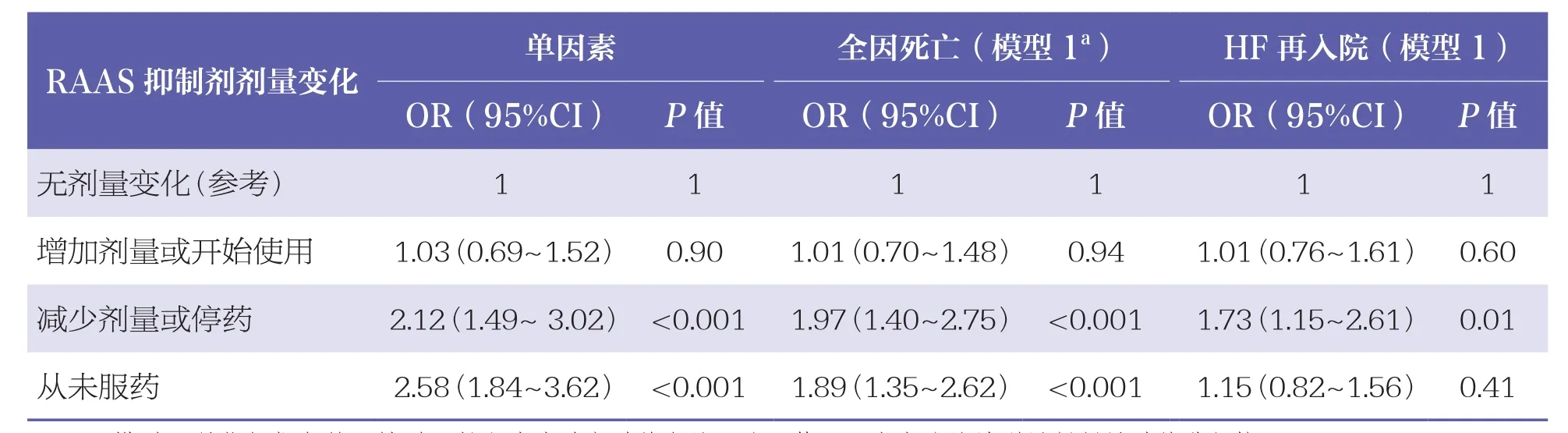
表3 RAAS抑制剂对急性HF合并肾功能不全患者全因死亡和HF再入院的多因素Logistic回归分析
3 讨论
本研究结果表明,因急性HF住院的肾功能不全患者出现高钾血症的比例较高。出现高钾血症后,患者更有可能减少RAAS 抑制剂剂量或直接停药。尽管根据目前研究结果,高钾血症与HF患者长期预后没有直接关系,但高钾血症事件出现后可导致RAAS抑制剂使用剂量减少。如果RAAS 抑制剂剂量保持不变或增加,发生高钾血症患者的预后更佳。本研究中超过50%的患者在入院期间出现低钾血症或高钾血症,35%的患者至少发生过1次高钾血症,17%的患者在住院期间至少出现过1次低钾血症。
许多HF相关临床试验,尤其是涉及RAAS抑制剂的临床试验,为了降低发生严重高钾血症的风险,基本都未纳入基线血钾水平>5.0mmol/L的患者进行分析[10-11]。根据PROTECT试验数据的相关分析,6%的急性HF患者在基线时有高钾血症[12];根据EVEREST试验数据的相关分析,14.6%的因HF恶化住院患者在出院时出现高钾血症[13];另有前瞻性研究表明,对急性HF患者进行长期血钾水平监测,结果5.6%的患者在出院后出现高钾血症[14]。
本研究中,住院期间发生高钾血症患者大多在住院前接受了MRA治疗,这提示接受MRA治疗的患者在随访期间出现高钾血症的风险更高,这与RALES、EMPHASIS-HF试验数据的研究结果一致[15]。有研究表明,糖尿病和肾功能不全的老年患者在接受RAAS抑制剂治疗后更易发生高钾血症[16]。但本研究中并未在高钾血症患者中发现类似结果,这表明RAAS 抑制剂剂量的变化可能在急性HF患者住院期间具有重要作用。然而,在高钾血症组中,与用药剂量恒定的患者相比,RAAS 抑制剂剂量降低的患者更容易合并糖尿病史且肾功能更差。
经过180天的随访,患者全因死亡率为17%,但住院期间发生的高钾血症与死亡率或继发性死亡无关,与已有研究结果相似[17]。对BIOSTATCHF试验数据(包括慢性HF患者)的分析表明,高钾血症与RAAS 抑制剂疗效不佳或剂量不足有关[5,7]。此外,SCREAM研究的数据分析表明,开始使用MRA后发生高钾血症的病例并不少见,而高钾血症常导致MRA治疗的中断,且这种现象在慢性肾功能不全的患者中更常见[6]。本研究结果表明,在高钾血症组中,增加或不改变RAAS 抑制剂剂量的患者预后更佳,这提示高钾血症可能不会削弱RAAS 抑制剂疗效,这与已有研究结果一致[18]。
本研究尚存在一定的局限。首先,本研究样本量较少,未来需大样本量、前瞻性研究进一步证实研究结果;其次,住院期间可能有未监测到的高钾血症或低钾血症,导致结果存在一定偏差。
综上,急性HF合并肾功能不全患者住院期间发生高钾血症比例较高,但高钾血症与全因死亡无关,且尽管发生了高钾血症这一严重的不良反应,患者在不改变或增加RAAS抑制剂剂量的治疗方案中仍可获益。
