重症肌无力与安全用药
2023-01-12编译谭颖朱珠管宇宙
编译:谭颖,朱珠,管宇宙
中国医学科学院北京协和医学院-北京协和医院,1神经科,2药剂科,北京 100730
重症肌无力(myasthenia gravis,MG)是一种自身免疫性疾病,其自身抗体与神经肌肉接头(neuromuscular junction,NMJ)中的受体或相关分子结合,导致骨骼肌无力[1]。MG自身抗体最常见的靶点是乙酰胆碱受体(acetylcholinerecepter,AChR)[1-2]。2020 年11月,美国重症肌无力基金会(Myasthenia Gravis Foundation of America,MGFA)在线发布了《重症肌无力管理国际共识指南:2020更新版》[3],反映了当前的精准治疗策略以及新的免疫治疗药物可能带来的不良影响。
2020年的流行病学调查结果显示[4],我国MG发病率约为0.68/10万,女性发病率略高,70~74岁年龄组为高发人群。据2015年美国重症肌无力基金会估计[5],美国每10万人中就有20人患有MG,相当于病例总数为3.6万例~6万例;MG发病年龄呈双峰分布,峰值分别在30岁和70~80岁;在30岁左右发病的患者中女性病例是男性的3倍;而晚发高峰中,男性病例居多。我国是世界上老年人口最多的国家,老年人常同时患有多种慢性疾病,需要给予不同类别的药物进行治疗,包括一些与其他药物相互作用风险未知的中成药,平均用药9种,多者达36种;有50%的老年患者同时使用3种药物,有25%服用4~6种药物,其中某些药物可以导致MG发病或病情加重[6]。许多可导致MG发病或急性恶化的药物,位列最常用处方药的前200种,包括阿奇霉素、环丙沙星、β受体阻滞剂、他汀类药物等[7],需要引起临床关注。
为了解药物对MG诊疗的影响,本文扼要回顾了MG的病理生理学、治疗方法以及可能导致MG发病或恶化的药物。
1 MG的病理生理学
NMJ是MG在病理生理上的主要发病部位。在健康个体中,神经元冲动刺激乙酰胆碱(acetylcholine,ACh)从突触前神经元释放到突触间隙,与AChR结合,致使钠通道打开,钠离子内流,从而让骨骼肌收缩[7]。在MG患者中,神经元冲动不受影响,而NMJ中自身抗体的形成会导致骨骼肌功能障碍。AChR抗体是最常见的致病性抗体,可防止ACh结合并减少骨骼肌的激活[7]。其他常见的抗体靶点包括脂蛋白受体相关蛋白[低密度脂蛋白受体相关蛋白4(low-density lipoprotein receptor-related protein 4,LRP4)]和骨骼肌特异性受体酪氨酸激酶(muscle-specific receptor tyrosine kinase,MuSK)[7]。
在AChR抗体阳性的全身型MG患者中,有10%~20%存在胸腺功能障碍[8-10]。胸腺的主要作用是去除自身反应性T细胞,从而建立中枢耐受[8]。在MG和胸腺功能障碍的患者中,调节性T(regulatory T cells,Treg)细胞数量减少,无法有效去除自身反应性T细胞[8]。在这些患者中,主要的治疗方法是胸腺切除术[11]。
一旦T细胞进入循环,将有更多的途径被上调或被抑制。上调的途径包括由细胞因子介导的慢性炎症途径,如白介素-6(interleukin-6,IL-6)、白介素-21(IL-21)和白介素-17(IL-17)[12]。T细胞释放的IL-21可以介导B细胞的活化,该通路的上调导致B细胞成熟为产生自身抗体的浆细胞[12]。在健康个体中,这些过程将被Treg细胞抑制。然而,在MG患者中,Treg细胞下调,导致炎症和B细胞活化不受抑制[12]。
2 MG的临床表现
每例MG患者的早期症状都是不同的。症状可以分为两类:全身症状和眼部症状[8]。全身症状包括构音障碍、吞咽困难、面部和下颌无力[8];眼部症状包括复视和上睑下垂。近60%的患者的眼部症状包括复视和上睑下垂,并在2年内进展为全身症状[8,13-14]。MG的核心表现是骨骼肌无力,运动时加重,休息后改善[8]。
3 MG的治疗方案
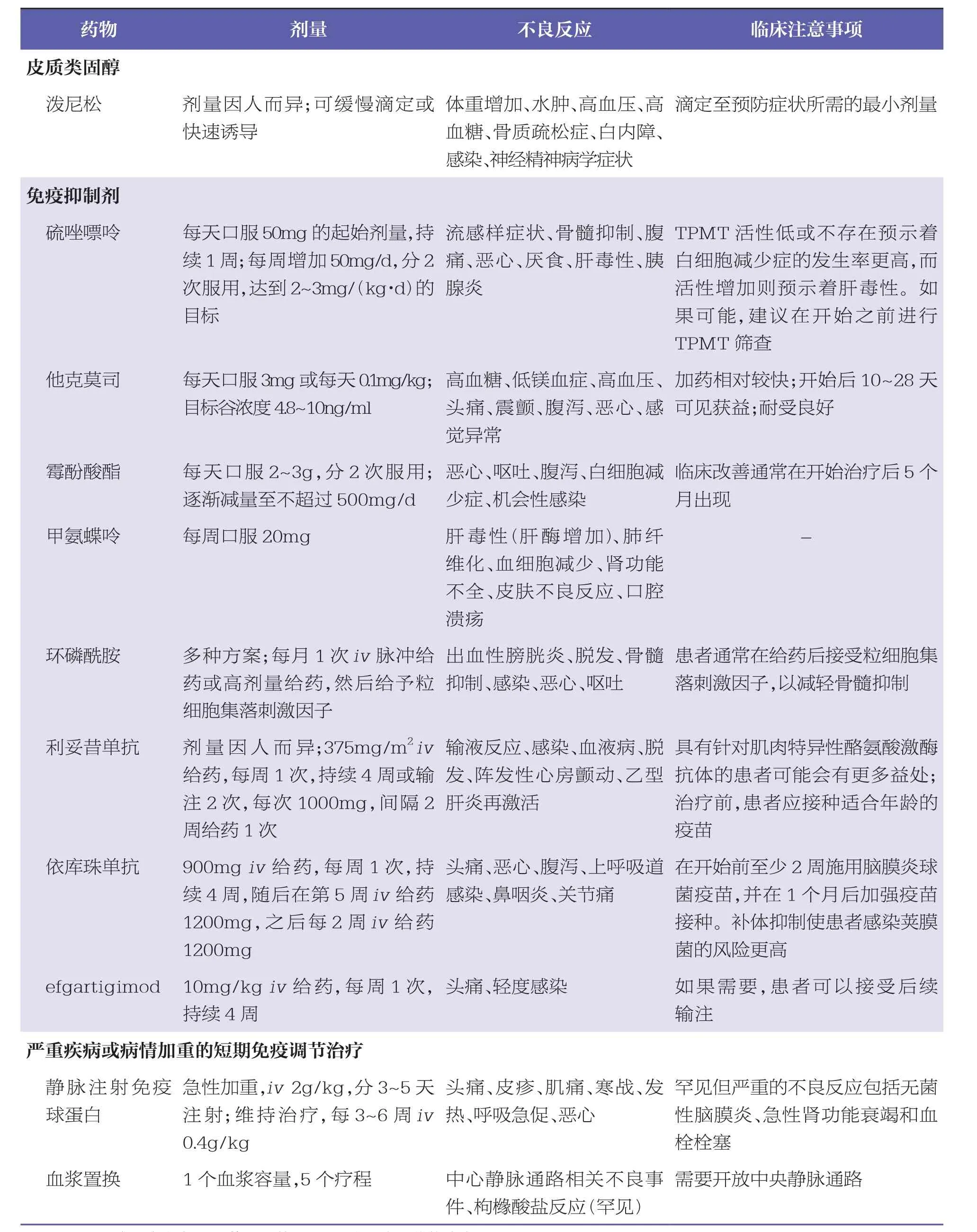
对MG患者有4种主要的治疗方案,包括乙酰胆碱酯酶(acetylcholinesterase, AChE)抑制剂、皮质类固醇、免疫抑制剂和短期免疫调节治疗[15]。而并非所有患者在其病程中都会接受每类药物治疗,这些疗法可以组合。各类药物的概述、有关剂量、不良反应和临床症状见表1。

表1 用于治疗MG的药物类别[11]
续表
3.1 AChE抑制剂
在AChE抑制剂中首选吡啶斯的明,因为其不透过血脑屏障,从而限制了中枢神经系统的不良反应[16]。吡啶斯的明是一种合成的AChE抑制剂,可抑制突触间隙中ACh的分解[16]。这种治疗方式没有从病理、生理机制上解决产生自身抗体的问题,患者仍然存在自身抗体的循环。这种治疗方式为抗AChR抗体阳性患者缓解症状提供了帮助,但对其他亚型MG患者未见相关益处[16]。尽管AChE抑制剂是最常用的一线药物之一,但此类药物有效性的证据均来自回顾性研究和临床经验,仍缺乏来自临床对照试验的数据[17]。
3.2 皮质类固醇
皮质类固醇也是MG患者的一线治疗药物[16]。但是,由于大多数研究都是回顾性研究,对于这些药物的应用证据或指导剂量证据有限[16]。皮质类固醇的2种常见给药方法,包括快速诱导和缓慢滴定,但哪种方法更好仍未可知[16]。如缓慢滴定是从口服泼尼松每日不超过25mg开始,并以5mg的间隔增加剂量[11]。如果患者在开始使用皮质类固醇时病情快速加重,应考虑使用更高剂量[11]。由于长期使用皮质类固醇会造成不良反应,一旦症状控制,应逐渐减低到最小有效剂量[11]。患者有时会在开始使用皮质类固醇或增加剂量后出现临床疾病的恶化[8]。
3.3 免疫抑制剂
多种免疫抑制剂已被用作MG治疗的一部分,作为类固醇保留方案,以损害淋巴细胞功能和减少自身抗体的产生[16]。因为未见相关头对头的直接比较,所以无法确定哪种药物更优[16]。环孢素是第1个用于MG患者的免疫抑制剂,但由于其具有肾毒性的风险,因此不经常被使用[16]。在一系列病例研究中,在患者使用环孢素后,25%的患者的血清肌酐水平平均增加了48%[18]。
硫唑嘌呤用于全身型MG患者,其在使用皮质类固醇治疗后仍会出现症状,或者存在皮质类固醇禁忌症[16]。部分临床试验比较了硫唑嘌呤与其他药物(如泼尼松和甲氨蝶呤)的效果[19-20]。一项在全身型MG患者中进行的前瞻性研究,评价了硫唑嘌呤与泼尼松使用的疗效,发现两药疗程不同而疗效无明显差异,对一种药物无反应的严重疾病患者可能从2种药物的联合治疗中获益[19]。这些数据很可能是许多指南推荐泼尼松起始治疗并在需要加强控制时添加硫唑嘌呤的来源[19]。
已用于治疗MG的其他免疫抑制剂包括霉酚酸酯、他克莫司、甲氨蝶呤、环磷酰胺、利妥昔单抗和依库珠单抗[11,16]。所有这些药物都有较多不良反应,可用于在传统方案中复发的患者或处方有限且需要换用更常见药物的情况,特别是甲氨蝶呤[16,19]。研究中[19],将甲氨蝶呤与硫唑嘌呤进行了头对头直接比较,显示出相似的获益和耐受性。因此,在因保险覆盖问题或医院处方无法使用硫唑嘌呤的情况下,可以使用甲氨蝶呤[19]。对于患有严重、难治性抗AChR抗体阳性的全身型MG患者,应考虑使用依库珠单抗,因其能减少病情加重并使病情得到改善[21]。
Efgartigimod是批准用于 MG 的新药[22]。针对人免疫球蛋白G1(immunoglobulin G1,IgG1)Fc片段的抗体,被设计用于降低IgG自身抗体水平[22]。其可通过竞争内源性IgG发挥作用,减少IgG的循环,增加其降解,从而降低自身抗体的循环水平[22]。
3.4 短期免疫调节治疗
对于因严重疾病或危象而需要紧急缓解症状的患者,最好的治疗方法是短期免疫调节[16]。可选择的方法包括血浆置换和静脉注射免疫球蛋白(intravenous immune globulin,IVIG)[16]。 尚未见血浆置换和IVIG方法的比较,但每种方法各有其优缺点[16]。没有随机对照试验支持使用血浆置换治疗MG;但是,与IVIG相比,血浆置换可能在3天内起效,而IVIG可能需要7~10天才能看到益处[11,16]。血浆置换的缺点包括需要建立血管通路、训练有素的工作人员和设备[16]。一项随机对照试验支持IVIG用于治疗MG,尽管美国食品药品监督管理局(Food and Drug AdministrationFood and Drug Administration,FDA)尚未批准IVIG用于该适应症[23]。 IVIG比血浆置换更容易给药,通常耐受性良好。然而,在有限的病例报告中已报告了罕见、严重的不良反应,包括过敏反应、肾损伤和血栓形成,发生率尚不清楚[11,16]。
4 共识指南的建议和讨论
《重症肌无力管理的国际共识指南》[3,23]的相关建议和讨论:①大多数抗AChR抗体阳性MG患者的初始治疗应包括吡啶斯的明[23]。②在尝试了吡啶斯的明治疗且未达到治疗目标或患者属于不同抗体亚型的情况下,应使用皮质类固醇或其他免疫抑制剂[23]。③对于眼部MG患者,应将皮质类固醇用作首选的免疫抑制剂[3]。④当患者不能接受皮质类固醇治疗时,应使用免疫抑制剂;当患者症状控制不佳时,也可以将免疫抑制剂与皮质类固醇联用[23]。⑤推荐的免疫抑制剂包括硫唑嘌呤、霉酚酸酯、甲氨蝶呤和他克莫司[23]。⑥除上述讨论的免疫抑制剂外,患有难治性疾病的患者还可以接受长期IVIG治疗、长期血浆置换治疗、环磷酰胺和利妥昔单抗治疗[23]。⑦2020年指南更新讨论将依库珠单抗用于严重、难治性抗AChR抗体阳性MG患者[3]。⑧自FDA批准efgartigimod以来,指南尚未修订,但可以根据临床试验数据及其FDA批准的适应症对其进行使用。⑨一旦症状控制达标,免疫抑制剂和皮质类固醇的剂量应逐渐减少至最低有效剂量[3,23]。
5 MG加重及其相关药物
MG病情加重,有时称为肌无力危象,是一种严重的并发症[24]。最明显的症状是进行性呼吸无力,在严重的情况下,可能导致呼吸衰竭并需要机械通气[24]。高达20%的MG患者一生中至少会发生1次急性加重,女性发生急性加重的可能性是男性的2倍[24]。
许多因素可能导致病情加重,包括感染(占38%)、怀孕、睡眠不足、手术、情绪压力、疼痛和极端温度[20]。某些药物也被确定为潜在原因[24],包括抗菌药物、β受体阻滞剂、钙通道阻滞剂、镁和普鲁卡因胺。
药物导致MG恶化的主要机制有2种:①引发针对NMJ的自身免疫应答[5]。激活免疫系统的药物除了会导致原有疾病恶化外,还会导致新的疾病发生[5]。②涉及对神经肌肉传递的干扰和并暴露症状[25]。药物可以通过抑制神经动作电位、抑制ACh释放、突触间隙中ACh的降解以及骨骼肌的AChR阻滞来影响神经肌肉的传递[5]。
MG最常见的恶化原因和涉及的常见药物类别在下文中列出,大多数证据来自病例报告和上市后分析。
5.1 影响免疫应答的药物
5.1.1 肿瘤免疫疗法
随着免疫疗法在癌症治疗中的应用增加,已有免疫检查点抑制剂(immune checkpoint inhibitors,ICI)引起MG 的报道[26]。虽然这是一种极为罕见的不良反应,但占所有ICI报告的0.47%。并且,在世界卫生组织(World Health Organization,WHO)药物警戒数据库的报告中,显示0.04%的患者可能危及生命[26]。在出现这种不良反应的患者中,高达45%的患者出现呼吸衰竭,并且有多达40%的患者死亡[26]。
5.1.2 酪氨酸激酶抑制剂(tyrosine kinase inhibitors,TKI)
TKI引起新发MG的机制尚不清楚[5]。12例癌症患者在接受达拉非尼和曲美替尼联合治疗、binimetinib、伊马替尼、尼洛替尼、坦度替尼和lorlatinib治疗后出现TKI相关MG[26]。诊断这种不良反应通常很困难,其中有5例患者被确定为抗AChR自身抗体阳性[27]。停用TKI或使用吡啶斯的明和皮质类固醇治疗后,所有患者的症状均得到改善[27]。随着TKIs越来越多地用于治疗各种恶性肿瘤,包括肾细胞癌、肺癌和慢性粒细胞白血病,应关注这种罕见的不良反应。
5.2 对NMJ有直接作用的药物
5.2.1 抗菌药物
抗菌药物是导致MG加重的最常见药物之一[5]。在一项回顾性研究中,使用阿奇霉素的31例患者中有8例(27%)发生MG加重[28],其被列为最可能引起MG加重的药物之一。研究认为,MG恶化与突触前水平的神经肌肉传递受损有关[5]。与其他药物相比,大环内酯类药物引起的MG急性加重频率相对较高,因此建议在MG患者中不使用大环内酯类药物[5,28]。
相关研究中[5],也有全身暴露于环丙沙星、莫西沙星和左氧氟沙星使MG恶化的报道。这种不良反应的发生在抗菌药物服用开始后15min~4天迅速发生[5]。喹诺酮可直接作用于AChR通道,影响终板电位,从而中断突触传递[5]。一项分析在FDA不良事件报告系统中检索了1970~2011年国内外使用这些药物导致MG恶化的报告,共发现27例受影响的患者和9例已发表的病例报告[29-30]。在这些患者中,病情加重均在全身暴露后1天内发生[29]。病例报告中的大多数患者为女性,中位年龄为63.5岁,70%的患者有MG病史[29]。由于症状可能很严重,因此如果可能,建议不要在MG患者中使用全身性氟喹诺酮类药物。
氨基糖苷类药物可能会导致病情危重且需要高剂量用药的患者病情加重[5,28]。这类药物可影响突触前膜的ACh释放,从而引起MG恶化[5]。而使用治疗剂量妥布霉素时,未见相关不良反应。妥布霉素是MG患者的首选氨基糖苷类药物。但是,尚未确定特定的“安全”剂量范围[5]。值得注意的是,已有报道给予钙剂可成功逆转阿米卡星和庆大霉素引起的神经肌肉阻滞[5,28]。
关于青霉素给药后MG临床恶化的研究数据有限[30]。1份病例系列研究描述了6例接受阿莫西林或阿莫西林/克拉维酸治疗后疾病恶化的患者[30]。在该系列研究中,大多数患者症状较轻,均在2个月内恢复[30]。由于所报告病例的发生频率低且症状较轻,故青霉素可用于该研究的MG患者。
5.2.2 心血管用药
多类心血管药物与MG加重有关。β受体阻滞剂已被证明可引起短暂性病情加重[5,28]。一项研究报告称,与未接受β受体阻滞剂治疗的患者相比,接受β受体阻滞剂治疗的患者病情恶化的概率增加了2.7倍[28]。β受体阻滞剂导致MG恶化的因素较多,因此,应尽量避免使用β受体阻滞剂,必须用药时,应密切监测。与抗菌药物一样,病情恶化通常发生在开始用药后不久,需要密切观察。
钙通道阻滞剂加重MG病情也有报道,特别是非洛地平、硝苯地平和维拉帕米[5]。非洛地平和硝苯地平的报道显示,停药后症状缓解,在用药后症状重新出现[5]。维拉帕米和硝苯地平的报告显示,在病情严重、全身型MG患者中可能会出现呼吸衰竭[5]。总体而言,钙通道阻滞剂加重病情的发生率较低,可谨慎使用这些药物。
Ⅰa类抗心律失常药引起MG病情加重也有报道,病例报告中强调了氯喹与抗AChR抗体的产生有关,并直接影响NMJ的信号传递[5]。普鲁卡因胺已被证明在患有肾脏和/或呼吸衰竭的患者中,即使没有潜在MG风险也会引起症状[5]。如果可能,可避免使用Ⅰa类抗心律失常药[5]。
5.2.3 镁
镁通过抑制ACh释放到NMJ来阻断神经肌肉传递[5]。尽管许多患者在正常镁浓度下不会出现不良反应,但MG患者中这种额外的ACh抑制作用可能会引起不良反应。在此类患者中应谨慎使用镁补充剂,因为这可能会加重和/或引起肌无力危象[5]。值得注意的是,1例补充镁后MG症状急性恶化的报告涉及肠胃外给药。尚不清楚其他制剂在MG患者中的安全性,静脉注射镁剂时应高度谨慎。
5.2.4 麻醉用药
MG患者往往对麻醉用药更敏感[5]。由于这种敏感性,如果可能,应避免高剂量使用这些药物[5]。有报告支持在MG患者中可以安全使用阿片类药物,安全的用法是尽可能从低的剂量开始,并在耐受的情况下进行滴定[5]。当考虑使用神经肌肉阻滞剂时,应优先选择非去极化肌肉松弛药(如罗库溴铵),而不是去极化肌肉松弛药(如琥珀酰胆碱)。
5.2.5 皮质类固醇
皮质类固醇虽然是MG的主要治疗药物,但在开始治疗后或剂量增加时可能导致疾病恶化[5]。对27篇描述启用糖皮质激素治疗后病情加重的文献进行分析,发现约33.3%的患者出现了初始病情恶化[31]。年龄较大、患有全身型MG、出现延髓症状、病情严重或胸腺异常的患者,这种初始恶化的风险可能会更大[5,31]。尽管已经观察到这类情况,但研究未能找到直接的相关性或排除这种不良反应的可能性[31]。还需要进行前瞻性研究以确定真正的影响。皮质类固醇仍可应用于MG治疗,考虑到病情恶化的可能性,在开始用药和增加剂量时应谨慎。
5.2.6 AChE抑制剂
吡啶斯的明虽然是治疗抗AChR抗体阳性MG的一线选择,但可能导致抗MuSK抗体阳性患者的神经肌肉传递恶化[5]。由于吡啶斯的明会延长ACh对AChR的作用,因此通过AChR正常传导的患者可能会出现不良反应,如虚弱、松弛性麻痹和呼吸衰竭[5]。因此,AChE抑制剂仅可用于抗AChR抗体阳性的患者。
5.2.7 肉毒杆菌毒素
肉毒杆菌毒素通过阻断ACh从突触前膜的释放而导致肌肉麻痹[5]。MG患者通常应避免使用肉毒杆菌毒素,但是一些研究支持其在轻度或疾病稳定患者中安全使用[32]。根据现有文献,肉毒杆菌毒素应避免用于MG患者的美容,但对于轻度或病情稳定的MG患者,当具有其他疾病适应症时(如偏头痛),可以考虑使用肉毒杆菌毒素。
5.2.8 疫苗
MG患者接种疫苗一直备受关注。大多数流感疫苗的数据可用,其中至少有2项前瞻性研究试图确定该疫苗在MG患者中的安全性。①一项研究调查了流感和疫苗接种对症状严重程度的影响[17]。这项前瞻性队列研究招募了2015年3~8月来自10家医院的诊断为MG的患者[33]。总共招募了258例患者,其中51.6%的患者接种了流感疫苗[33]。该研究发现,与普通感冒患者[15/96(15.6%)]相比,流感患者的症状激活率[10/25(40%)]更高[33]。133例接种流感疫苗的患者中,有2例(1.3%)出现症状恶化[33]。②一项前瞻性、随机、双盲、安慰剂对照研究[34],探讨了流感疫苗在使用或未用免疫抑制药物的抗AChR阳性MG患者中的安全性和有效性,纳入了47例MG患者和47名健康受试者[34]。患者被随机分为接种流感疫苗或注射安慰剂,4周后揭盲,并给安慰剂组受试者接种疫苗[34]。结果表明,在针对流感或AChR的抗体滴度方面,两组之间没有差异,表明流感疫苗接种既安全又有效[34]。根据现有文献,MG患者接种流感疫苗是安全的。
6 讨论
MG是一种自身免疫性疾病,会导致骨骼肌无力。全身型抗AChR抗体阳性MG患者的主要治疗方法是吡啶斯的明联合或不联合免疫抑制剂。对于非AChR抗体阳性的患者,应考虑使用皮质类固醇和/或其他免疫抑制剂。治疗基于患者的应答,并且许多数据都很薄弱,需要根据不良反应和患者特定因素(如肾功能)进行临床判断。
应谨慎使用和密切监测的特定药物包括抗菌药物(如大环内酯类和氟喹诺酮类)、镁、镇静剂和镇痛药。由于在有限的文献中,MG患者对镇痛药的反应不可预测,因此对于MG患者镇痛药的给药剂量或顺序、可能的最低剂量应基于患者过去是否接受过类似的镇痛药来确定。
药物并非总会导致MG恶化,其他外部因素也可能会导致MG恶化。药物诱发MG加重的支持证据较弱,主要来源于病例报告。因此,寻找其他可能的MG加重原因(包括感染、手术、情绪压力和疼痛),以避免中止患者可能因其他疾病而需要的药物是很重要的。药物引起的MG加重的时间线应与开始用药或增加剂量一致,如果患者在上个月没有新加药物或剂量增加的情况下出现MG加重,是由药物引起MG加重的可能性很小。可安全使用、应慎用和禁用的药物见表2。
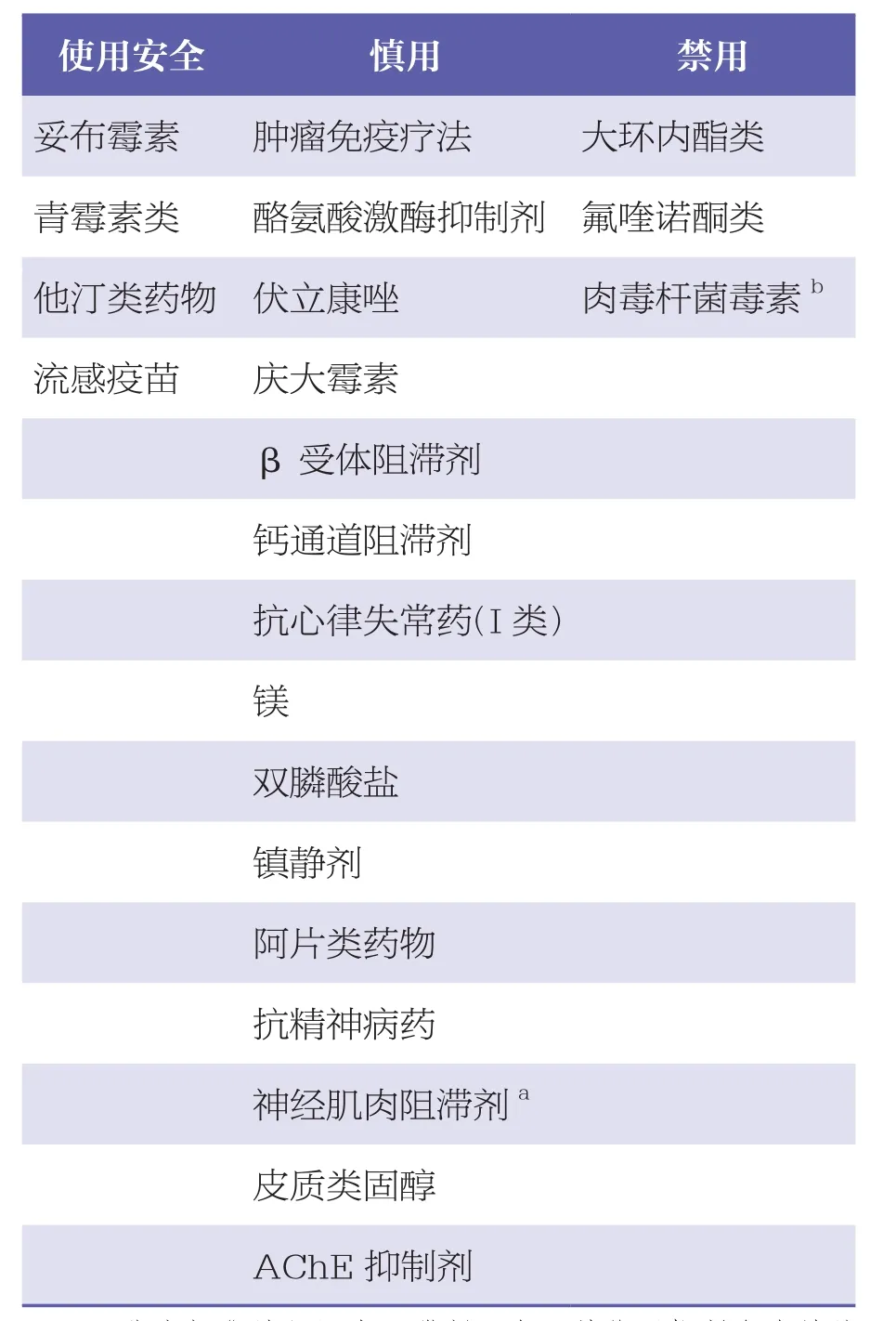
表2 MG患者使用安全、慎用、禁用的药物汇总[5,17,23,34]
中国免疫学会神经免疫分会基于近5年国内外文献中的最新证据,参考相关国际指南,在对中国MG诊治指南(2015版)更新修订的基础上编写并发表了《中国重症肌无力诊断和治疗指南》(2020版)[34],采用MGFA临床分型替代Osserman分型,旨在对疾病严重程度进行量化评估;提出了MG亚组分类,指导精准化治疗;对治疗目标进行了定义;针对胸腺切除,利妥昔单抗、依库珠单抗等生物制剂的应用,眼肌型MG早期免疫抑制治疗以及免疫检查点抑制剂治疗相关MG等方面提出了新的建议。在安全用药的角度,该指南中提醒MG患者慎用的药物包括部分激素类药物、部分抗感染药物(如氨基糖苷类抗菌药物以及两性霉素等抗真菌药物)、部分心血管药物(如利多卡因、奎尼丁、β受体阻滞剂、维拉帕米等)、部分抗癫痫药物(如苯妥英钠、乙琥胺等)、部分抗精神病药物(如氯丙嗪、碳酸锂、地西泮、氯硝西泮等)、部分麻醉药物(如吗啡、哌替啶等)、部分抗风湿药物(如青霉胺、氯喹等)。其他注意事项包括:禁用肥皂水灌肠,注意休息、保暖,避免劳累、受凉、感冒、情绪波动等。
7 结论
MG是一种自身免疫性疾病,患者体内存在与AChR或NMJ中其他分子结合的循环抗体。MG表现为骨骼肌无力,严重时会导致呼吸困难,可能需要机械通气。因此,临床医生应了解该疾病、理解其治疗以及药物如何导致MG或疾病恶化。
多种药物都可能导致MG急性恶化或新发病,但是数据非常薄弱,主要基于病例报告。任何对NMJ存在实际或潜在作用的药物都可能导致MG恶化,因此在MG患者中应谨慎使用。激活免疫系统的药物可能导致新的疾病发作,然而非常罕见。临床判断和选择替代药物可指导MG患者避免某些不合理用药;如果没有替代方法,则应根据适应症谨慎使用。
