10-羟基-12-十八碳烯酸的静息细胞合成
2023-01-12郭前婉彭舒悦王晨晨赵萌MichaelGaenzle
郭前婉,彭舒悦,王晨晨,赵萌*,Michael G.Gaenzle,2
(1 发酵工程教育部重点实验室 湖北省工业微生物重点实验室 湖北工业大学 武汉430068 2 阿尔伯塔大学农业、食品与营养科学系 加拿大埃德蒙顿 T6G 2P5)
10-HOE 是一种典型的微生物源羟基不饱和脂肪酸,主要通过亚油酸水合酶催化亚油酸,对其顺9 位双键进行羟基化而合成[1-2]。据文献报道,10-HOE 具有良好的真菌抑制效果[3-5],添加在发酵面包中其抑菌效果堪比商业防腐剂[6-7];对大脑炎症有潜在的调节和控制作用[8-10];通过小鼠实验发现10-HOE 还可有效预防过敏性皮炎[11]。10-HOE 在食品、生物医药等领域应用潜力巨大,其高效制备具有重要意义[1,12]。
10-HOE 是微生物合成共轭亚油酸的中间产物,主要是由含有10-亚油酸水合酶的野生菌或重组菌等进行生物合成[13-14],因而可通过静息细胞法进行生物合成。静息细胞法生物合成的影响因素主要有pH、温度、辅酶及其浓度、底物及菌体浓度等[15-17]。目前,有研究发现化脓性链球菌(Streptococcus pyogenes)[18],短双歧杆菌(Bifidobacteium breve)[19],鼠李糖乳杆菌(Lactobacillus rhamnosus)[20],植物乳杆菌(L.plantarum)[20],嗜酸乳杆菌(L.acidophilus)[20],动物双歧杆菌乳酸亚种(Bifidobacterium animalis subsp.Lactis)[20],汉氏乳杆菌(L.hammesii)[21],罗伊氏乳杆菌(L.reuteri)[21],穗状左乳杆菌(Levilactobacillus spicheri)[21]等菌具备合成10-HOE 的能力。而与一般的野生菌相比,基因工程菌含有高活性、高特异性的胞内酶,可大量表达目标酶,应用到静息细胞转化中,不仅可以有效发挥酶的作用,维持酶的稳定性,而且其细胞转化效率高,产物杂质少,处理更简单[22-23],是产业化生产10-HOE 的有效途径。
目前,10-HOE 生物合成研究较少[24],尚未有重组静息细胞大量合成10-HOE 的研究报道。10-HOE 是近年来研究的一种新型功能性脂肪酸,为探索其各种生物活性,有必要大量生产10-HOE,而静息细胞法是10-HOE 生物合成的有效途径。本文利用含有10-亚油酸水合酶的重组大肠杆菌(E.coli)BL21(DE3)/ pET28a-ZS2058-mcra 对底物亚油酸进行静息细胞转化合成10-HOE,通过单因素实验对转化温度、转化pH 值、FAD 浓度、氯化钠浓度、甘油浓度、酶浓度、底物浓度、转化时间等条件进行优化,建立可高效合成10-HOE 的混合体系。
1 材料与方法
1.1 材料与试剂
甘油、乙酸、乙醇,国药集团化学试剂有限公司;异丙基-β-D-硫代半乳糖苷(IPTG)、十五烷酸,Sigma-Aldrich 公司;甲醇、正己烷、异丙醇、2-丙醇,Fisher Scientific 公司;卡那霉素,广州赛国生物科技有限公司;FAD,上海麦克林生化科技有限公司;亚油酸、三甲基硅重氮甲烷,上海阿拉丁生化科技股份有限公司。
1.2 仪器与设备
7890A-5975C GC/MS 联用仪,日本Agilent公司;TS-2102C 型恒温摇床,常州金坛良友仪器有限公司;BOXUN 立式压力蒸汽灭菌器,上海博迅实业公司医疗设备厂;AIRTECH 超净工作台,苏州安泰空气技术有限公司;XW-80A 旋涡混合器,海门市其林贝尔仪器制造有限公司。
1.3 方法
1.3.1 重组大肠杆菌的构建、培养和诱导表达重组大肠杆菌的构建:质粒来源于江南大学,质粒名称为 pET28a -ZS2058 -MCRA(GenBank:JF747255.1)[25]。通过大肠杆菌 DH5α 和BL21(DE3)感受态细胞转化,最终获得可成功表达10-亚油酸水合酶的大肠杆菌BL21(DE3)/pET28a-ZS2058-mcra[24]。
LB 液体培养基:氯化钠10 g/L,酵母浸膏5 g/L,胰蛋白胨10 g/L,pH 7.4~7.6。LB 固体培养基:在上述LB 液体培养基中加入琼脂粉15 g/L。
将在-80 ℃冷冻保藏的2 mL 大肠杆菌BL21(DE3)/pET28a-ZS2058-mcra 接种于100 mL LB液体培养基中,加入50 mg/L 卡那霉素,37 ℃、200 r/min 培养12 h;按4.0%的接种量转接到新的LB液体培养基中,加入50 mg/L 卡那霉素,37 ℃,200 r/min 培养100 min(OD600nm0.6~0.8),加入0.5 mmol/L IPTG(IPTG 溶液为诱导剂,诱导重组细胞对10-亚油酸水合酶基因的表达),继续放入摇床中18 ℃、120 r/min 培养24 h。将诱导培养结束的重组细胞培养液在4 ℃、6 000 r/min 离心30 min,倒掉上清液,获得菌泥,将菌泥分装在2 mL 离心管中,于-20 ℃下冷冻保藏。
1.3.2 静息细胞转化试验 在8 mL 白盖瓶瓶内滴加3 mg 亚油酸液体作为反应底物,沿瓶壁加入50 mg 菌泥,再加入1 mL 磷酸盐缓冲溶液(pH 6.5,20 mmol/L),用旋涡混合器震荡至菌泥混合均匀后,分别在30,35,37,40,45,50 ℃,200 r/min 摇床中培养6 h,研究温度对10-HOE 转化率的影响。在确定温度的基础上,研究pH 值(pH=5.5,6.0,6.5,7.0,7.5,8.0 的磷酸盐缓冲溶液)对10-HOE 转化率的影响,其余条件不变。在确定温度、pH 值的基础上,加入(0,0.01,0.025,0.05,0.1,0.25 mmol/L)FAD,研究FAD 浓度对10-HOE 转化率的影响,其余条件不变。在确定温度、pH、FAD浓度的基础上,分别加入不同质量分数(2%,5%,10%)的甲醇、乙醇、正己烷、异丙醇、乙酸乙酯,研究有机溶剂种类及浓度对10-HOE 转化率的影响,其余条件不变。在确定温度、pH 值、FAD 浓度、有机溶剂种类及浓度的基础上,加入0,2%,5%,10%,15%,20%甘油,研究甘油质量分数对10-HOE 转化率的影响,其余条件不变。在确定温度、pH 值、FAD 浓度、有机溶剂种类及浓度、甘油的基础 上,加入0,15,50,100,150,200 mmol/L氯化钠,研究氯化钠浓度对10-HOE 转化率的影响,其余条件不变。在确定温度、pH 值、FAD 浓度、有机溶剂种类及浓度、甘油、氯化钠浓度的基础上,改变菌质量浓度(0,20,50,100,150,200,250 g/L),研究菌浓度对10-HOE 转化率的影响,其余条件不变。在确定温度、pH 值、FAD 浓度、有机溶剂种类及浓度、甘油、氯化钠、菌浓度的基础上,改变亚油酸质量浓度(4,10,20,30,40,50 g/L),研究亚油酸浓度对10-HOE 转化率的影响,其余条件不变。在确定最优条件后,在该条件下转化6,12,24,72 h,研究10-HOE 转化率随时间的变化。
1.3.3 10-HOE 的提取和甲酯化处理 脂肪酸的提取:培养结束后,在转化样品中加入2 mg 十五烷酸作内标,充分混匀,加入1 mL 异丙醇,旋涡震荡仪充分震荡30 s,再加入1 mL 正己烷,充分震荡30 s,在4 ℃、6 000 g 条件下离心30 min,吸取正己烷层氮气吹干,获得脂肪酸样品。
甲酯化:在脂肪酸样品中加入0.2 mL 重氮甲烷,剧烈振荡后,在室温反应30 min,加入50 μL乙酸,2 mL 正己烷,2 mL 超纯 水和100 μL 0.5 mol/L NaOH 溶液,离心取正己烷层,过0.22 μm有机滤膜后装入2 mL 气质瓶中。
1.3.4 气-质谱检测10-HOE 含量 气-质谱检测:安捷伦7890A-5975C。柱型:Agilent 19091S-433,0.25 μm×250 μm×30 m。初始150 ℃,保持2 min,以5 ℃/min 升温至200 ℃,保持10 min,再以4 ℃/min 升温至240 ℃,保持10 min,分流比10∶1,溶剂延迟3 min,进样器和检测器温度均为240℃,载气为高纯氦气。
内标法定量:称取10 mg 十五烷酸标样(内标物)、10 mg 亚油酸标样、10 mg 10-HOE,加入1 mL 磷酸盐缓冲溶液(20 mmol/L,pH 6.5),用上述脂肪酸提取,甲酯化的方法处理,然后进行气-质谱检测。
1.4 转化率和相对转化率的计算
响应因子f 的计算:

式中,As——内标物十五烷酸的峰面积(mV×min);ms——内标物的质量(mg);Ar——对照物的峰面积(mV×min);mr——对照物的质量(mg)。
根据含内标物待测物的色谱峰响应值,计算其含量mi(mg):

式中,f——校正因子;Ai——待测物质的峰面积(mV×min);As——内标物十五烷酸的峰面积(mV×min);ms——加入内标物的质量(mg)。
10-HOE 转化率αi的计算:

式中,mi——试样i 中10-HOE 的甲酯衍生物的质量(mg);m0——试样i 中所含的亚油酸质量(mg)。
相对转化率αri的计算:

式中,α1——每组试验中第1 个试样(对照组)中亚油酸的转化率(%)。
2 结果与分析
2.1 10-HOE 的气-质谱鉴定结果
静息细胞转化产物的气-质谱测定结果如图1a 所示。通过谱库匹配,除内标十五烷酸及底物亚油酸外,有新物质的生成,新物质的质谱图如图1b 所示。其特征碎片169 m/z 及201 m/z 同文献[24],[26]中报道的10-HOE 质谱图结果相同,与理论碎片值一致。因而,可以确定该新物质为10-HOE。在图1a 中,10-HOE 的色谱峰很高,说明大肠杆菌重组细胞对亚油酸有很好的转化能力,可高效合成10-HOE。

图1 重组大肠杆菌生物合成产物的鉴定Fig.1 Identification of the biosynthesis products of the recombinant E.coli
2.2 转化温度对转化率的影响
图2 显示不同温度下静息细胞转化合成10-HOE 的相对转化率。以30 ℃时转化率为100%,当转化温度37 ℃时,转化率最高,其转化率是30℃的1.5 倍。35,37,40 ℃下的转化率无明显差异。当温度大于45 ℃时,转化率急剧下降,仅为最高转化率的10%左右。最适温度的选择对静息细胞转化至关重要,含有13-亚油酸水合酶的重组菌在40 ℃时转化率最高[27],而对于含有油酸水合酶的重组菌则在30 ℃时达到最高转化率[28]。温度对生物合成具有重要意义,可以通过影响细胞的生长代谢而影响产物合成[15],也可直接影响产物的转化合成。最终选择37 ℃进行后续静息细胞转化实验。
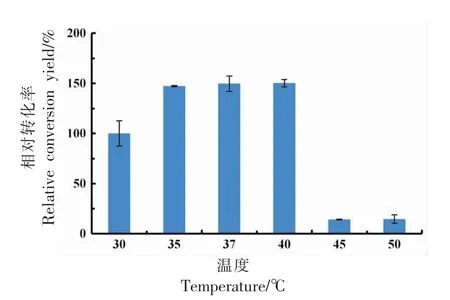
图2 转化温度对相对转化率的影响Fig.2 The effect of temperature on the conversion yield
2.3 pH 值对转化率的影响
静息细胞合成10-HOE 的转化率随pH 值变化如图3 所示。随着pH 值偏向中性,转化率逐渐升高,当pH 6.5,7.0 时,转化率达到最大值。pH 值继续增加,转化率明显降低,这有可能是由于10-亚油酸水合酶的活性受到抑制,使转化率降低。不同pH 值条件下酶的活性会有所差异,pH 值直接影响重组菌的生长及酶的催化活性、稳定性。当pH 7.0 时,静息细胞转化仍保持高活性,这是由于重组菌的最适生长pH 范围为7.4~7.6。与本试验结果相似的:含有油酸水合酶的重组菌转化油酸合成10-羟基硬脂酸的最适pH 值为7.5[29],接近大肠杆菌的最适生长pH 值。最终静息细胞转化的最适pH 值为7.0。
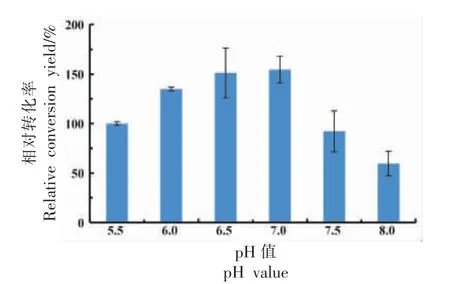
图3 pH 值对相对转化率的影响Fig.3 The effect of pH on the conversion yield
2.4 优化的辅酶因子FAD 浓度
如图4 所示,随着FAD 浓度的增加,菌体对亚油酸的转化率增加,当FAD 浓度达0.25 mmol/L后转化率趋于稳定,相比于未添加FAD 时转化率增加了5 倍。这是因为10-亚油酸水合酶具有辅酶因子依赖性,在静息细胞转化过程中,添加辅酶因子FAD 有利于10-HOE 的合成。来源于溶酪大球菌(Macrococcus caseolyticus)的油酸水合酶具有更明显的FAD 依赖性,当转化体系不含FAD时,含油酸水合酶的重组菌不具有催化活性,随着FAD 浓度的增加,其催化活性增加,当FAD 浓度在0.2 mmol/L 以上时含油酸水合酶的重组菌催化活性达到稳定[30]。辅酶因子可与酶结合,刺激酶的活性,促进酶对产物的催化合成,参与电子、基团等的传递,合适的辅酶因子浓度可以增加细胞的转化效率[17]。最终最适FAD 浓度为0.25 mmol/L。
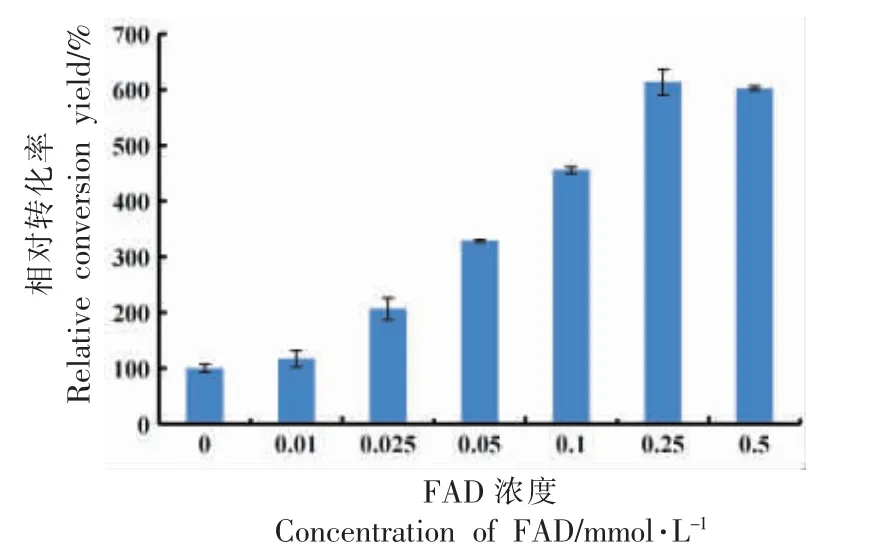
图4 FAD 浓度对相对转化率的影响Fig.4 The effect of the FAD concentration on the conversion yield
2.5 优化的有机溶剂及其浓度
图5 显示不同有机试剂对菌体转化的影响。在2%添加量的情况下,添加甲醇、乙醇对转化有抑制作用,而添加乙酸乙酯、异丙醇及正己烷有利于菌体转化,且正己烷效果最好,其转化率约为未添加有机试剂的3.8 倍。然而,有机试剂浓度增加到一定值后,菌体的转化率明显降低。对于静息细胞转化而言,有机溶剂不仅作为助溶剂提高底物的溶解度,还对细胞进行透性化处理来促进细胞转化[27]。细胞透性化处理主要是在改变细胞膜通透性的同时,不破坏细胞整体有机体系,使得一些小分子和较大分子物质能够自由进出细胞,使胞内酶在相对稳定的细胞环境中充分发挥作用,提高菌体的催化效率[31]。与赵伟睿等[32]的研究结果相同,正己烷具有低介电系数,且疏水性较高,对酶分子的稳定性影响较小,有助于提高酶的催化活性,从而提高了转化率。最终选择2%的正己烷添加到菌体转化体系。
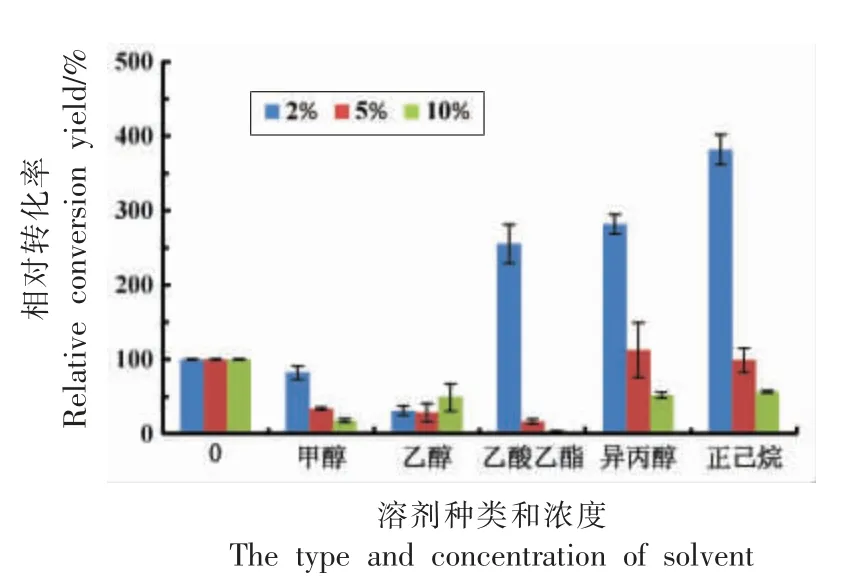
图5 有机试剂对转化率的影响Fig.5 The effect of organic reagent on the conversion yield
2.6 优化的甘油浓度
据报道,有机溶剂存在时,甘油对生物细胞具有一定的保护作用,还可为生物细胞提供一定的热稳定性[33-34]。甘油浓度对转化率的影响如图6 所示。随着甘油含量的增加,转化率均略有降低,未有明显的抑制作用。甘油的作用是在冷冻过程中保护菌体,不一定有利于菌体的转化。转化率降低可能是由于甘油增加了转化体系的黏度,阻碍了振荡过程中菌体与底物的结合。另一个原因可能是甘油浓度升高造成高渗透压环境,抑制细胞内10-亚油酸水合酶的活性,从而降低菌体合成10-HOE 的转化率。选择不添加甘油做后续试验。
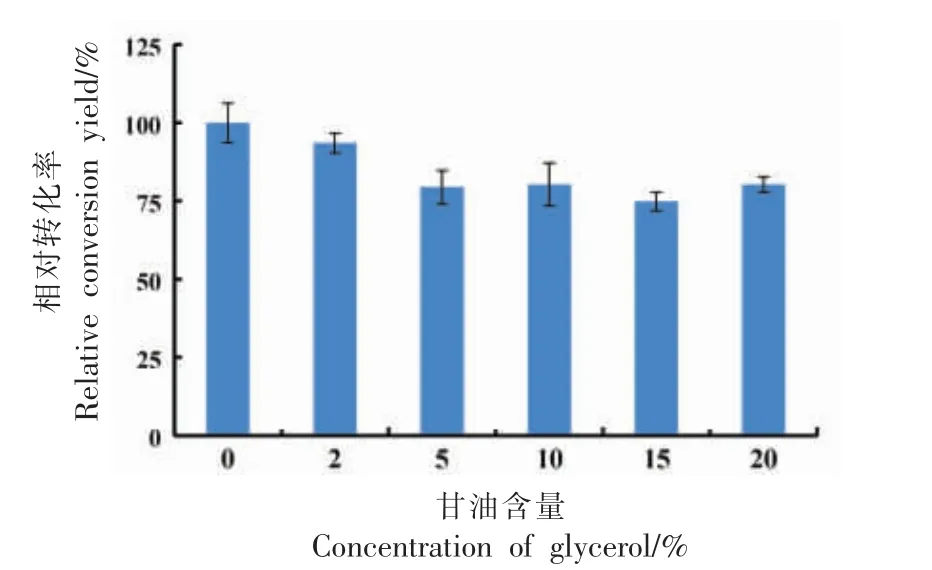
图6 甘油浓度对相对转化率的影响Fig.6 The effect of the glycerol concentration on the conversion yield
2.7 优化的氯化钠浓度
不同浓度的氯化钠对静息细胞转化合成10-HOE 转化率的影响如图7 所示。当氯化钠浓度为15 mmol/L 时,能够增加转化率,当其浓度过高时,转化率无明显变化。Gandhi 等[35]研究发现当氯化钠质量分数超过临界值2.5%时,会抑制大肠杆菌的生长,从而影响其催化活性。添加适量的氯化钠可以维持细胞内、外渗透压,渗透压过高或过低均不利于菌的存活及内、外物质交换[36]。在后续试验中选择氯化钠最适浓度15 mmol/L。
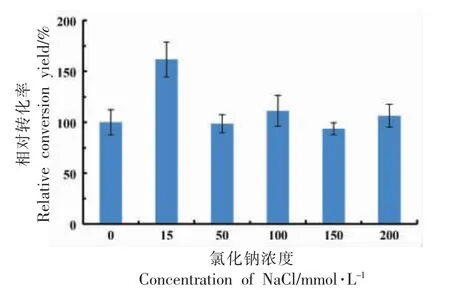
图7 氯化钠浓度对相对转化率的影响Fig.7 The effect of the NaCl concentration on the conversion yield
2.8 优化的菌浓度
菌浓度对静息细胞转化合成10-HOE 转化率的影响如图8 所示。转化率随菌浓度的增加而增加,当菌质量浓度达200 g/L 后,转化率无明显变化。这是由于参与细胞转化的菌浓度越高,含有10-亚油酸水合酶越多,合成10-HOE 的能力越强,而当菌浓度与底物达到饱和状态时,转化率不再明显上升。这与13-LHT 全细胞催化亚油酸合成13-HOE 的结果相似,13-HOE 浓度随细胞浓度的增加而增加,当细胞质量浓度在25 g/L 以上时趋于稳定,转化率约为70.0%[27]。选择菌质量浓度为200 g/L 进行后续试验。
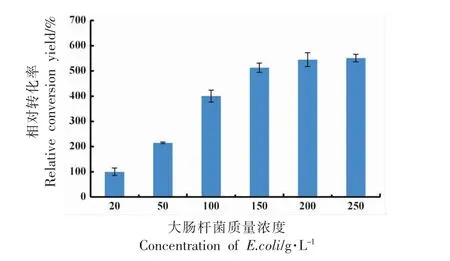
图8 菌浓度对转化率的影响Fig.8 The effect of the E.coli concentration on the conversion yield
2.9 优化底物浓度
细胞转化结果如图9 所示。随着亚油酸浓度的增加,10-HOE 的转化率呈先增大后减小的趋势。当亚油酸质量浓度为10 g/L 时,10-HOE 转化率为(68.3±3.9)%;当亚油酸浓度增加至20 g/L时,转化率迅速降低,说明此时亚油酸达到饱和。与13-LHT 细胞转化亚油酸的结果类似,产物13-HOE 的浓度随底物亚油酸浓度的增加而增加,当亚油酸质量浓度为250 g/L 时达到饱和,13-HOE转化率随亚油酸浓度的增加而慢速减小[27]。据报道,底物和产物浓度对全细胞催化合成脂肪酸有很大的影响,胞内、外的浓度过高,对合成有一定的抑制作用[17]。以10 g/L 的亚油酸为底物时转化率最高,而以20 g/L 的亚油酸为底物时,其转化率仍有(50.7±1.6)%。为了提高生产效率,选择20 g/L亚油酸为底物进行后续实验。

图9 亚油酸质量浓度对转化率的影响Fig.9 The effect of linoleic acid concentration on the conversion yield
2.10 转化进程曲线
混合体系静息细胞合成10-HOE 的转化率随时间的变化如图10 所示。以20 g/L 亚油酸为底物,加入的细胞质量浓度为200 g/L,随着转化时间的增加,转化率增加,而转化速率先增大后减小。催化反应12 h 内转化率增长最快,转化12 h时,转化率达(62.2±1.7)%,此后转化速率增加速度明显减小;24 h 时转化率为(73.1±0.9)%,10-HOE 质量浓度为(16.3±0.2)g/L;转化72 h 时,转化率达(81.5±1.3)%。Kishimoto 等[37]利用野生菌副干酪乳杆菌副干酪亚种(Lacticaseibacillus paracasei subsp.paracasei JCM 1111),以2 g/L 亚油酸为底物,在pH 6.5、30 ℃条件下转化148 h,10-HOE 的合成转化率达91%,是目前生物合成10-HOE 产量最高的报道。本研究利用重组大肠杆菌以20g/L 的底物质量浓度在24h 内合成率达73.1%,极大地提升了10-HOE 的生物合成效率。

图10 最优条件下大肠杆菌静息细胞法合成10-HOE 的时间曲线Fig.10 Time-course reaction of 10-HOE biosynthesis using E.coli resting cell system under optimal conditions
3 结论
通过气相色谱-质谱联用仪对混合体系静息细胞合成10-HOE 的条件进行优化。经单因素优化,得到混合体系静息细胞合成10-HOE 的最佳条件为:20 g/L 亚油酸、pH 7.0 的20 mmol/L 磷酸盐缓冲溶液、200 g/L 菌泥、0.25 mmol/L FAD、2%正己烷、15 mmol/L 氯化钠,恒温摇床37 ℃、200 r/min 转化24 h,最优转化率为(73.1±0.9)%。与初始条件相比,优化的静息细胞合成10-HOE 的转化率得到很大提升。本文基于混合体系的重组菌静息细胞转化法合成10-HOE,方法操作简单,生产效率高,10-HOE 的纯度高,为静息细胞合成10-HOE 的工业生产提供技术参考。
