热诱导对麦醇溶蛋白-芦丁相互作用及其乳化特性的影响
2023-01-12李春翼王启明张驰雷小娟赵吉春明建
李春翼,王启明,张驰,雷小娟,赵吉春,2,明建,2*
(1 西南大学食品科学学院 重庆400715 2 西南大学 食品贮藏与物流研究中心 重庆 400715)
麦醇溶蛋白(gliadin,G)是从小麦中提取的一种植物源醇溶性蛋白质。植物源蛋白具有价格亲民、资源丰富、环境无污染等优点,被认为是食品工业中替代动物蛋白的潜在来源之一[1]。鉴于G的两亲性,可以自组装成纳米颗粒。G 还可以自组装形成广泛的中间结构,通常用于药物或生物活性物质的输送[2]。在多种黄酮类化合物中,芦丁(rutin,R)(3',4',5',7'-四羟基黄酮-3-芸香苷)是槲皮素和鼠李糖-葡萄糖二糖的一种糖基化形式,在荞麦中含量丰富,又称芦苷、槲皮素-3-O-芦丁苷、维生素P、槐花素,其名字来源于富含芦丁的植物芦塔(Ruta graveolens L)[3]。芦丁的主要缺点是生物利用度受限,归因于水溶性低、稳定性差、膜透性有限,观察到的体外效应并不总是能转化为临床试验[4]。研究发现,多酚结合在蛋白质的疏水位点上能改变蛋白质结构,因为只有弱的疏水位点才能留在蛋白质表面,从而引起蛋白质折叠和功能的可能性转变[5]。鉴于荞麦和小麦在日常生活中的混合食用以及多谷物产品的出现,G 与R 不可避免地存在相互作用,且有关二者间强烈的相互作用已有文献[6]报道。
多酚类物质对食品加工条件很敏感,特别是对热处理。巴氏杀菌或高温灭菌可能会导致多酚的氧化,这些化合物显著损失或降解[7]。此外,氧化酚类具有通过各种物理化学途径与周围的大分子,包括蛋白质相互作用的潜力,导致食品生产和随后的贮藏过程中发生质量恶化[8]。另外,对蛋白质-多酚互作领域的基础研究通常是在环境温度附近进行。在这种条件下,二者的相互作用本质上主要是非共价的(氢键、范德华尔力和疏水效应)。然而,还应考虑工业加工过程中高温的影响,以便利用高温条件下蛋白质-多酚化合物相互作用的研究结果有效地指导加工产品。由于蛋白质的结构特征(如构象状态或灵活性)会影响其功能[9-10],包括界面吸附行为和乳化特性,因此,需要探讨构象状态、灵活性与食物蛋白质功能特性之间的联系。
本文研究不同热处理对G、R 相互作用的影响,通过多光谱技术分析两者相互作用。通过同步荧光、紫外扫描光谱、拉曼光谱表征蛋白质结构的差异,旨在为G 的结构修饰,改善蛋白功能特性,蛋白质的精深加工提供参考。
1 材料与方法
1.1 材料与试剂
麦醇溶蛋白,美国sigma 公司;芦丁,北京索莱宝科技有限公司;大豆油,九三粮油工业集团有限公司;其它试剂均为分析纯级,成都科龙化工试剂公司。
1.2 仪器与设备
ZEN3690 马尔文激光粒度分析仪,英国马尔文仪器公司;LGJ-10 真空冷冻干燥机,北京松原华兴科技有限公司;HH-6 数显恒温水浴锅,金坛市富华仪器有限公司;F-2500 荧光分光光度计,日本日立;2450FW 紫外扫描仪,日本Shimadzu 公司;DXR2 激光拉曼光谱仪,美国Thermo Fisher 公司;DSC25 差示量热扫描仪,美国TA 公司。
1.3 方法
1.3.1 复合物的制备 制备G-R 复合物,参考Filippidi 等[11]的方法。在磁力搅拌下将0.1 g G 和0.01 g R 分别于0.05 L 0.01 mol/L 醋酸溶液,0.05 L 60%(体积分数)乙醇溶液中分散,于冷藏条件下储存12 h 后按体积比1∶1 混匀。将0.1 L 所得溶液滴入转速为10 000 r/min 的0.3 L 水溶液中。均质完成后,所得溶液分别经25,60,80,100 ℃处理30 min,冰水浴中冷却,停止反应。对冷却后的部分液体留样检测,一部分样品冻干后进行固体样测定。不加芦丁的相同条件下制备对照样品。
1.3.2 粒径、电位测定 用malvern 激光粒度分析仪(ZEN3690,UK)测定热处理的G-R 悬浮液的粒度分布及电位值。用去离子水按1:50 的比例稀释悬浮液,设置溶剂的折射率为1.33。对每个样液至少测定3 次。
1.3.3 同步荧光光谱 固定282 nm 处的激发波长,测量同步荧光。设置波长差Δλ 分别为15 nm和60 nm,激发、发射狭缝宽度均5.0 nm,扫描速度1 500 nm/min。
1.3.4 紫外光谱测定 参考王丽颖[6]方法,以纯化水作为空白,将一定量的样品置样品池中,测定扫描波长190~400 nm 范围的紫外吸收光谱。
1.3.5 拉曼光谱分析 将样品置玻片上,激发波长785 nm。仪器设置为物镜20 倍,光斑尺寸1 μm,针孔宽度50 μm,激光能量15 mW,背景曝光4.2 s,曝光次数42,光栅为400 刻度/nm,收集波数500~4 000 cm-1范围的光谱。使用OMNIC 8.2(Thermo Fisher Scientific Inc.,Waltham,MA,USA)软件校正基线、平滑以及数据归一化处理(以1 003 cm-1为内标)。分析G 的二硫键结构。
1.3.6 热稳定性分析 用差示扫描量热仪(Differential scanning calorimetry,DSC)分析复合物热稳定性[11]。将2.0 mg 试样放入铝锅中,铝盖密封,以10 ℃/min 的速度从40 ℃加热到100 ℃。空白铝锅为对照。用分析软件从各热曲线上计算变性点的峰值温度。
1.3.7 乳化活性与乳化稳定性测定 将样品与大豆油5 ∶9(体积比)混合后在10 000 r/min 的转速下分散3 min。乳化活性指数(emulsifying activity index,EAI)和乳化稳定性指数(emulsion stability index,ESI)参考Shen 等[12]的方法。取10 μL 乳液稀释于6 mL SDS(0.1 mg/mL)溶液中,在500 nm处测定吸光度。分别根据方程(1)和(2)计算EAI和ESI 的值。
式中,DF——稀释因子;C——样品的初级质量浓度(g/mL);λ——乳液中 油的体积分数;A0——纳米乳液在0 min 时的吸光度;A1——纳米乳液在10 min 时的吸光度;t——10 min。
1.4 数据统计及分析
数据为3 次重复,用Origin 9.0 软件处理数据。使用SPSS 19.0 软件对数据ANOVA 做差异显著性分析与t 检验。
2 结果与分析
2.1 粒径电位分析
如表1 所示,麦醇溶蛋白粒径338.55 nm,多分散指数较高,溶液分布不均匀。然而,加热后G溶液的尺寸发生较大的变化,样品粒度分布向较大值方向移动。热处理导致热聚集现象的发生。这一结果与文献[13]报道的一致。60 ℃条件下G-R溶液粒径较G 有所下降,表明芦丁有助于G 溶液粒径的减小,且常温下G-R 粒径相较于G 减小,芦丁的添加对热诱导的蛋白质聚集产生抑制作用。颗粒的减小主要是由于蛋白质-多酚相互作用增强所致[13]。在加热前,G 保持原生状态,大部分疏水结构域被埋在核内,导致与芦丁的相互作用较弱。然而,加热带来蛋白质变性和结构重排,暴露更多隐藏的疏水氨基酸残基以及多肽链解卷[11],从而大大加强了G 和R 之间的相互作用,产生更紧凑的复合物。此外,R 的负电荷也在增加静电排斥和阻止进一步聚集方面发挥作用。80 ℃条件下G 粒径有所减小,聚集或絮凝的液滴变少,与潘成磊等[14]的研究结果相似。100 ℃条件下,G-R的粒径相较于G 增加了25.40%,温度达100 ℃后,R 可连接蛋白质分子,形成更大的复合物[15]。另外,热处理以及与芦丁复合后所有样品的PDI显著降低,表明样品尺寸分布变得更窄。

表1 热诱导后麦醇溶蛋白与芦丁的猝灭参数、结合常数以及结合位点Table 1 Quenching parameters,binding constants and binding sites of wheat gliadin and rutin at different temperatures
Zeta 电位分析表明,添加芦丁和热处理均显著提高了麦醇溶蛋白溶液的绝对Zeta 电位值。通常,较高的净负电荷或正表面电荷导致较大的静电斥力,从而抑制聚集,增强体系的稳定性。另外,因蛋白质表面净负电荷增加而产生的强静电斥力,也会削弱非极性基团之间的疏水作用[16]。热处理后,随着加工温度的升高(至100 ℃),绝对Zeta电位明显下降,这与Ren 等[13]的研究一致。热诱导导致电荷发生重排,部分带电基团进入蛋白质的内部,失去对表面电荷贡献的能力[13]。
从上述结果看出,芦丁与麦醇溶蛋白结合对热诱导的蛋白质聚集体形成起抑制作用,这涉及一个复杂的变性、解离和再聚集过程。结合位点的净正电荷被芦丁分子上的负电荷所取代,导致蛋白质聚集体的净负电荷增加,从而增强蛋白质溶液的胶体稳定性[17]。
2.2 同步荧光光谱
同步荧光被广泛用作研究蛋白质荧光团微环境变化。设定激发波长(λex)及发射波长(λem)的固定波长差为Δλ=15 nm、Δλ=60 nm,分别反映Trp和Tyr 残基的微环境变化[18]。Δλ=15 nm、Δλ=60 nm 时其荧光强度均随芦丁浓度的增加而降低;当Δλ=15 nm 时,最大吸收波长没有变化;当Δλ=60 nm 时,色氨酸最大发射波长出现红移:25 ℃(276.5→279.5 nm),60 ℃(276→279.5 nm),80 ℃(277→279.5 nm),100 ℃(276.5→279 nm),证实色氨酸(Trp)和酪氨酸(Tyr)都参与G 荧光的猝灭。R的加入,使蛋白质荧光强度降低,Trp 残基的荧光强度猝灭强于Tyr 残基,这表明Trp 的荧光贡献更强,此现象取决于激发波长的设置以及两种氨基酸的相对含量[19]。此外,受芦丁的影响,Trp 的微环境极性增加,疏水性降低。

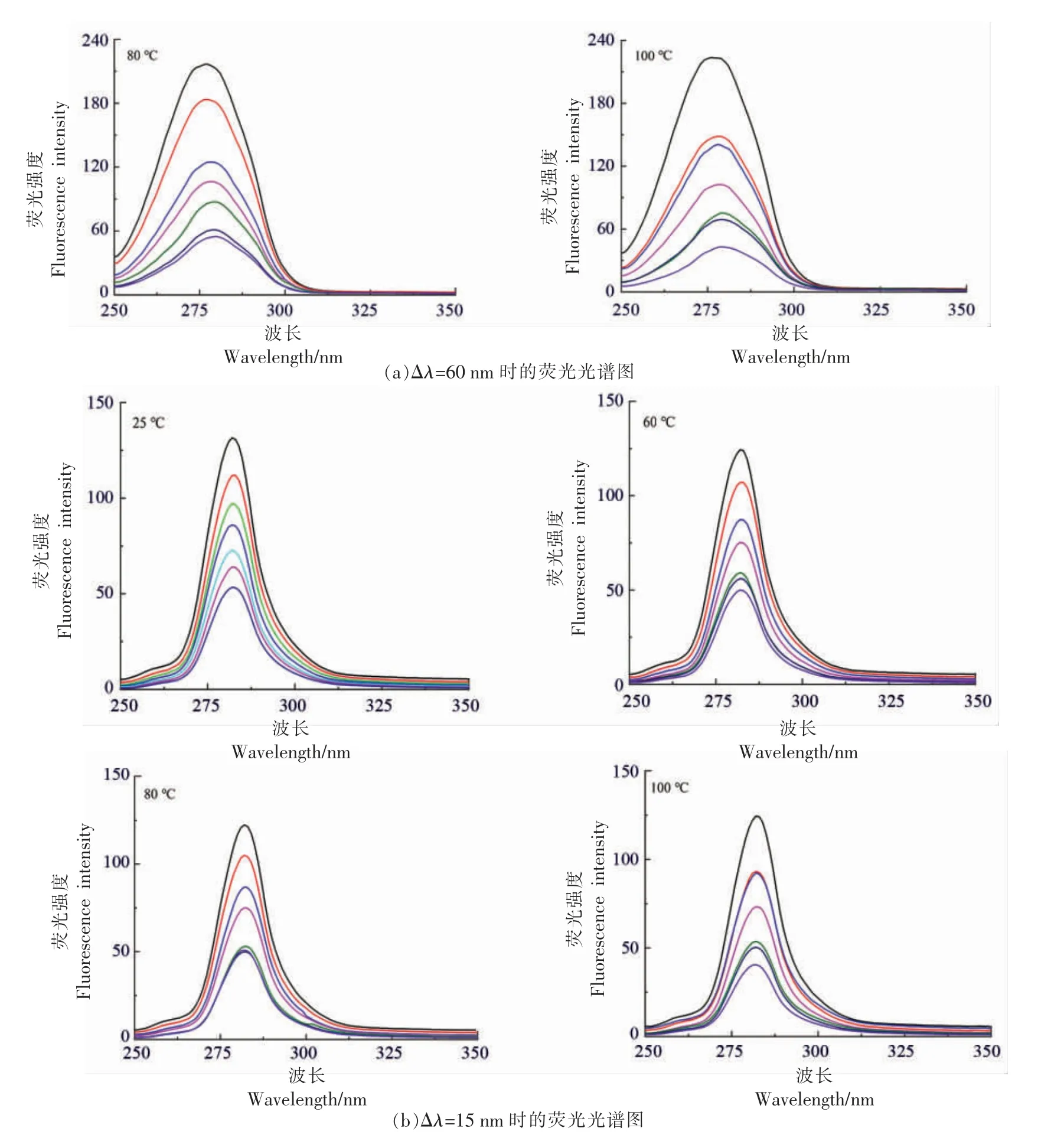
图1 不同温度下麦醇溶蛋白/芦丁相互作用的同步荧光光谱图Fig.1 The synchronous fluorescence spectroscopy of gliadin-rutin after thermal processings
2.3 紫外扫描光谱
蛋白质的结构及化学变化可通过紫外光谱表征。为了进一步探究麦醇溶蛋白和芦丁间的相互作用,紫外-可见光谱法利用从基态到激发态的电子跃迁的特点对吸收光谱进行了监测[20]。吸收峰出现在207 nm 及270 nm 左右的波长处,分别表示多肽骨架结构C=O 和氨基酸残基的吸收[21]。如图2 所示,未经热处理的麦醇溶蛋白溶液中,在270 nm 附近有一个最大特征吸收峰,对应于色氨酸(Trp)(285 nm)和酪氨酸(Tyr)(277 nm)氨基酸残基的振动。与芦丁复合后,G 的吸收峰明显增加,归因于这两个组分之间共价共轭复合物的形成[22]。同样地,热处理条件下制备的G-R 溶液表现出明显高于单一蛋白质溶液的紫外-可见吸收强度,这归因于两种组分之间形成了共价结合物[22]。热诱导后,麦醇溶蛋白组峰强度相对于未经热处理组有所下降(见图2),这可能是G 结构出现聚集,发色基团被包裹,从而使紫外光吸收基团减少。由麦醇溶蛋白与芦丁复合物的紫外吸收可知,热处理同样导致吸收峰强度降低,而处理温度为80 ℃和100 ℃时,该处的峰强度相较于60 ℃处理组有所上升,归因于G 结构舒展,发色基团向外翻转,Trp 和Tyr 残基暴露。在所有样品中,峰的位置稍有变化,证实G 氨基酸残基的微环境发生改变。上述结果表明,温度变化影响麦醇溶蛋白内氨基酸残基的结构和微环境,从而进一步影响它们与芦丁的相互作用。

图2 热诱导后麦醇溶蛋白/芦丁复合物的紫外光谱图Fig.2 The ultraviolet-visible spectroscopy of gliadin-rutin after thermal processings
2.4 侧链氨基酸分析
用拉曼光谱仪对结构进行分析,通过吸收峰的位置和强度可以表征氨基酸侧链的构象[23]。760 cm-1处的谱带起源于色氨酸残基中蒽环的振动,可以表征Trp 的微环境,而760 cm-1(I760)处谱带的强度反映氢键强度和Trp 的暴露程度。I760的下降表明Trp 残基处于疏水微环境中,它们对形成更无序的结构有贡献,而增加值表明Trp 参与亲水环境的氢键[24]。如表2 所示,加热温度为80 ℃时,G-R 复合物的I760达到最大值0.93,这是由于蛋白质结构展开导致Trp 暴露在更亲水的环境中。当继续加热时,G-R 复合物I760的减少归因于麦醇溶蛋白在95 ℃处的聚合,将Trp 埋在一个更疏水的微环境中。25 ℃时,与原麦醇溶蛋白相比,芦丁的加入使I760减小(0.34),表明Trp 残基处于疏水微环境中,这与荧光光谱的结果一致。
850 cm-1和830 cm-1处的酪氨酸(Tyr)双峰提供了Tyr 残基中酚羟基的氢键信息。当850 cm-1处的谱带强度高于830 cm-1处时,Tyr 暴露在分子表面,酚羟基作为弱氢键的供体或受体,I850/I830值在1.25 左右。如酚羟基作为强氢键受体,I850/I830值为2.50。当850 cm-1处的带强低于830 cm-1处时,Tyr 残基被埋在参与分子间和分子内相互作用的分子内[25]。如表2 所示,麦醇溶蛋白I850/I830值为1.06,表明原麦醇溶蛋白酪氨酸暴露在分子表面,形成弱氢键。Tyr 作为疏水氨基酸,存在于分子表面,使得疏水性更强。热处理后,I850/I830值均呈现减小的趋势,表明热处理使暴露的氨基酸减小,其中60 ℃和80 ℃处理的麦醇溶蛋白以及100 ℃处理的G-R 复合物中的酪氨酸处于包埋状态,参与蛋白聚合过程中分子内或分子间氢键的形成。
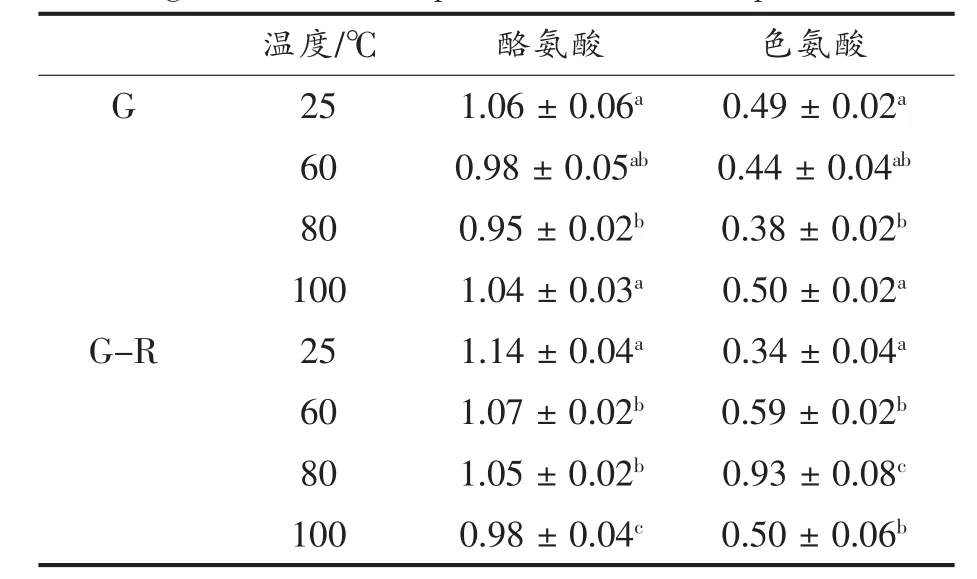
表2 不同温度下麦醇溶蛋白与芦丁复合物的酪氨酸色氨酸微环境Table 2 Tyrosine tryptophan microenvironment of gliadin-rutin complex at different temperatures
2.5 二硫键构象分析
二硫键(S-S)是蛋白质维持三级结构的关键。蛋白构象的变化可以通过测定二硫键拉伸振动来评估。S-S 键的对称伸缩振动受S-S 桥中C 原子构象的影响[26]。根据C-S-S-C 原子结构的不同,490~550 cm-1区域由以下构象组成:旁-旁-旁式(gauche-gauche-gauche,g-g-g)(500~510 cm-1),旁-旁-反式(guache-gauche-trans,g-g-t)(515~525 cm-1)和反-旁-反式(trans-gauche-tran,t-gt)(535~545 cm-1)[27]。g-g-g 构象被认为能量最为稳定。由图3 可知,麦醇溶蛋白的二硫键构象gg-g、g-g-t、t-g-t 占比分别为12.06%,74.68%,13.26%,g-g-t 构象占主要比例。与芦丁复合后,G的g-g-g 构象有所增加(12.06%→22.90%),表明其稳定性提高。热诱导处理后,G-R 复合物的gg-t、t-g-t 含量减少和g-g-g 构象增加,表明麦醇溶蛋白在热诱导后形成更稳定的S-S 键构象,这可以解释为异常蛋白质折叠和亚基聚集过程中出现的多肽链位移[28]。

图3 不同温度下麦醇溶蛋白与芦丁复合物的二硫键构象Fig.3 Disulfide bond conformation of gliadin rutin complex at different temperatures
2.6 热稳定性分析
DSC 以测量分子热变性的变化来表征蛋白质的稳定性。热图4 显示广泛的吸热转变。与芦丁复合后,麦醇溶蛋白的峰值温度从63.31 ℃升到64.23 ℃。峰值温度的升高可能与芦丁通过不同的键与麦醇溶蛋白连接有关,比如氢键和范德华力[29]。在芦丁与麦醇溶蛋白结合的情况下,麦醇溶蛋白的结构更加致密。以上结论表明芦丁可增强麦醇溶蛋白的稳定性。相较于未经热处理的样品,热处理的麦醇溶蛋白(60,80,100 ℃处理后分别降至61.21,61.52,61.78 ℃)以及麦醇溶蛋白-芦丁复合物(60,80,100 ℃处理后分别降至63.11,62.05,63.13 ℃)的变性温度均有所降低,可能的原因是热处理破坏了有利于G 的化学键及相互作用力,导致G 的结构展开,致热稳定性降低[30]。不同的加热温度对复合物的变性温度无显著影响。

图4 热诱导后麦醇溶蛋白与芦丁复合物的差示扫描量热谱图Fig.4 Differential scanning calorimetry of wheat gliadin rutin complex at different temperatures
2.7 乳化活性和乳化稳定性分析
蛋白质吸附到油-水界面的能力可用乳化性表征。乳化性能可用乳化活性指数(EAI)及乳化稳定性指数(ESI)评价。EAI 表示每单位质量蛋白质稳定的界面面积,而ESI 用于衡量乳状液浊度[31]。由表3 可知,经不同温度处理,G-R 复合物的乳化活性提高1.96%(60 ℃),20.59%(80 ℃)。热诱导后,G 结构展开,疏水残基在G 表面聚集,有利于O/W 界面的生成,G 乳化力增强。随着处理温度的增加(100 ℃),暴露出的疏水残基增多,在G 分子间形成新的非共价键,使G 分子聚集(这与粒径测定的结果一致),O/W 界面的稳定性下降,G 乳化能力变低。乳化稳定性变化趋势与乳化活性一致,复合物稳定性经热诱导后,提高了13.80%(60℃),27.49%(80 ℃),这可能归因于经热诱导,G 结构部分展开,疏水基团暴露,油滴表面的蛋白存在疏水相互作用,界面膜的强度得到增强,油滴间难以聚结[32],从而ESI 增加。
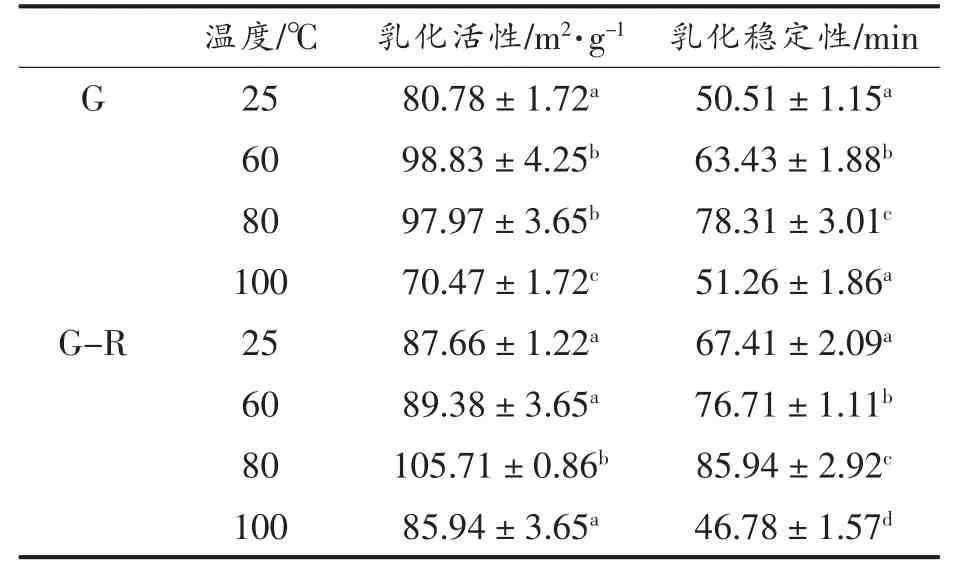
表3 不同温度下麦醇溶蛋白与芦丁复合物的乳化活性与乳化稳定性Table 3 Emulsifying activity and emulsifying stability of gliadin-rutin complex at different temperatures
3 结论
通过反溶剂法制备G-R 复合物,然后做热诱导处理,对G 及G-R 复合物的结构产生影响。热处理导致热聚集,芦丁的加入使颗粒粒径有所减小。温度的变化影响麦醇溶蛋白内氨基酸残基的结构和微环境,从而进一步影响它们与芦丁的相互作用。热处理使G 的酪氨酸趋于埋藏在G 内部结构,热诱导条件下与芦丁形成复合物后,麦醇溶蛋白的g-g-t 构象趋于减小,向g-g-g 与t-g-t 构象转变。芦丁可增强麦醇溶蛋白的热稳定性,而热处理削弱了蛋白热稳定性。80 ℃处理后复合物乳液乳化性与乳化稳定性最高。
