光谱法和分子对接研究高儿茶酚与牛血清白蛋白的相互作用
2023-01-12吕艳芳张紫卿梁倩倩李营刘欣欣李学鹏
吕艳芳,张紫卿,梁倩倩,李营,刘欣欣,李学鹏*
(1 渤海大学食品科学与工程学院 辽宁锦州121013 2 上海交通大学农业与生物学院 上海 200240)
高儿茶酚(Homocatechol),又称3,4-二羟基甲苯,化学式为C7H8O2,是一种芳香族衍生物,槲皮素代谢的产物,可通过还原木质素衍生的香草醛,然后脱甲基来制备[1-2],结构见图1。其用途大致可分为3 类:第1 类,可作为中间体制造苹果型香料、农药、染料等[3];第2 类,可用于杀菌防腐[3];第3 类,可用于医药领域制备具有医药活性的化合物,并且该物质在抗氧化方面有良好的应用[4-5]。Applová 等[6]在研究中发现高儿茶酚能有效抑制血小板聚集,甚至比临床上使用的抗血小板药物阿司匹林疗效更好。Hsiao 等[7]通过小鼠实验发现高儿茶酚能够缩短热阵痛时间,刺激多种神经营养素,促进皮肤神经再生。Fukuhara 等[8]通过给大鼠侧脑室静脉注射高儿茶酚,发现能够预防大鼠的慢性疼痛并产生抗抑郁作用。刘春丽等[9]和肖卓炳等[10]通过研究荔枝果肉和猕猴桃变软与其多酚氧化酶的关系时,发现在多种底物中,高儿茶酚与其多酚氧化酶能较好地结合。

图1 高儿茶酚的3D(a)和2D(b)结构图Fig.1 3D(a)and 2D(b)structures of homocatechol
蛋白质是生物体最重要的大分子之一,是一切生命活动的物质基础。若小分子参与生物代谢或者可以改变生物大分子的某种理化性质,则研究二者间的相互作用,揭示其作用机理很有意义。牛血清白蛋白(BSA)分子质量为66.4 ku,是一种球状心形蛋白[11-12]。因其与人血清白蛋白是同源蛋白[13-14],故可广泛用于蛋白质与小分子互作的研究。姚惠芳等[15]、孙艳辉等[16]运用光谱法研究笃斯越橘花青素和绿原酸与BSA 的互作,结果发现,笃斯越橘花青素主要依靠静电作用力,绿原酸主要依靠疏水作用力与BSA 发生作用,其猝灭类型均为静态猝灭。
本文从热力学角度研究高儿茶酚与BSA 的结合作用。研究二者结合后BSA 的三维结构和微观形态的变化。利用分子对接技术分析二者的结合位点,旨在为高儿茶酚的应用提供参考。
1 材料与方法
1.1 材料与试剂
BSA(≥98%),北京中生瑞泰科技有限公司;高儿茶酚(≥99%),上海阿拉丁生化科技股份有限公司;磷酸氢二钠、磷酸二氢钾(分析纯),上海国药集团化学试剂有限公司。
1.2 仪器与设备
紫外-可见分光光度计(UV2550),日本岛津;荧光分光光度计(970CRT),上海棱光公司;冷场发射扫描电镜(S-4800),日本日立公司;电热恒温水浴锅(DK8D),上海一恒科技有限公司。
1.3 试验方法
1.3.1 紫外光谱法测定高儿茶酚与BSA 的相互作用 在7 支试管中分别加入2.5 mg/mL,BSA 溶液0.5 mL,接着加入2×103μmol/L 高儿茶酚溶液(0,0.05,0.10,0.15,0.20,0.25,0.30 mL),最后用PBS 缓冲液(pH 7.4)定容5 mL,使BSA 终质量浓度为0.25 mg/mL,高儿茶酚的终浓度分别为0,20,40,60,80,100 μmol/L 和120 μmol/L。混匀后 于298 K 下静置10 min。紫外光谱扫描范围200~600 nm。
1.3.2 荧光光谱法测定高儿茶酚与BSA 的相互作用 取24 支试管,分为3 组,每组8 支。按1.3.1节的方法配制溶液,使BSA 终质量浓度为0.25 mg/mL,高儿茶酚的终浓度分别为0,20,40,60,80,100,120 μmol/L 和140 μmol/L。将混合后的3组样品分别置298,310 K 和320 K 恒温水浴中10 min。荧光检测条件:激发波长281 nm,扫描范围280~450 nm,狭缝宽度均为5 nm。
1.3.3 荧光猝灭与热力学计算公式 在1.3.2 节基础上,通过Stern-Volmer 方程(1)对荧光数据进行计算,分析其猝灭类型[17]。通过公式(2)计算其结合常数Ka和结合位点数n[18]。根据方程(3)、(4)计算高儿茶酚与BSA 互作的热力学参数[19]。
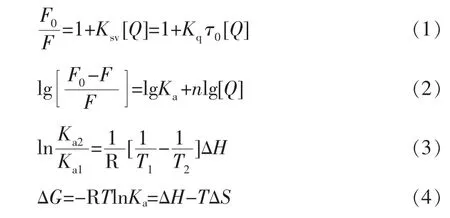
式中:F0和F——加入高儿茶酚前、后BSA的荧光强度;Ksv——动态猝灭常数;Kq——猝灭速率常数;τ0——猝灭剂不存在时生物大分子的平均寿命(10-8s);Ka1和Ka2——分别为T1、T2温度下的结合常数;R——气体常数(8.314×10-3kJ/mol)[20]。
1.3.4 同步荧光法测定高儿茶酚与BSA 的相互作用 方法同1.3.1 节。荧光光谱扫描条件:激发波长281 nm,扫描范围200~400 nm,Δλ 分别为15 nm 和60 nm,狭缝宽度均为1 nm。
1.3.5 高儿茶酚对BSA 形态的影响 在3 支试管中分别加入0.25 mg/mL BSA 溶液0.5 mL,接着加 入2×102μmol/L 高儿茶酚溶液(0,0.05,0.10 mL),用去离子水定容5 mL,使BSA 终质量浓度为0.025 mg/mL,高儿茶酚的终浓度分别为0,2,4 μmol/L。混合溶液于298 K 下静置10 min,在培养皿中放入导电硅片,吸取10 μL 样品溶液平铺在硅片上,放入35 ℃烘箱中直至样品完全干燥。将样品粘贴在样品台上,喷金后扫描电镜观察。
1.3.6 分子对接研究高儿茶酚与BSA 的结合 BSA的晶体结构(ID:4F5S)从PDB 数据库中获得,利用PyMol 软件对晶体结构进行前处理。配体高儿茶酚的2D 结构由Chem Draw 软件绘制,通过Chem3D 软件对其优化,将能量优化后的配体保存为PDB 格式文件,然后利用Auto Dock-vina 软件进行分子对接,最后用Discovery Studio(简称DS)、PyMol 软件作图,查看对接结果。
2 结果与分析
2.1 高儿茶酚与BSA 相互作用的紫外吸收光谱分析
从图2a 可以看出高儿茶酚的最大吸收波长(λmax)在279 nm 处,随着高儿茶酚浓度的增加,它的吸光值由0.032 增至0.357,而其吸收波长没有发生改变。从图2b 可以看出,当不添加高儿茶酚时,BSA 在277 nm 处有一个由BSA 的色氨酸(Trp)与酪氨酸(Tyr)残基的芳杂环π-π*跃迁引起的吸收峰[21]。加入高儿茶酚后,当其浓度为20~80 μmol/L 时,BSA 的吸光值由0.125 增至0.333,且波长从277 nm 红移至279 nm,说明高儿茶酚与BSA 形成了复合物,在这个过程中BSA 结构内部的Trp 与Tyr 残基暴露在蛋白质结构表面,使BSA 的疏水性增强,空间构象发生改变[22-23]。当高儿茶酚浓度超过80 μmol/L 时,BSA 的吸光值增加,其波长仍保持不变,说明二者结合较好,复合物的结构趋于稳定,二者之间发生相互作用[24]。
2.2 高儿茶酚与BSA 相互作用的热力学分析
2.2.1 高儿茶酚与BSA 相互作用的荧光光谱分析 通常蛋白质的荧光是由色氨酸(Trp)、酪氨酸(Tyr)和苯丙氨酸残基(Phe)引起的[25]。由图3 可知,当BSA 质量浓度为0.25 mg/mL 时,3 种温度下,不添加高儿茶酚的BSA 分别在347,349 nm和345 nm 处有一个强荧光发射峰。添加高儿茶酚后,3 个温度下BSA 的荧光强度随高儿茶酚浓度的增加均呈下降趋势。当温度为298 K 和310 K时,最大发射波长出现蓝移的现象;温度为320 K时,最大发射波长先红移后蓝移,这说明高儿茶酚与BSA 发生了相互作用[26],且BSA 的峰形和强度没有发生明显变化,表明高儿茶酚的加入没有破坏发色团[27],仅使蛋白质周围的微环境发生改变,内源荧光发生猝灭,蛋白质的疏水性增强。
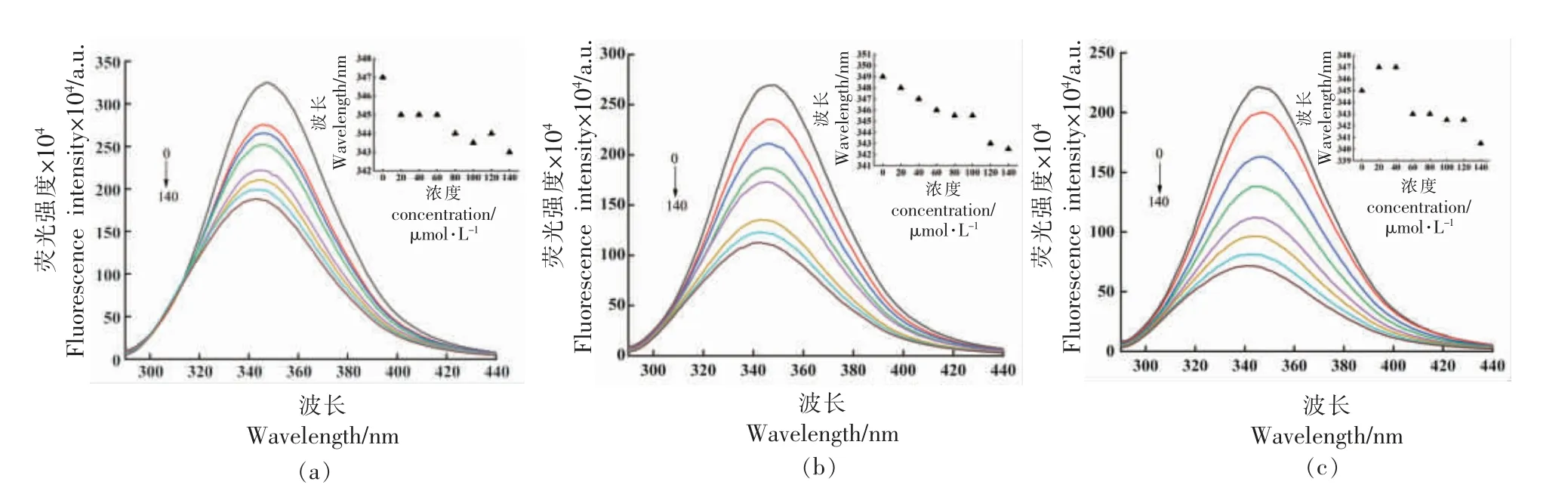
图3 298(a)、310(b)和320 K(c)时不同浓度的高儿茶酚与BSA 相互作用的荧光光谱Fig.3 Fluorescence spectra of the interaction between BSA and homocatechol of different concentrations at 298(a),310 K(b)and 320 K(c)
2.2.2 高儿茶酚对BSA 的猝灭类型的判定 动态猝灭的猝灭常数(Ksv)随着温度的上升而增大,静态猝灭反之[28-30]。3 个温度下,[Q]与F0/F 拟合出来的曲线线性关系良好(图4)。由表1 可知,随着温度的升高,Ksv由4.80×103L/mol 增至1.663×104L/mol,推测高儿茶酚对BSA 的荧光猝灭过程是动态猝灭;又因其Kq值由0.480×1012L/(mol·s)增至1.663×1012L/(mol·s),大于各类猝灭剂对生物大分子的最大碰撞猝灭速率常数阈值(2.0×1010L/(mol·s))[31]。这表明二者在结合的过程中也存在静态猝灭。
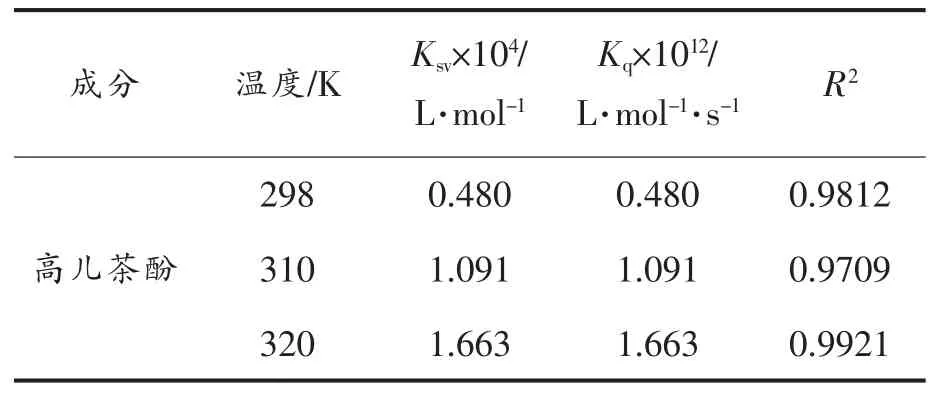
表1 不同温度条件下高儿茶酚与BSA相互作用的猝灭常数Table 1 Sterne-Volmer quenching constants of the interaction between homocatechol and BSA at different temperatures
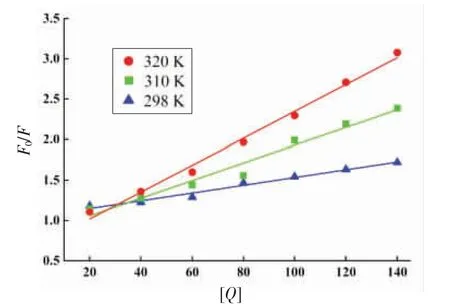
图4 298,310 K 和320 K 时高儿茶酚和BSA相互作用的Stern-Volmer 拟合图Fig.4 Sterne-Volmer plot of the interaction between homocatechol and BSA at 298,310 K and 320 K
2.2.3 高儿茶酚与BSA 作用的结合位点与结合常数 在2.2.2 节分析中发现,二者结合过程中存在静态猝灭。根据公式(2),以lg[(F0-F)/F]为纵坐标,lg[Q]为横坐标绘制双对数图(图5),对它们的结合方式进行分析。由表2 可知,随着温度的升高,高儿茶酚与BSA 之间的Ka值不断增大,尤其是当温度为320 K 时,Ka达到1.535×106L/mol,远大于5.908×102L/mol,说明高儿茶酚能与BSA 形成复合物,且温度升高显著提高了复合物的稳定性,进一步证明高儿茶酚对BSA 的猝灭以动态猝灭为主[32-33]。在298,310 K 和320 K 时,结合位点数分别为0.763,1.197 和1.518 接近于1,说明二者之间至少存在1 个结合位点。从数值上看,结合位点数有增大的趋势,均未超过2,推测随着温度的升高,二者的结合位点可能会超过一个[34]。综上所述,高儿茶酚对BSA 的猝灭可能是以动态猝灭为主,也有静态猝灭的过程。
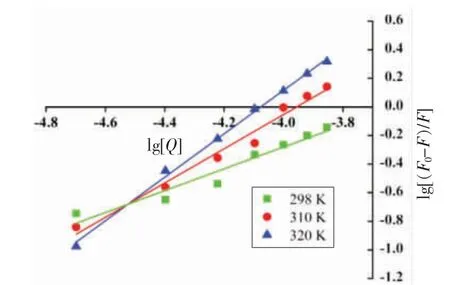
图5 298,310 K 和320 K 时高儿茶酚与BSA相互作用的双对数图Fig.5 Double logarithmic plot of the interaction between homocatechol and BSA at 298,310 K and 320 K

表2 298,310 K 和320 K 高儿茶酚和BSA相互作用的结合常数与结合位点数Table 2 Binding constants and number of binding sites of interaction between homocatechol and BSA at 298,310 K and 320 K
2.2.4 高儿茶酚与BSA 的热力学参数和作用力类型 由表3 可知,3 个温度下的吉布斯自由能(ΔG)均为负数,表明高儿茶酚与BSA 之间的结合反应是自发进行的;熵变(ΔS)和焓变值(ΔH)分别为1 002.567 J/(mol·K)和282.779 kJ/mol,均大于0,说明二者在结合过程中熵增明显,属于吸热反应,且温度升高有助于增加复合物的稳定性,疏水作用力是该反应的主要驱动力[35-37]。这与杨荣荣等[38]研究的槲皮素与BSA 结合的作用力类型,俞波等[39]研究酒石酸美托洛尔与BSA 的相互作用力类型相同。

表3 高儿茶酚和BSA 相互作用的热力学参数Table 3 Thermodynamic parameters of the interaction between homocatechol and BSA
2.3 高儿茶酚与BSA 相互作用的同步荧光光谱分析
同步荧光光谱中Δλ 为15 nm 和60 nm 时,分别反映蛋白质中酪氨酸(Tyr)和色氨酸(Trp)残基的光谱特征,它们的最大荧光发射波长与周围环境的极性有关[40]。从图6a、6b 可以看出,当不加入高儿茶酚时,BSA 的Tyr 和Trp 残基的最大发射波长分别在303 nm 和346 nm 处;随着加入的高儿茶酚浓度的增大,Tyr 与Trp 残基的荧光峰分别红移了1 nm 和3 nm;Tyr 残基的荧光强度出现先增加后下降的趋势;Trp 残基的荧光强度则呈现出下降趋势,其峰形均无明显变化,这表明高儿茶酚的加入不仅引起Tyr 与Trp 残基周围的微环境发生改变,还会降低其疏水性,使肽键的伸展程度有所增加。由2.2.3 节可知,高儿茶酚与BSA 之间至少存在一个结合位点,从Tyr 与Trp 残基荧光峰的红移程度来看,推测出高儿茶酚结合在BSA 的Trp 残基附近。

图6 高儿茶酚与BSA 相互作用的同步荧光光谱:Δλ=15 nm(a);Δλ=60 nm(b)Fig.6 Synchronous fluorescence spectra of the interaction between homocatechol and BSA:Δλ=15 nm(a)and Δλ=60 nm(b)
2.4 BSA 与高儿茶酚相互作用前、后微观形态变化
从图7a 可以看出不添加高儿茶酚时,BSA 呈近似正方体,分布均匀,存在蛋白颗粒聚集现象。图7b(2 μmol/L)与图7a 比较,添加高儿茶酚后,BSA 的聚集现象减少了,说明高儿茶酚的加入,促进了BSA 在溶液中的溶解,因此图7b 中蛋白质颗粒比较分散。当高儿茶酚浓度继续增加时,蛋白质颗粒开始聚集,如图7c(4 μmol/L)所示。从这个结果推测,高儿茶酚浓度在一定范围,可能会促进蛋白质的溶解;当高儿茶酚浓度高于2 μmol/L 时,使蛋白质发生聚集。

图7 高儿茶酚与BSA 相互作用的扫描电镜图(×20.0 K)Fig.7 Scanning electronic microscopy images of interaction between homocatechol and BSA(×20.0 K)
2.5 高儿茶酚与BSA 相互作用的分子对接分析
分子对接结果表明,结合能量越低,大分子与小分子之间结合越紧密[41]。根据表4 可知,第3 种模型的结合能为-5.0 kcal/mol,有4 个疏水键和2个氢键,表明高儿茶酚与BSA 能够紧密结合。王晓霞等[42]研究了盐酸四环素与BSA 相互作用,其结合位点在亚结构域IIA(siteⅠ)。另外,小分子与BSA 的结合位点通常存在于亚结构域ⅡA 和ⅢA的子域中,即位点siteⅠ与siteⅡ[43]。由图8a 可知,高儿茶酚结合在BSA 亚结构域IIA 的疏水腔中(位点siteⅠ);从图8b、8c 可以看出,高儿茶酚与BSA 结合后,形成的化学键主要是疏水键,这一结论与热力学实验结论一致。高儿茶酚通过疏水相互作用与BSA中的Ala209、Ala212、Leu346 和Leu480 结合,键长分别为4.20,5.28,4.27 Å 和5.32 Å。从图8c 还可看出,高儿茶酚与BSA 结合的过程中还形成两个常规氢键(O···H-X),一个是Lys350 的羧基氧与高儿茶酚羟基的氢形成的,键长为4.41 Å;另一个是与Glu353 羧基氧形成的,键长为5.06 Å,这些氢键在维持蛋白质结构中起重要的作用。以范德华力结合作用的氨基酸残基有Val481、Leu330、Ala349、Arg208、Leu326,虽然范德华力是一种较弱的作用力,但是对维持复合物空间结构的稳定性起到支持作用。高儿茶酚被氨基酸残基形成的疏水口袋包围着,结合在Trp213 附近(图8c),通过疏水作用力与BSA 相互结合形成复合物,进一步说明高儿茶酚能够猝灭BSA 的内源荧光,该结果与荧光光谱试验结论相同。
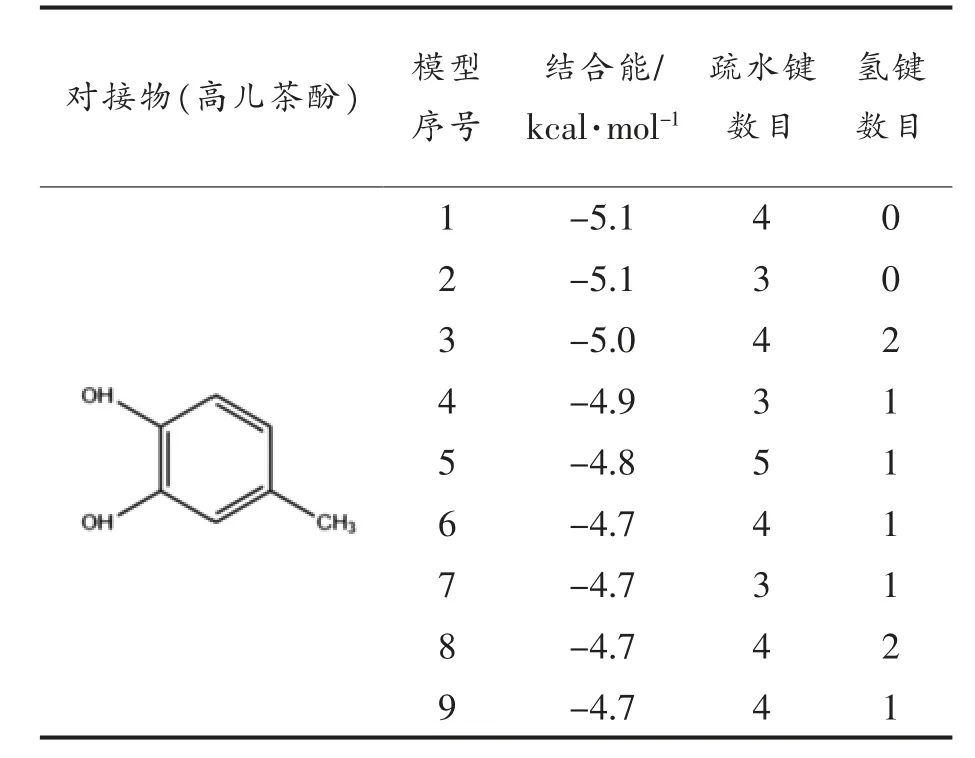
表4 高儿茶酚和BSA 相互作用主要对接结果Table 4 Main docking results of interaction between homocatechol and BSA
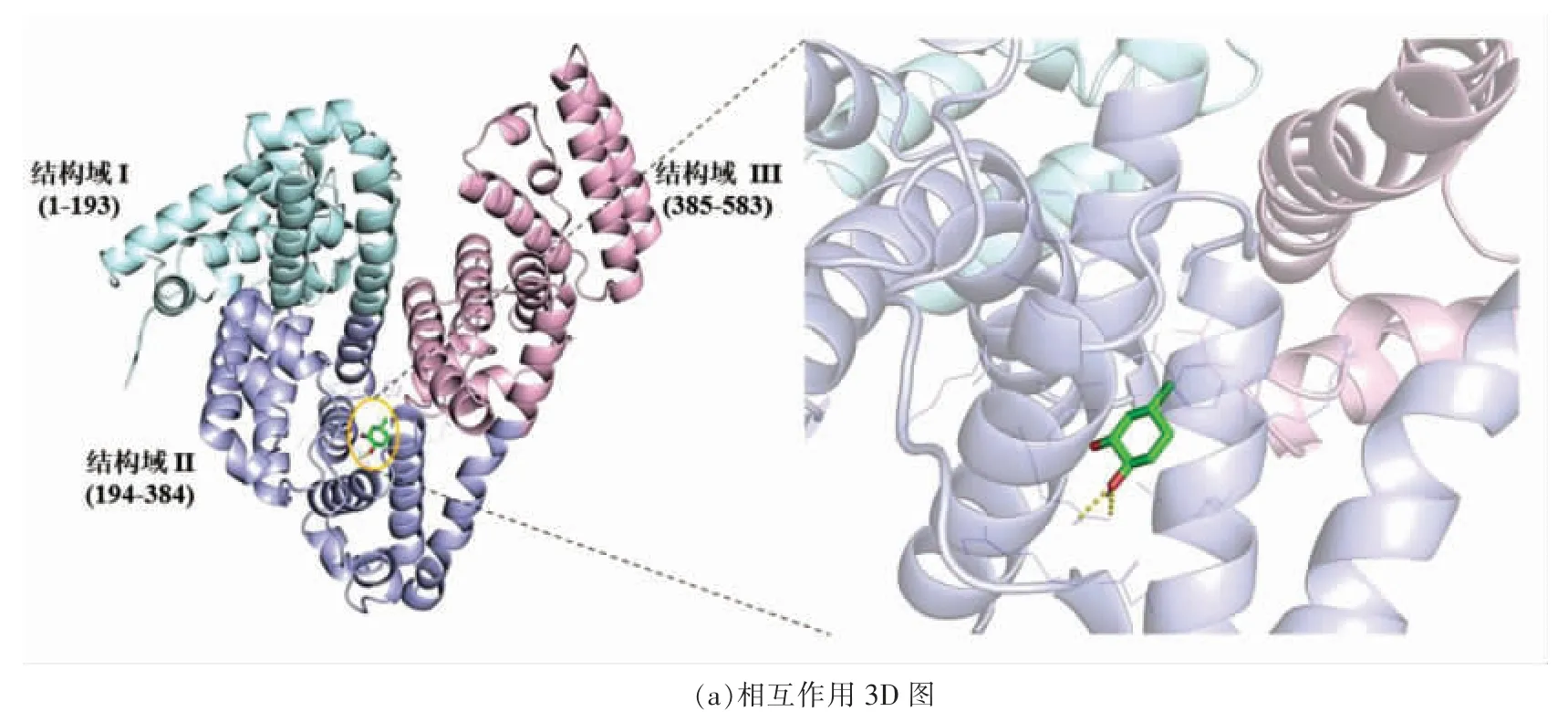
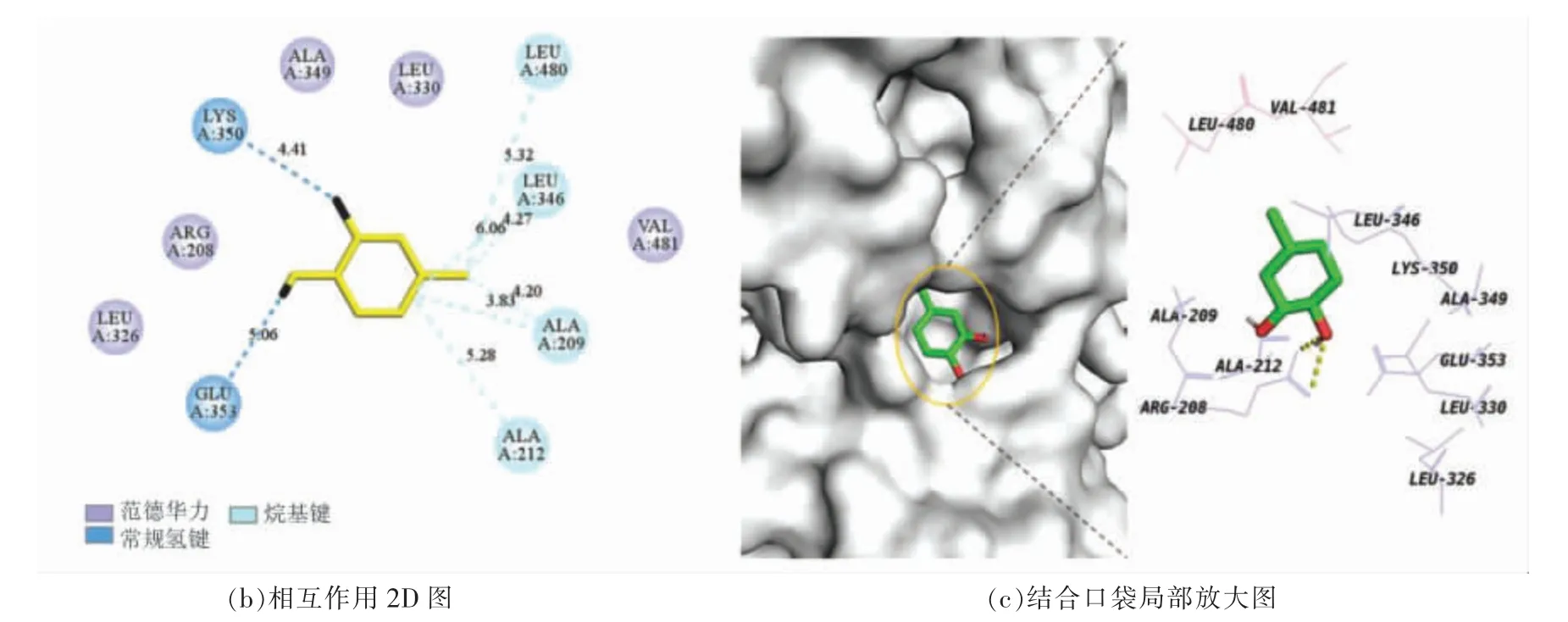
图8 高儿茶酚与BSA 相互作用的分子对接图Fig.8 Molecular docking diagram of interaction between homocatechol and BSA
3 结论
本研究发现,高儿茶酚对BSA 的猝灭过程是以动态猝灭为主,也存在静态猝灭。根据热力学参数计算得出,ΔS、ΔH 为正值,ΔG 为负值,推测高儿茶酚与BSA 形成的复合物主要以疏水作用力来维持稳定,二者结合过程是自发进行的。结合位点数n 接近于1,且随着温度的升高不断增大,这说明高儿茶酚在BSA 上至少存在一个结合位点。2 μmol/L 的高儿茶酚能够促进蛋白的溶解,而当高儿茶酚浓度高于2 μmol/L 时,部分蛋白又重新发生聚集。从分子对接结果看,高儿茶酚在BSA的疏水性口袋结构内部存在一个结合位(siteⅠ),距离Trp213 很近。结合光谱试验结果,加入高儿茶酚改变了BSA 的Tyr 和Trp 残基周围的微环境,最终猝灭Tyr 和Trp 残基的内源荧光。
