细胞培养肉支架材料与组织成型研究进展
2023-01-12刘东红利婕牛瑞浩忻启谱朱青青徐恩波
刘东红,利婕,牛瑞浩,忻启谱,朱青青,徐恩波
(1 浙江大学生物系统工程与食品科学学院 杭州310058 2 浙江大学 智能食品加工技术与装备国家地方联合工程实验室 杭州310058 3 浙江大学 长三角智慧绿洲创新中心 浙江嘉兴314102 4 浙江大学 南方果蔬保鲜技术集成科研基地 杭州310058 5 浙江大学馥莉食品研究院 杭州 310058)
全球肉类消费需求量增长与肉制品生产力限制的不平衡问题日益凸显。据联合国粮农组织(FAO)预测,到2050 年,全球肉类需求将达到4.55 亿t;对比2018—2020 年,未来10 年全球肉类蛋白质消费量将增长14%[1]。现有肉类生产供应链存在诸多隐患,如人畜共患病(如尼帕病毒、甲型流感)扩大风险,COVID-19 疫情爆发影响肉类加工厂等[2]。此外,畜牧业产生的甲烷(动物肠道和粪便发酵)和一氧化二氮是最主要的温室气体,前者对全球变暖的影响比二氧化碳高28 倍[3]。而到2025 年,世界人口预计超过90 亿,这意味着食物、水、耕地需求将持续过载[4]。与动物肉相比,细胞培养肉有助于人类在解决饥饿问题的同时,保护水源、土地和能源。因此,细胞培养肉作为替代蛋白来源之一,被赋予解决当前肉业生产效能不足以及公共卫生、环境退化和动物福利等诸多社会问题的新使命。
细胞培养肉也称人造肉,是一种通过组织工程技术生产的仿真模拟肉类,最初依赖于医学领域干细胞生物学和组织工程学基础(如诱导性多能干细胞、体外骨骼肌移植等),并通过交叉技术迭代实现可食用肉类组织的细胞培养发展。细胞培养肉的历史可追溯到1999 年,被誉为“细胞培养肉教父”的威廉·范·埃伦(Willem van Eelen)申请了第1 项细胞培养肉专利。2013 年,马斯特里赫特大学的Mark 教授展示了首个培养肉汉堡,85 g 造价却高达330 000 美元[5]。之后,细胞培养肉产业开始蓬勃发展,其生产流程也逐渐明确并主要涉及4 个部分:1)肌肉、脂肪细胞(或内皮细胞)的分离和培养;2)增殖和分化培养基配方的研制;3)支架材料的筛选和优化;4)组织化成型方式的设计。如今,越来越多商业公司为畜禽肉类(如猪肉、牛肉、鸡肉等)和海洋食品的肉类替代物提供了开发方案,学术界也对此迸发出强烈的研究热情,致力于高密度、批量化以及营养全面、质构风味近似的培养肉科学基础研究。
然而,我国细胞培养肉研发仍处于起步阶段,有不少重大技术挑战尚未解决,如高传代及永生化细胞系建立、多阶段生长培养基优化、高通量生物反应器设计、仿生细胞支架构建等技术[6]。其中,培养肉细胞支架旨在支持自然组织中细胞结构和功能的细胞外基质(ECM)的结构模拟,在一定程度上模仿其生化特征,并促进其形成具有肉类力学特性组织[7]。细胞培养肉支架技术更新发展迅速,各种新型的组织成型方法不断涌现。本文介绍培养肉三维培养的各种支架材料及细胞感知机制,探讨细胞肉组织成型的最新技术及所面临的挑战,为培养肉的支架选择和组织成型技术提供科学参考。
1 细胞感知与三维培养
1.1 三维培养细胞的力学感知
细胞体外三维培养(3D culture)是组织工程和类器官制造的基础,也是细胞培养肉形成具有一定力学性质的支撑性结构的关键,其体外三维培养模型中细胞的生长环境更加接近真实组织内的微环境。在传统二维培养(2D)过程中,单层细胞一般在平坦的固体表面生长,然而,细胞的接触抑制行为,很难在孔板平面上形成复杂的组织结构,并且二维平面的硬度大于胞外基质硬度,贴壁后的细胞被过度拉伸后会导致细胞基因与蛋白质的异常表达,使其形态差别于组织中真实细胞形态[8]。三维培养时细胞支架充当了体内细胞外基质的角色,其首要作用是为三维空间中的细胞黏附提供一定的力学支撑,从而促进三维组织的形成。
三维环境中细胞感知支架强度,进而着床并分化为不同组织的过程被称为 “机械转导机制”(如图1 所示)[9]。机械转导机制能够使细胞感知机械刺激并作出反应,从而调整胞内成分以满足不同胞外微环境硬度需求。细胞外基质蛋白与细胞膜上的特异性序列结合,进而与细胞核建立物理连接,并启动从细胞骨架到细胞核的机械转导信号。细胞膜表面机械受体即整联蛋白[10],通过ECM中常见的RDG 序列(由精氨酸、甘氨酸和天冬氨组合而成)[11]来感知ECM 硬度(压/拉伸应力诱导的ECM 形变)和流体流动(间质流体的剪切应力)的变化。为了平衡膜黏附蛋白与微丝、微管之间的错位力,细胞激活肌动球蛋白介导的收缩并重新排列细胞骨架。在机械转导过程中,细胞骨架网络充当“桥梁”的作用,将细胞-胞外基质界面产生的机械张力传导到细胞核。
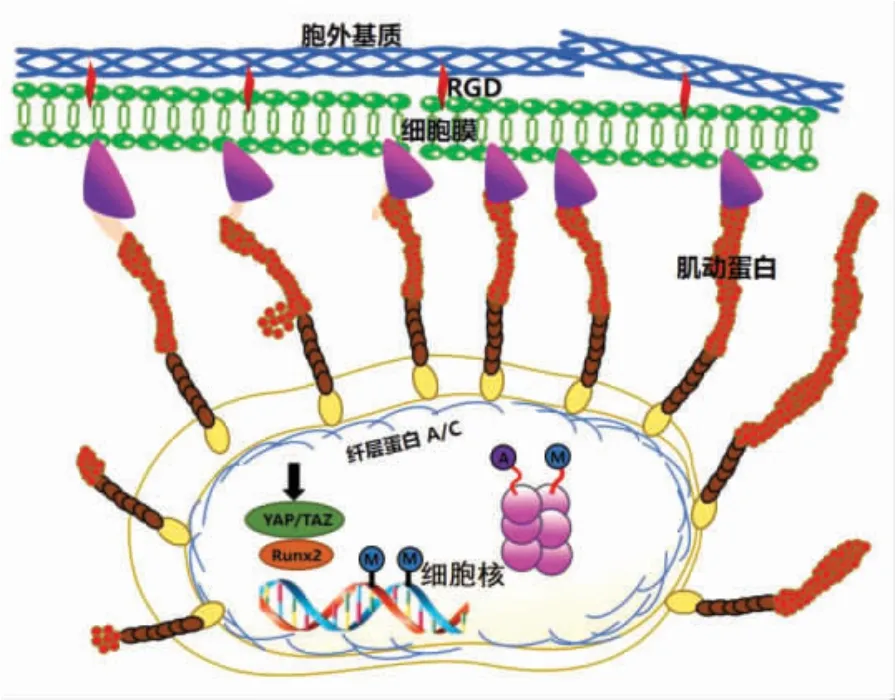
图1 细胞中的机械转导机制示意图[9]Fig.1 Schematic representation of mechanotransduction mechanisms in cells[9]
1.2 支架结构与细胞行为
细胞支架除为细胞黏附提供一定的力学支撑外,还为细胞提供足够的生长空间以及物质交换通道。虽然支架的组成和表面化学性质决定其细胞生物相容性,但是支架的结构特征如孔径、形态和孔隙度等,对细胞的黏附、增殖、迁移和分化能力也起着重要的调节作用[12]。除了允许细胞穿透外,支架结构还将允许营养物质和氧气流入,并利于去除细胞产生的废物以增加细胞存活率。Griffon 等[13]发现较小的孔径(<100 μm)使细胞最大程度黏附,播种3 d 后观察到较多的细胞数量。中等尺寸的孔径(100~300 μm)更有利于细胞增殖分化,长期培养后细胞数量增多且检测到更多的分化标志物。然而,孔径过大反而会导致细胞数量减少。Lee 等[14]向500 μm 孔径支架中播种细胞,在7d 后几乎观察不到细胞,这说明在静态播种条件下,大孔径虽然会增加细胞在空间中的穿透能力,但是也相应地减小了细胞和支架间的相互作用,导致细胞难以附着。此外,支架的孔隙形态同样会对细胞行为造成影响,如Caliari 等[15]使用马肌腱细胞,通过定向凝固胶原蛋白-糖胺聚糖支架重建了三维的肌腱组织平台。在此定向孔支架上培养肌腱细胞,可观察到更强的细胞附着、代谢活性和排列能力。这可能是由于定向孔中的细胞更具流动性,能为细胞扩散和增殖提供更大空间,同时保持均匀的营养供应,进而增强细胞活性。与此相反,孔隙率较小的支架不能为细胞提供充足空间使细胞迁移和增殖,从而导致细胞聚集并因此呈现较低的活性。
从生物学的角度来看,大孔隙率的支架结构在细胞穿透并防止细胞溢出方面起着关键作用。适当的微孔隙利于营养物质的交换,并能吸附充足的特定蛋白质来满足细胞的生长需求。然而,较大的孔隙率不利于保持机械性能,随着孔隙率的增加,机械性能往往呈指数下降[16]。总之,对于细胞培养肉而言,因不同种动物的组织结构及机械性质差异,故满足相应种子细胞最适生长条件的三维支架制造仍需进行大量测试验证。
2 细胞培养支架材料
2.1 支架材料选择的一般性原则
术语“支架”最早出现在组织工程领域,指经过加工的具有适当形状、尺寸、物理性质的结构材料,其与细胞、生长因子和其它生物活性分子结合,促进组织修复和再生[17]。因此,支架作为一种三维的细胞培养平台,通过再现细胞的原生三维微环境,促进更自然的细胞行为和组织形成。作为组织形成的模板,支架材料通常模拟细胞外基质,保证细胞的有效黏附、增殖和分化[18]。除生物相容性外,组织工程支架材料性能优化通常还集中在生物降解性,以及包括孔隙率、材料强度、可变结构与形态等[19]。
在细胞培养肉领域,由于肉类的主要成分是肌细胞形成的肌纤维组织及脂肪细胞形成的脂质,因此培养肉的支架材料侧重于通过多种细胞共培养和支架结构适度支撑的方式来培养骨骼肌组织。这与再生医学中生物人工肌肉研究领域有着类似的技术原则[20]。同时,支架材料也必须是多孔结构,以满足连续的介质灌注要求,从而模拟自然组织的血管。此外,细胞培养肉的支架应有助于产品形成的理想感官特性,并具备可食用安全性(尤其是支架作为最终产品的部分组织)。支架也可通过培养或后续加工中移除的方式,避免在最终产品中残留[21]。综上,细胞培养肉支架材料应满足多孔性、生物相容性、生物可降解性、可食用性、适度的支架结构与力学性能、良好的加热性质等要求(图2a)。而根据支架材料最终的应用形态,可以分为水凝胶支架、脱细胞的组织或器官,以及包括三维多孔支架、纤维和微球支架在内的其它预成型支架[22]。
2.2 水凝胶支架
水凝胶是一种具有三维网络结构的聚合物材料,可以容纳大量的水分子。其制备方式包括共价键合、光化聚合、高温凝胶、低温凝胶以及其它方式如物理交联、疏水相互作用、静电作用、结晶或氢键结合等(图2b)[23]。水凝胶材料通常具有生物相容性良好,机械性能可调节,降解率可预测等优点[24-25]。同时,其与细胞外基质含水量以及自然组织力学性能相似,可为种子细胞提供一个良好的迁移增殖分化平台[26]。此外,水凝胶良好的亲水性[27],其物理空间封装细胞的能力显著,因而在干细胞三维培养领域有着广泛的研究。例如,水凝胶用于脂肪源性干细胞的培养,目前已在成骨分化、肌肉再生、心脏分化、神经分化、皮肤再生等领域发挥作用[23]。此外,Furuhashi 等[28]在水凝胶模块中制造毫米厚的牛肌肉组织,其肌管沿长轴方向排列,可在电刺激的作用下收缩,具有适当的肉类生理特性和食物特性。

图2 (a)培养肉支架的基本制造条件[21];(b)细胞相容性水凝胶及其细胞界面复杂的化学相互作用[33]Fig.2 (a)General conditions of manufacturing cultured meat scaffolds[21];(b)Multiple chemical interactions in the complexity of cytocompatible hydrogels and their cell interfaces[33]
天然水凝胶及其衍生材料包括明胶、胶原蛋白、壳聚糖、海藻酸盐、透明质酸等,具有细胞信号传导能力,可以在细胞间产生相互作用,然而,仍存在机械强度低,结构降解不受控制,免疫原性未知等问题。胶原水凝胶可对同种或异种移植细胞进行保存和免疫保护[29]。海藻酸盐水凝胶珠包裹的软骨细胞显示出高活力,软骨基质沉积,低水平的软骨细胞肥大,在培养7 d 内细胞增殖逐渐增加,并通过相应的信号和激素刺激后模拟了天然生长板软骨的组织结构,建立了一种可调的体外系统[30]。
合成水凝胶材料包括聚乙二醇、聚乙烯醇等,这些材料降解性能和微观结构虽可控,但缺乏相应的生物组分[31]。因此,天然材料和合成材料改性复配制备支架的方法引起广泛的关注。甲基丙烯酸明胶水凝胶结合了天然和合成水凝胶的优点,保留了明胶的大部分功能氨基酸基序,可以通过定制合成工艺或添加各种天然或化学合成的生物材料来满足特定的生物功能和机械可调性要求,目前已可以保证诱导多能性干细胞、间充质干细胞、胚胎干细胞等多种干细胞移植与组织修复时的活性[32]。然而,在细胞培养肉领域,甲基丙烯酸明胶水凝胶尚存在培养残留与食用安全性问题。
2.3 脱细胞组织、器官支架
脱细胞的组织或器官是指通过化学(表面活性剂、酸、碱)或酶(如胰蛋白酶)或机械力(如冻融、搅拌、超声、超临界CO2、静水压力)等方式分离和移除细胞成分[34],残余骨架即天然细胞外基质材料作为三维支架。动物来源的脱细胞组织的主要成分是胶原蛋白、层交连蛋白和纤维连接蛋白[35];植物来源的主要成分则是纤维素骨架、果胶和半纤维素[36]。以上成分在其研究中均被证明具有细胞相容性。
由于肌肉组织生长的定向特性,细胞培养肉为了实现组织成型需要肌肉纤维的单向排列,研究表明在分化前对齐成肌细胞有利于生成排列的肌管[37]。而排列的方法包括用电或机械的主动刺激,以及被动调节支架力学性能,如改变刚度,引入促进细胞排列的表面路径等[38,39]。如图3a 所示,去细胞和脱钙的鱼鳞衍生支架表面存在径向凹槽和环脊,可以模拟细胞培养的三维微环境,同时鱼鳞主要成分是羟基磷灰石和Ⅰ型胶原纤维,与骨细胞外基质相似,利于细胞扩散和增殖。结果表明,鱼鳞具有较高的细胞相容性,可增强细胞黏附和增殖,并引导细胞沿脊通道迁移[40]。脱细胞植物叶保留了其自然的条纹形貌,可以支持成肌细胞的贴附、增殖、排列和分化;肌细胞单轴自排列,这一特征在分化成肌管后仍可保留,为骨骼肌和其它各向异性组织培养提供了一种廉价、可持续的支架制造方法[22]。
2.4 其它预成型功能支架
2.4.1 三维多孔支架 用水凝胶包覆肌细胞制备的培养肉,与传统肉品质相比还有一定差距[41]。具有特定形状和相连孔径结构的三维多孔支架模型,不仅可以控制空间形状,还可确保气体、营养物质和代谢废物的交换[42],在制备高度结构和有组织的肉类中具有极大优势。三维多孔支架可以通过冷冻干燥、静电纺丝、3D 打印、熔融沉积、溶剂浇铸等技术加工而成[21]。制备支架的材料可分为天然材料(如食品动物源和植物源的多糖及蛋白)、合成材料(如聚乳酸等聚合物以及体外重组蛋白等)[43]。例如,利用壳聚糖和海藻酸钠静电相互作用,通过冷冻干燥制备3D 可食用壳聚糖-海藻酸钠-胶原/明胶支架。该支架具有外部多孔的蜂窝结构,接种猪骨骼肌卫星细胞的蛋白和肌源性基因表达上调,诱导分化后可以形成细胞骨架[44]。再如用聚乳酸打印模具并进行反向铸造,脱模制备的PDMS 模具用以混合胶原培养猪肌肉干细胞,结果显示形成了结构组织的肌管[45]。
植物蛋白具有类似肌肉的纤维结构,通常用来制备模仿肉质地的“素肉”。其应用在细胞培养肉中,可以提供整体质构韧性。植物曾被认为缺乏动物细胞经典黏附蛋白的真正同源物,而对细胞基质黏附分子的研究揭示了动物、真菌和植物分子之间的序列相似性[24]。目前,有研究表明花生拉丝蛋白多孔支架可以用于猪平滑肌细胞的黏附和生长[46],同时可以促进猪脂肪来源的间充质干细胞表达PPARγ、FABP4、Plin1 基因和蛋白[47]。此外,有研究证明组织化大豆蛋白多孔支架可以支持细胞附着和增殖(如图3b),并将其应用于牛卫星肌细胞、牛平滑肌细胞和牛内皮细胞的培养,从而创建了3D 工程化牛肌肉组织的培养模型[48]。
2.4.2 类纤维和微球支架 目前哺乳动物细胞肉大多是非结构化的,为了模拟真正的肉组织,可以应用各种组织工程技术如细胞薄片工程、细胞纤维工程、3D 打印等[49]。组织工程领域基于纤维调控的策略在体外创建三维复杂组织具有良好的发展前景(图3c)。有研究证明,使用双同轴层流的微流控装置制造的水凝胶纤维包裹细胞外基质蛋白和细胞,可以重建活组织的内在形态和功能,同时还可通过编织和卷曲组装成具有各种空间模式的宏观结构[50]。在细胞培养肉领域,挤压明胶纤维可以促进牛主动脉平滑肌细胞和兔骨骼成肌细胞贴附增殖,同时短长度纤维促进细胞聚集,长纤维促进肌肉组织形成[51]。Kang 等[49]采用颗粒状结冷胶浴和明胶浴的方法进行肌腱-凝胶集成生物打印,制备出3 种牛细胞纤维:肌肉、脂肪组织和毛细血管,3 种细胞在分化过程中可保持良好的纤维结构并组装形成类牛排样组织。
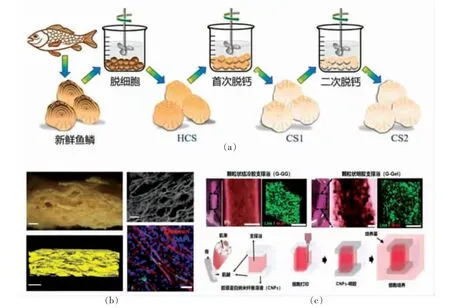
图3 (a)制备脱细胞和脱钙鱼鳞支架过程的示意图[40];(b)组织化大豆蛋白支架的微观结构及生物相容性[48];(c)结冷胶、明胶支架运用于肌腱-凝胶支撑浴打印[49]Fig.3 (a)Schematic diagram of the process of preparing decellularized and decalcified fish scale scaffolds[40];(b)Microstructure and biocompatibility of textured soybean protein scaffolds[48];(c)Granular gellan gum bath and granular gelatin bath used in tendon-gel integrated bioprinting[49]
微载体是直径为数百微米的微型三维培养支架,是一种高效、可伸缩的细胞扩张平台。理想的微载体需具有比表面积大、细胞亲和力高、生物降解性或可食用性等特点[52]。Zhang 等[53]将淀粉通过离子交换与DEAE 偶联合成淀粉微球,适合贴壁哺乳动物单细胞的生长。在旋转瓶中运用可食用的三维多孔明胶微载体培养猪骨骼肌卫星细胞,结果表明细胞发生可伸缩扩张,并在没有肌源性试剂的情况下触发了自发肌生成。此外,Liu 等[54]利用3D 打印模具和TG 酶将微组织组装成具有相似力学性能和高蛋白量的厘米级肉丸。
3 培养肉支架组织成型
细胞培养肉支架组织成型需要满足一定的孔隙率,合适的孔径或通道大小,适宜的支架尺寸和厚度,以及支撑细胞生长与支架成型的杨氏模量等结构属性,且与细胞的来源与生长要素差异有关。由于细胞大小、迁移要求和物质运输,孔径的最低要求被认为是100 μm[55-56],对于成肌细胞和成脂细胞需要的孔隙分别为50~150 μm 和40~400 μm[57]。一般而言,宏观的工程化组织培养肉才能真正意义地被称为“肉”,这不仅需要细胞能在支架材料上成功增殖与分化,还需要借助如微载体成型、静电纺丝成型、生物3D 打印成型等一定的组织成型方法。
3.1 微载体成型
细胞微载体是用于细胞治疗和组织工程等生物医学领域的细胞培养和物质传递的微尺度聚合微粒[58]。Yang 等[59]报道了一种RGD 肽功能化壳聚糖微球支架用于人脐静脉内皮细胞(HUVECs)的快速增殖,使其在体外能够形成组织化血管;Anton 等[60]制备了直径571 μm 的壳聚糖微球支架,并能支持小鼠骨骼细胞C2C12 成肌细胞、兔平滑肌细胞、羊成肌纤维细胞等的黏附和快速增殖。在细胞培养肉方面,清华大学的研究人员利用可食用的多孔明胶微载体(如图4a),结合搅拌式生物反应器,在体外高效、规模化扩增出猪原代肌肉星形细胞(即猪骨骼肌干细胞),并诱导其分化和成熟;随后,利用3D 打印肉球模具和食品级谷氨酰胺转氨酶,将百微米尺度的猪肌肉微组织组装成数厘米大小的人造猪肉丸[54]。

图4 (a)模板微球成型的人造肉丸[54];(b)静电纺丝明胶成型的组织肌肉[61];(c)生物3D 打印成型的类牛排组织[49];(d)水凝胶堆叠成型的类牛肉组织[57]Fig.4 (a)Artificial meatballs formed by template microspheres[54];(b)Engineered tissue muscles formed by electrospinning gelatin[61];(c)Steak-like tissue with marble texture formed by 3D bioprinting[49];(d)Beef-like tissue formed by stacking hydrogel[57]
3.2 静电纺丝成型
静电纺丝技术是一种简单、经济、可调的工艺,将其用于组织成型时,能诱导植入的细胞对齐,促进肌肉细胞的伸长[62]和肌肉组织生成[63],形成明显的纤维结构。Deng 等[64]报道了一种静电纺丝制备的明胶/玉米醇溶蛋白纳米纤维膜。哈佛大学的研究人员利用浸没旋转喷射纺纱(iRJS)纺制了食品级的明胶纤维(图4b),并将兔肌肉细胞和牛平滑肌细胞植入其中生长,得到一个大小约4 cm3,1.5 mm 厚的成型肉,纹理剖面分析表明其更接近于绞碎的牛肉而非兔或牛肉的整块肌肉。虽然肌肉纤维排列性良好,但是其结构仍未达到传统全切肉制品的组织结构密集程度[61]。
3.3 3D 打印成型
三维打印技术也被称为增材制造技术,作为一种可在各种尺度上定位细胞位置并可从多种材料中大规模生产复杂几何结构的工具,近年来受到广泛关注。生物墨水的3D 打印可通过喷墨、激光辅助生物打印、投影式光固化和挤出等多种方式实现。其中,基于挤出的生物3D 打印操作简单、成本低、加工安全,且易实现多种用途、商业化及应用推广,是目前食品领域最受欢迎的打印制造方式[65]。常用的挤出式生物3D 打印材料因需要具备剪切稀化的非牛顿流体特性,故以水凝胶基质的生物墨水为主[66]。同时,挤出式生物3D 打印墨水还应具备最小的巴勒斯效应(Barus effect),以保证材料从喷嘴中挤出后不会过度膨胀[67]。Li 等[68]通过挤出式3D 打印和光固化打印细胞化的Gel-MA-20%丝素蛋白生物墨水,制备出具有多层的猪骨骼肌组织。Bolívar-Monsalve 等[69]通过连续共挤出方式打印海藻酸盐和载有C2C112 明胶甲基丙烯酰-海藻酸盐生物墨水生成含多层纤维骨骼肌微组织。
随着研究人员对仿生结构研究的深入,部分试验验通过3D 生物打印技术以模仿真实的排列方式,进而制备组织化的细胞培养肉。日本大阪大学的研究人员利用一种支撑浴3D 打印及肌腱-凝胶生物3D 打印技术(如图4c),构建了72 根细胞纤维(42 块肌肉,28 个脂肪组织和2 条毛细血管),并仿照真实和牛细胞纤维染色后的图像进行手工排列堆叠,最终得到直径为5 mm、长度为10 mm 的具有大理石纹路的人造牛排[49]。浙江大学刘东红团队通过生物3D 打印技术模拟真实鱼肉组织结构,基于大黄鱼成肌干细胞与脂肪干细胞的增殖分化构建出类组织化的细胞培养鱼片[70]。
3.4 其它成型方法
除上述的微载体成型、静电纺丝成型和3D 打印成型方法外,还有一些如细胞片工程等方式可将细胞微组织组装成型为厘米级或毫米级的组织化人造肉(图4d)。Shahin-Shamsabadi 等[71]利用无血清细胞片工程培养C2C12 成肌细胞和3T3-L1前脂肪细胞,将18 片细胞片进行堆叠构建出一个宽1 cm,厚1~2 mm 的组织化人造肉。Simsa 等[72]通过纤维蛋白凝胶中植入牛卫星细胞,以血红蛋白和肌红蛋白构建一个与熟牛肉颜色相似的13 mm×1.4 mm×2.3 mm 的工程化人造肉。Ben-Arye等[48]在多孔组织化大豆蛋白支架中植入牛卫星细胞、内皮和平滑肌细胞,培养4 d 后通过染色观察到成型的肌管,制得一个宽6 mm,厚1~2 mm 的类牛肉薄片,并与市售的牛肌肉有着相似的杨氏模量和极限拉伸强度。Furuhashi 等[73]将胶原蛋白、纤维蛋白和基质组成的ECM 水凝胶植入牛成肌细胞,堆叠在柱子中促进收缩排列,利用脉冲培养14 d,构建了与商业牛肉具有相似断裂力的毫米级类牛肉组织。
4 总结与展望
由于日益加剧的人口压力、资源限制和环境劣变,以及全球肉类消费需求的不断增长,传统畜牧业的可持续发展逐渐成为一个严峻的挑战。细胞培养肉作为替代蛋白的新兴技术,其依据动物肌肉组织生长机理,利用干细胞由体外三维培育而成,被认为是最有可能解决未来肉品生产难题和消费困境的方案之一,在解决当前肉业生产效能不足以及公共卫生、环境退化和动物福利等问题方面展现了巨大的潜力。
在细胞培养肉制备过程中,由于细胞对三维环境存在“机械转导机制”,支架的组成、表面化学性质以及孔径、孔隙度在内的结构特征均对细胞的黏附、增殖、迁移和分化起着重要的调节作用,因此,细胞培养肉支架材料应满足多孔性、生物相容性、生物可降解性、可食用性、适度的支架结构与力学性能、良好的加热性质等原则及要求。常见的细胞培养三维支架材料包括水凝胶支架、脱细胞的组织或器官,以及三维多孔支架、纤维和微球在内的其它预成型功能支架。细胞在支架材料上成功增殖与分化后,还需设计结构成型方法使其形成宏观的工程化组织培养肉,目前微载体成型、静电纺丝成型、生物3D 打印成型等技术已被研究证实为可行的培养肉组织成型手段。
总之,培养肉被认为是未来替代传统肉类生产模式的技术发展方向之一,目前仍处于初期阶段,缺乏工业化生产基础。此外,还有一些基本问题需要解决,包括高表达细胞系、大规模生物反应器、低成本无血清培养基与支架、高效组织成型工程的建立[74,75],以及相应的食品安全性和质构风味特性的调控。随着生物、材料与食品技术的进一步融合发展,细胞培养肉有望成为一种高效生产、绿色环保且无需动物屠宰的可持续肉类制造策略,从而缓解未来人口和肉类需求增长带来的压力。
致谢
本研究得到浙江大学上海高等研究院繁星科学基金资助(SN-ZJU-SIAS-004)。
