昆明优质本土乳酸菌的筛选及其对全株玉米青贮品质的影响
2023-01-03李彦飞杨双双初晓辉马向丽段新慧段佳鑫单贵莲
李彦飞, 杨双双, 初晓辉, 马向丽,2, 段新慧,2, 韩 博,2, 段佳鑫, 单贵莲,2*
(1.云南农业大学动物科学技术学院, 云南 昆明 650201; 2.云南省高原特色农业产业研究院, 云南 昆明 650201)
青贮是在厌氧环境中,利用乳酸菌的发酵作用,降低pH,抑制有害菌的生长,以长期保存饲草青绿多汁营养特性的简单而又经济的方法[1]。在青贮饲料发酵过程中,乳酸菌发挥着关键的作用[2]。青贮饲料中乳酸菌种类较丰富,其中,乳酸菌并不是青贮饲料表面附着的唯一的微生物[3],梭状芽孢杆菌(ClostridiumPerfringens)、大肠杆菌(Escherichiacoli)、酵母菌(Candidaboidinii)等也常附着在青贮饲料表面,并与乳酸菌竞争水溶性碳水化合物,降低了青贮饲料的品质[4-5]。
为有效提升青贮饲料的品质,人们往往采用添加乳酸菌制剂的方式进行青贮。研究表明添加乳酸菌制剂大多能有效改善饲料的营养价值、发酵品质及有氧稳定性[6-8]。也有研究发现,受区域性环境因素的影响,接种乳酸菌可能对青贮品质没有提升效果甚至会降低青贮品质,因为更能适应环境的附着微生物可能更具竞争力而主导青贮过程[9-10]。添加适应当地气候条件的乳酸菌菌株,才能起到提升青贮饲料发酵品质的效果[11-12]。然而,不同地区、不同类型青贮饲料中乳酸菌种群结构和数量差异较大[5],开展青贮原料表面附着优质乳酸菌的筛选研究,研发出适应当地气候条件的乳酸菌制剂,对促进当地青贮产业及草地畜牧业的高效发展具有一定的推动作用。
为筛选出适应昆明气候条件、地理环境及青贮原料种类的青贮用乳酸菌制剂,提高全株玉米青贮饲料的青贮品质,本试验旨在发现适应昆明温暖湿润气候条件的优质乳酸菌菌株,探讨其在全株玉米青贮上的应用效果,为昆明地区青贮用乳酸菌制剂的研发提供材料与支撑。
1 材料与方法
1.1 优质乳酸菌的筛选与鉴定
1.1.1优质乳酸菌的筛选 2021年7月20日,将采自云南农业大学校实习基地的蜡熟期‘云瑞121’青贮玉米(Zeamays‘Yunrui 121’)、现蕾期‘WL525’紫花苜蓿(Medicagosativa‘WL525’)、抽穗期‘安巴’鸭茅(Dactylisglomerata‘Amba’),粉碎至3~4 cm、揉搓、充分混合均匀后装入容积为5 kg的聚乙烯塑料桶,每份材料装3桶,压实密度为640 kg·m-3,密封,于室温避光贮藏,自然发酵60 d。
2021年9月20日,取发酵完成的青贮样品各10 g,利用稀释涂布平板法[13]进行乳酸菌的分离,采用MRS琼脂培养基进行划线培养,从3种样品中各分离30株菌株,依次编号为A1-A30(来自青贮玉米样品)、B1-B30(来自紫花苜蓿样品)、C1-C30(来自鸭茅样品)。将90株菌株进行革兰氏染色和过氧化氢酶试验[13],筛选出乳酸菌菌株并继代划线3次,得到纯化的菌株。将纯化后的菌株接种在装有MRS液体培养基的离心管中,置于37℃恒温培养24~36 h。于培养12 h和24 h时测其OD600 nm及pH值,据此初选优质菌株。根据初选菌株的生长速率和产酸速率[14],初选获得9优质乳酸菌菌株。
1.1.2乳酸菌生理生化特性及鉴定 根据Cai等[14]描述的乳酸菌鉴定方法,对9株菌株进行革兰氏染色、菌落形态、过氧化氢酶活性和葡萄糖产气试验。
1.1.3乳酸菌的鉴定及分类地位的确定 采用TIANamP细菌DNA试剂盒(DP302-02,天根科技有限公司,北京,中国)[15],按照说明书提取菌株基因组DNA。通过引物序列27F:5′-AGAGTTTGATCCTGGCTCAG-3′和1492R:5′-AAGTCGTAACAAGGTAACC-3′[14]进行PCR扩增。将长度约为1 500 bP的条带PCR产物送上海生工生物工程(云南)股份有限公司测序并进行序列分析[14]。将测得的16SrRNA序列提交NCBI Genbank进行Blast同源性比对,得出菌株的属种信息。
选取Genbank中与初选菌株相似度最高的已知菌株序列,利用MEGA7.0软件采用邻接法(Neighbor-Joining)构建系统发育树,确定其分类地位。
1.1.4优质菌株生长性能和产酸能力测定 将初选获得的9株菌株发酵液以3%的接种量接种到MRS液体培养基中,置于37℃恒温培养,每隔3 h测定其OD600 nm和pH值,连续测定24 h,终选出3株优质乳酸菌菌株,并绘制产酸速率和生长速率曲线。
1.2 优质乳酸菌应用效果检测
1.2.1供试材料的种植与管理 供试玉米品种为‘曲辰9号’青贮玉米(Zeamays‘Quchen 9’),该品种购自北京克劳沃种业有限公司。2021年6月15日,将供试玉米品种播种于云南农业大学校实习基地(25°21′N,102°58′E),穴播,种植密度58 000株·hm-2,播种时适量施入农家肥为基肥,复合肥为种肥,之后于玉米拔节期追施适量尿素,并于玉米生长过程中进行常规管理,确保其正常生长。
1.2.2试验设计 2021年10月16日,将筛选获得的优质乳酸菌菌株,进行活化,按照3%的接种量加入100 mL的MRS液体培养基中进行培养24 h制成优质乳酸菌菌液。将优质乳酸菌菌液,单独或按1∶1配比添加到蜡熟期全株玉米中进行青贮发酵(设自然发酵和添加商用乳酸菌制剂为对照),检测其应用效果。试验设7个处理,表1为各处理乳酸菌种类、活菌数量、添加量等。

表1 试验设计Table 1 Experimental design
1.2.3青贮样品的制作 2021年10月16日,将蜡熟期全株玉米刈割,用切短揉搓机粉碎(长度2~3 cm)并混合均匀后,将自制菌液均匀喷洒在原料表面(CK组喷洒等量蒸馏水,商用乳酸菌制剂按推荐添加量溶于蒸馏水后均匀喷洒),充分混均、揉搓,确保喷洒均匀。将处理好的样品装入容积为5 kg的聚乙烯塑料桶,每处理装3桶,压实密度为640 kg·m-3,即为3次重复。压实、密封,发酵60 d后开封取样,开展相关指标的测定。经测定,全株玉米原料的WSC为8.11% DM,CP为6.33% DM,ADF为27.75% DM,NDF为44.61% DM,EE为14.15% DM,Ash为3.70% DM。
1.2.4测定指标及方法
发酵品质测定:pH值采用pH计测定[15]。乳酸、乙酸、丁酸及丙酸含量采用高效液相色谱法测定[8],色谱柱为RoA-organic Acid H+(8%),柱温为30℃,流动相为20 mmol·L-1KH2PO4/H3PO4,pH为2.37,进样量20 μL,检测波长为210 nm,流速为0.6 mL·min-1。NH3-N采用苯酚-次氯酸钠比色法测定[16]。
微生物数量测定:采用稀释涂布平板法[13]进行乳酸菌、酵母菌、霉菌和好氧细菌的计数。乳酸菌采用MRS培养基(上海博微生物科技有限公司,上海,中国),好氧细菌使用营养琼脂培养基,酵母菌和霉菌采用孟加拉红(虎红)培养基培养[13]。乳酸菌和好氧细菌在30℃下培养2 d,酵母菌和霉菌在28℃条件下培养3~5 d,培养结束后进行平板菌落计数。
常规营养成分的测定:DM采用烘干法[17],NDF及ADF采用范氏法[6],CP采用凯氏定氮法[8],EE采用残余法[18],Ash采用灼烧法[19],WSC采用蒽酮-硫酸法测定[13]。
有氧稳定性的测定:取500 g置于15 cm×20 cm塑料封口袋中,用牙签扎数十个小孔,再套上一个宽松不封口的塑料袋,防止交叉污染和减少水分损失,置于室温下存放,避免阳光直射。记录温度从完成装袋时算起,每4 h记录1次,直至所有处理组的温度超过环境温度2℃为止。环境温度以挂在墙上的温度计为参考。同时为消除环境温度骤变带来的误差,以试验前放置的水为对照。
1.3 数据分析
用Microsoft Excel 2010整理数据,采用SPSS23.0统计分析软件进行单因素方差分析,采用Duncan氏法多重比较检验进行组间差异显著性分析,数据采用平均值±标准误表示,P<0.05表示差异显著。
运用模糊数学隶属函数法[19]对青贮营养价值进行综合评价,如果测定的指标与青贮的营养价值呈正相关,计算公式如下:
如果为负相关,则用反隶属函数进行转换,计算公式如下:
式中:R(Xi)为某一指标隶属函数值,Xi为该指标的测定值,Xmax和Xmin分别为该指标所有测定值中的最大值和最小值。
对所有指标隶属函数值进行相加,求其平均值,以平均值大小进行排名。
2 结果与分析
2.1 昆明本土青贮饲料中优质乳酸菌的筛选与鉴定
2.1.1乳酸菌群落结构特征 从昆明本土青贮饲料中分离出90株菌株,经革兰氏染色和过氧化氢酶试验,继代划线3次,纯化获得83株乳酸菌菌株。通过16SrRNA序列和NCBI Blast N序列比对,83株乳酸菌菌株分别属于乳酸杆菌(Lactobacillus)、片球菌(Pediococcus)和魏斯氏菌(Weissella)3个属,包含了植物乳杆菌(L.Plantarum)、戊糖片球菌(P.Pentosaceus)、短乳杆菌(L.brevis)和类肠膜魏斯氏菌(W.Paramesenteroides)4个种,其中植物乳杆菌42株,占50.6%,戊糖片球菌和短乳杆菌各18株,占21.7%,类肠膜魏斯氏菌5株,占0.06%(表2)。
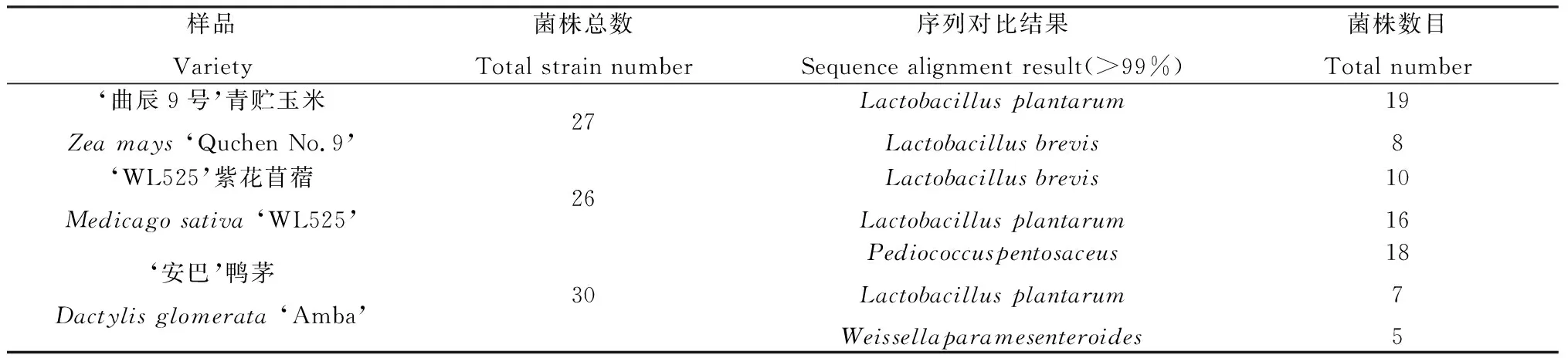
表2 83株乳酸菌鉴定结果及分布详情Table 2 Identification results and distribution details of 83 lactic acid bacteria strains
2.1.2乳酸菌的鉴定与筛选 根据培养12 h和24 h时的OD600 nm值及pH值,从83株菌株中初选出9个优质菌株,分别是A9,A11,A19,B10,B16,B23,C10,C14和C23菌株。通过对其生理生化特征的测定,结果表明,9株菌株均呈过氧化氢酶阴性和革兰氏阳性,其中A9,A11,A19,B10,B16,B23,C10均是杆状,初步判定为片球菌属;而C14,C23是球状,初步鉴定是乳杆菌属。9株菌株中,B10菌株能够利用葡萄糖产生气体,并产生乳酸,表明B10菌株是异型乳酸菌,其余8株菌株不能利用葡萄糖产生气体,表明这8株菌株是同型乳酸菌(表3)。
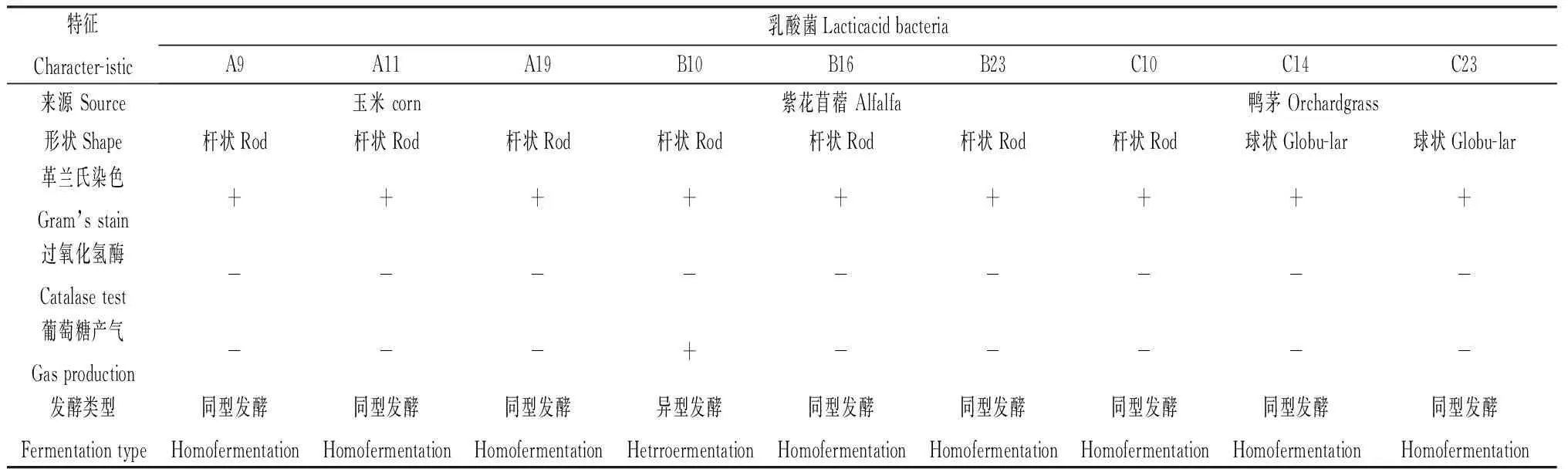
表3 乳酸菌的生理生化特性Table 3 Physiological and biochemical characteristics of lactic acid bacteria
通过对9株菌株糖发酵试验的测定(表4),结果表明,A9,A11,A19,B16,B23,C23菌株能够利用半乳糖、乳糖、七叶苷、纤维二糖、麦芽糖、甘露醇、水杨甘、蔗糖、棉子糖、马尿酸、阿拉伯糖、果糖、甘露糖、蜜二糖,初步鉴定为植物乳杆菌。B10菌株能够利用半乳糖、阿拉伯糖、果糖、蜜二糖,不能利用其它糖进行发酵,且其形状为杆状,初步鉴定为短乳杆菌。C14,C23菌株形状为球状,能够利用半乳糖、七叶苷、纤维二糖、麦芽糖、水杨苷、阿拉伯糖、果糖、甘露糖,初步鉴定为戊糖片球菌。
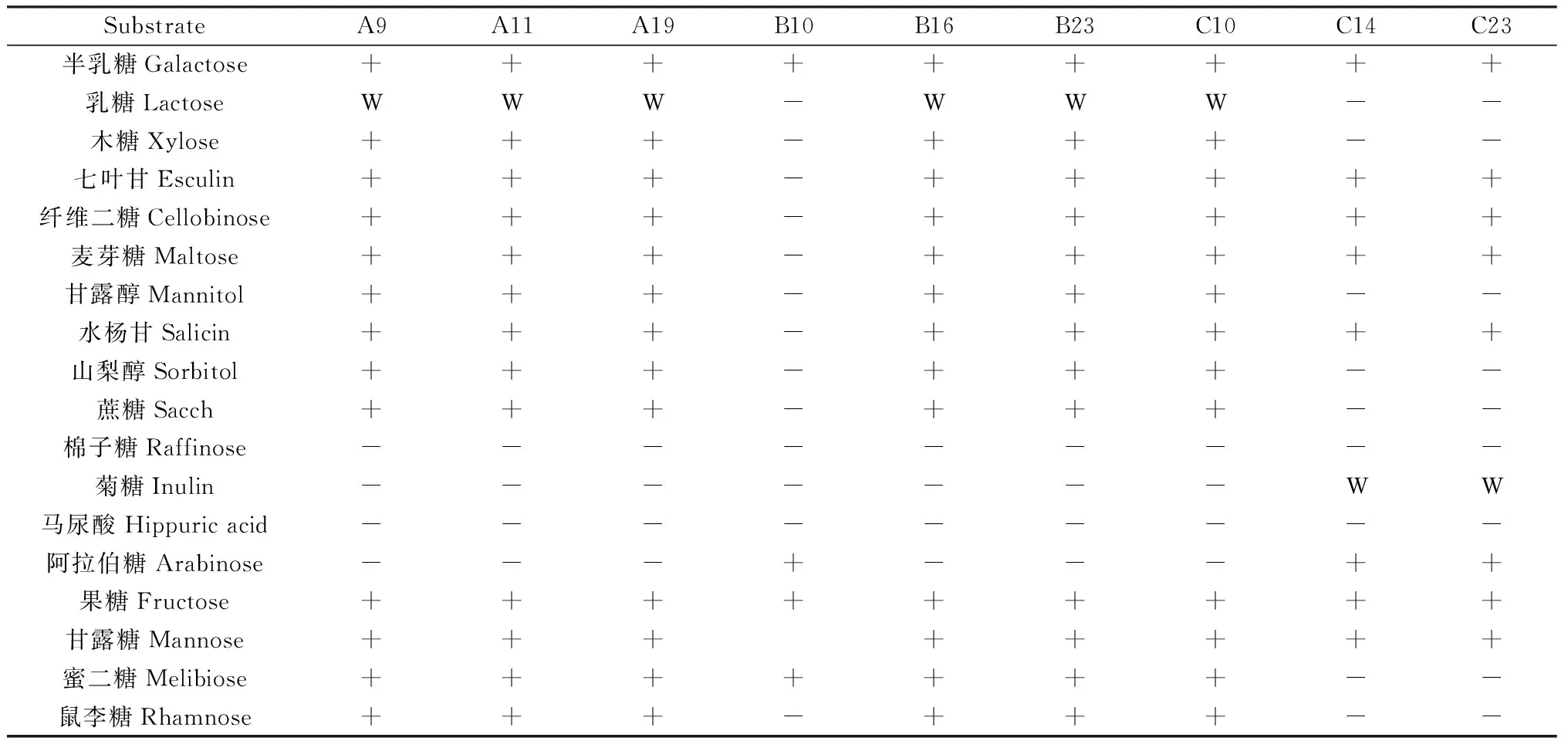
表4 乳酸菌糖发酵特性Table 4 Characteristies of sugar fermentation of lactic acid bacteria
系统发育树构建结果显示(图1),菌株A9,A11,A19,B16,B23,C10与L.Plantarum以100%相似度聚在同一支上,鉴定为植物乳杆菌。菌株B10与L.brevis以100%相似度聚在同一支上,鉴定为短乳杆菌。菌株C14,C23与P.Pentosaceu以100%相似度聚在同一支上,鉴定为戊糖片球菌。用于构建系统发育树的参考菌株见表5。
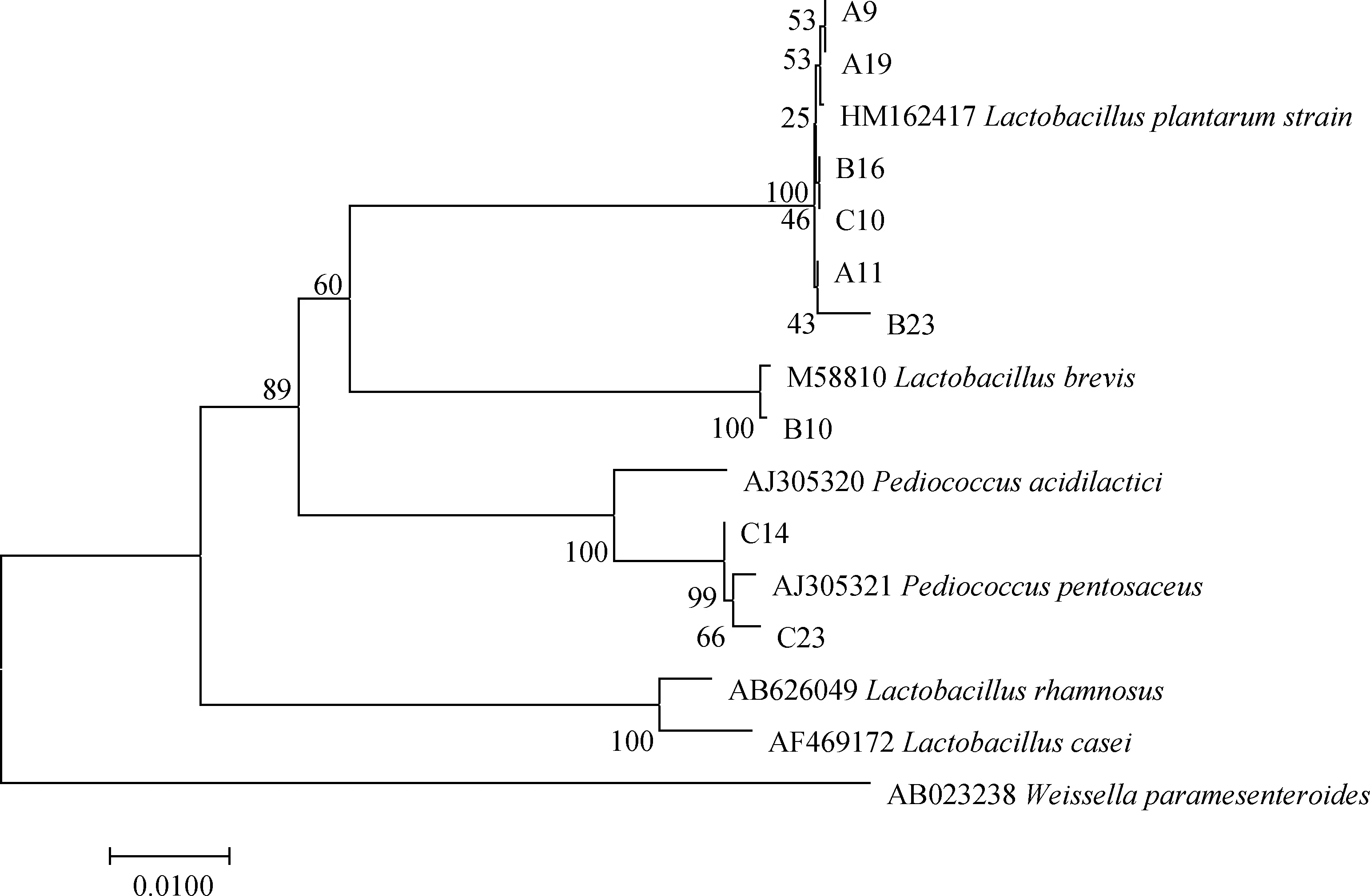
图1 乳酸菌系统进化树的构建Fig.1 Construction of phylogenetic tree of lactic acid bacteria
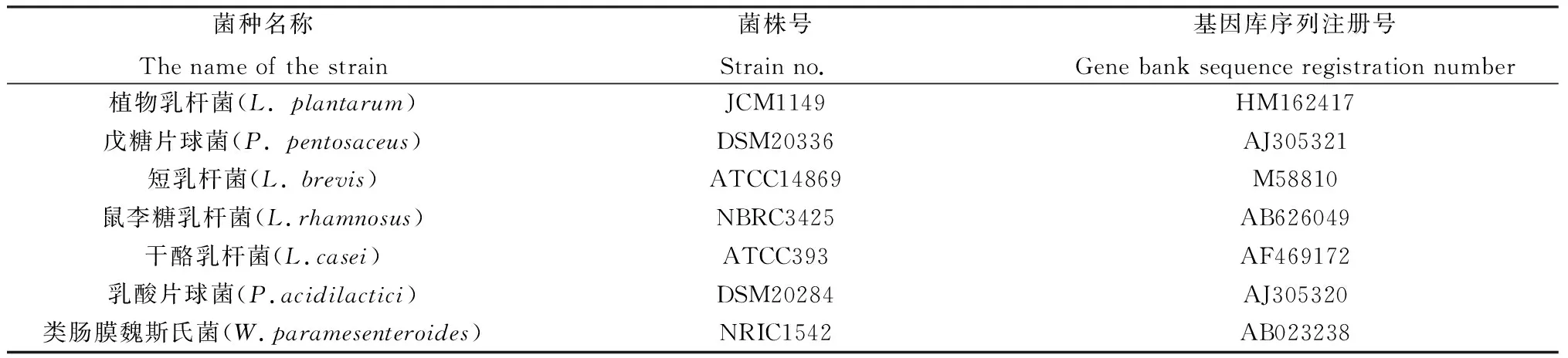
表5 构建系统发育树参考菌株Table 5 To construct reference strains of lactic acid bacteria phylogenetic tree
比较初选获得的9株菌株的生长速度及产酸速率,分别从3种乳酸菌菌株中筛选获得产酸能力最强、生长速度最快的3株菌株为优质菌株,它们分别是短乳杆菌B10、植物乳杆菌B16及戊糖片球菌C23。进一步测定其产酸速率和生长速率,结果表明:培养15 h时,B16菌株的pH下降至3.44,C23菌株的pH下降至3.84。培养24 h时,B16菌株的pH为3.37,C23菌株的pH值为3.56,B10菌株的pH为4.22,此时B16菌株和C23菌株的pH值基本达到稳定(图2A)。培养12 h时,B16和C23菌株的OD600nm值基本达到最大值,为2.87和2.80。B10菌株在培养的第6~12 h生长相对较慢,但在培养的第12~24 h快速生长,培养24 h时,其OD600nm增加至2.84(图2B)。
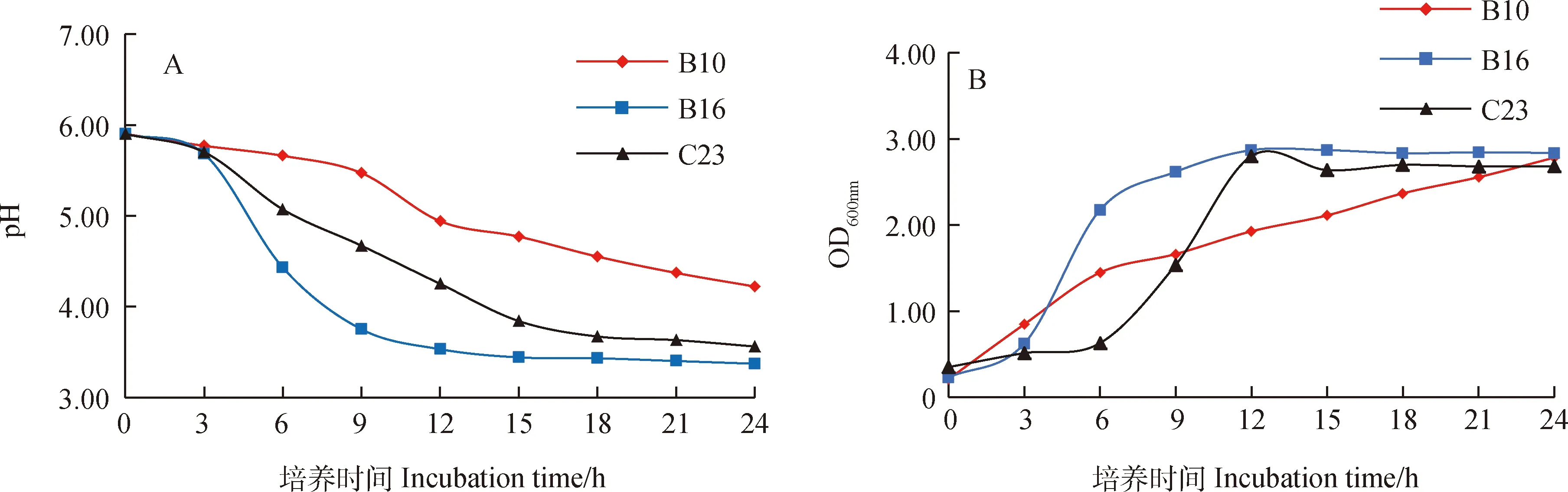
图2 优质乳酸菌的产酸速率(A)及生长速率(B)Fig.2 Acid production rate (A) and growth rate (B) of high-quality lactic acid bacteria
2.2 添加本土优质乳酸菌对全株玉米青贮品质的影响
2.2.1对微生物数量的影响 图3A可知,与CK相比,添加自制乳酸菌及商用乳酸菌可显著增加全株玉米青贮样品的乳酸菌数量(D处理除外),以X和W1D1处理乳酸菌数量最高,显著高于其他处理(P<0.05)。图3B可知,与CK相比,添加自制乳酸菌及商用乳酸菌均可显著降低全株玉米青贮饲料中好氧细菌的数量(P<0.05)。以W1D1和X处理效果最好,此2种处理下青贮样品好氧细菌数量较CK降低了37.5%和35.5%。本试验所有处理均未检测出酵母菌和霉菌的存在。
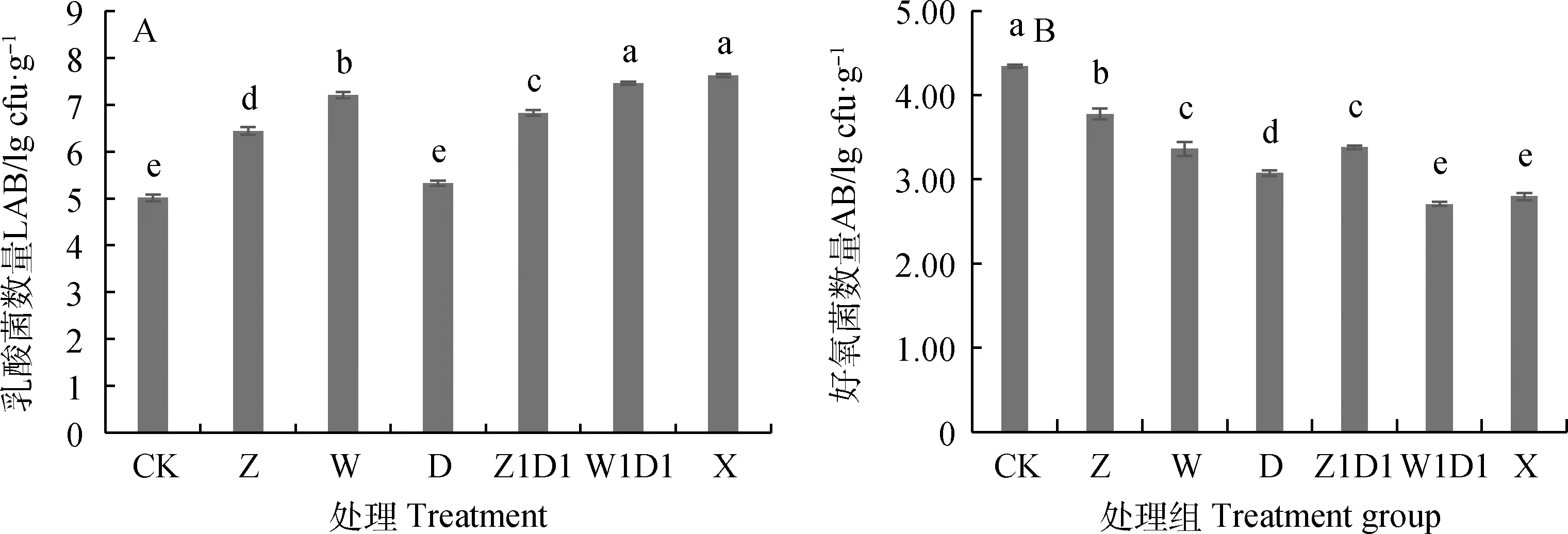
图3 乳酸菌制剂对全株玉米青贮饲料乳酸菌(A)及好氧细菌(B)的影响Fig. 3 Effects of different lactic acid bacteria preparations on LAB (A) and AB (B) in whole corn silage注:不同小写字母表示差异显著(P<0.05),下同Note:Different lowercase letters in the figure indicate significant differences(P<0.05). Same in the following figures
2.2.2对发酵品质的影响 图4A可知,与CK相比,添加乳酸菌处理下青贮样品的pH值显著降低(P<0.05),下降范围为0.7%~4.1%。图4B可知,与CK相比,D,Z1D1,W1D1处理青贮样品NH3-N含量降低了2.6%~9.6%,但4处理间差异不显著(P<0.05),Z,W,X处理青贮样品NH3-N含量显著增加(P<0.05),增幅为18.2%~27.3%。表明添加异型发酵乳酸菌菌液(D处理)或异型与同型乳酸菌菌液的配合添加(Z1D1、W1D1处理)可以显著降低青贮饲料的NH3-N含量(P<0.05)。相比较而言,单独添加同型发酵乳酸菌菌液(Z、W处理)不能很好地抑制好氧细菌的繁殖生长(图3B),可能是因为好氧细菌的繁殖生长加速了饲料中粗蛋白的分解,青贮饲料中NH3-N含量增加。
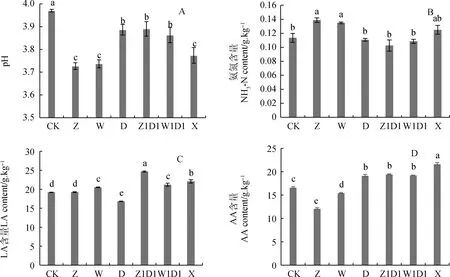
图4 乳酸菌制剂对全株玉米青贮饲料pH(A)、NH3-N(B)、LA(C)及AA(D)的影响Fig.4 Effects of lactic acid bacteria preparation on pH (A),NH3-N (B),LA (C) and AA (D) of whole corn silage
图4C可知,不同处理全株玉米青贮样品乳酸含量以Z1D1处理最高,较CK增加了28.6%,其次是X处理,较CK增加了15.1%,位于第三位的是W和W1D1处理,较CK增加了6.9%和10.6%。图4D可知,与CK相比,X处理青贮样品AA含量增加了30.2%,Z1D1,W1D1,D处理增加了16.9%,15.7%和15.1%。表明异型发酵乳酸菌菌液单独添加(D处理)或异型与同型乳酸菌菌液的配合添加(X、Z1D1,W1D1处理)与CK相比,在提高全株玉米青贮饲料AA含量上效果显著。相比较而言,单独添加同型发酵乳酸菌菌液(W、Z处理)在提高青贮饲料AA含量上效果不明显。本试验中,所有处理均未检测出丙酸和丁酸,表明在整个发酵过程中,有害微生物活动较少。
2.2.3对常规养分的影响 表6可知,与CK相比,添加乳酸菌制剂的全株玉米青贮饲料DM,CP,EE含量显著高于CK组,其WSC(Z1D1处理除外),ADF,Ash含量显著低于CK组(P<0.05),表明乳酸菌制剂的添加有利于全株玉米青贮饲料DM,CP及EE的保存,但乳酸菌制剂的添加促进了青贮发酵,加速了对WSC和ADF的分解,因此显著降低了青贮饲料的WSC和ADF含量。
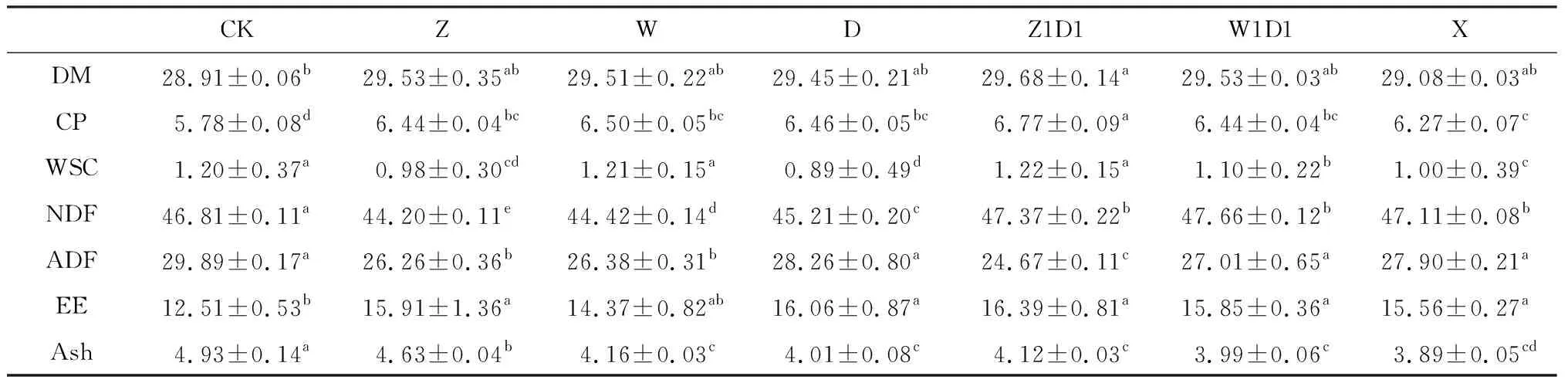
表6 乳酸菌制剂对全株玉米青贮饲料营养成分的影响Table 6 Effects of Lactic acid bacteria preparation on nutrient composition of whole corn silage 单位:%
2.2.4对有氧稳定性的影响 图5可知,与CK相比,添加自制或商用乳酸菌制剂(Z处理除外)可显著增加全株玉米青贮饲料的有氧稳定性(P<0.05),以X处理有氧稳定性最好,达到了215.6 h,较CK提高了1.87倍,其次是D,W1D1,Z1D1处理,分别为141 h,131 h,124 h,较CK提高了88%,74.7%和65.3%。
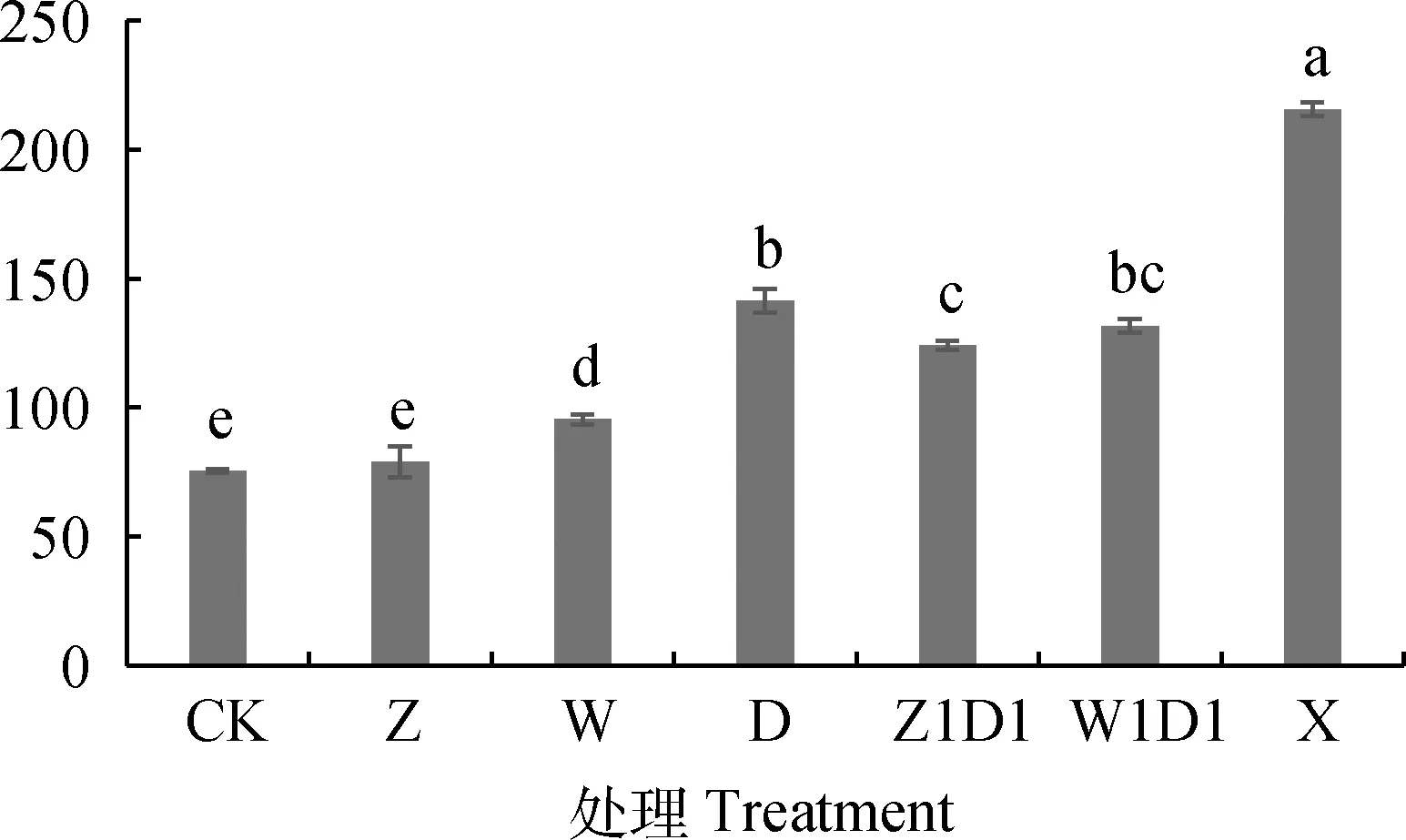
图5 乳酸菌制剂对全株玉米青贮饲料有氧稳定性的影响Fig.5 Effect of lactic acid bacteria preparation on aerobic stability of whole corn silage
2.2.5对综合品质的影响 图6可知,不同处理全株玉米青贮品质优劣排序为Z1D1>W1D1=X>W>D>Z>CK。与CK相比,自制或商用乳酸菌制剂的添加可显著提高全株玉米青贮饲料的品质,但不同处理间存在一定的差异,以Z1D1处理综合评分最高,其次是W1D1和X处理。与本土优质乳酸菌和商用乳酸菌的添加效果相比,本试验发现本土优质乳酸菌复合菌液的添加效果优于或接近于商用乳酸菌制剂,但本土优质乳酸菌单一菌液的添加效果不是很理想。在全株玉米青贮中,需要将同型和异型的乳酸菌进行合理搭配,以便更好的发挥添加效果。
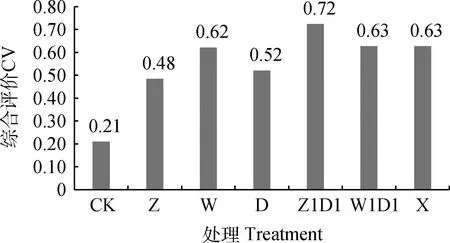
图6 不同处理全株玉米青贮品质综合评价 Fig.6 Comprehensive evaluation of whole plant corn silage under different treatments
3 讨论
3.1 昆明本土青贮饲料中优质乳酸菌的筛选和鉴定
受地理、气候、品种等因素的影响,青贮原料表面附着的微生物种类及数量存在显著差异[9]。本研究以3种青贮样品为材料,从中分离出83株乳酸菌,其中,从青贮玉米和紫花苜蓿青贮饲料中分离出的优势菌种是植物乳杆菌和短乳杆菌,与付浩等[13]研究结论一致,但不同于Yang等[13]的研究结果,可能是气候因子不同,致使同种青贮饲料表面附着乳酸菌种群结构和数量存在一定差异[5,9]。
生长速率和产酸速率是优质乳酸菌筛选中两个非常重要的指标[7]。不同种类的乳酸菌其产酸能力和生长能力不同[24]。有研究表明,同型发酵乳酸菌在发酵初期便能快速产酸,且发酵效率更高,可作为青贮启动菌[20-21]。本研究表明,同型发酵乳酸菌植物乳杆菌B16和戊糖片球菌C23具有良好的产酸能力,异型发酵乳酸菌短乳杆菌B10产酸能力相较于前两者略低,但该菌株在提高青贮饲料有氧稳定性方面具有较大潜力[22]。
3.2 昆明本土优质乳酸菌的应用效果
乳酸菌能够改变青贮饲料内的微生物体系,促进青贮发酵,进而改善青贮发酵品质[22-27]。大量研究表明,添加乳酸菌能显著降低青贮饲料的pH值和NH3-N含量,提高其乳酸含量[5,8,23-26],有效保存青贮饲料的DM和CP含量[20,23,27-28]。本研究表明,与CK相比,添加优质本土乳酸菌复合菌液可促进全株玉米产生较多的乳酸和乙酸,抑制有害菌对DM,CP及氨基酸的分解,降低其NH3-N含量,有效提升青贮玉米的发酵品质并有效保存营养物质。相比较而言,单一菌液作用效果不如复合菌液显著。本研究还发现,与添加商用乳酸菌制剂相比,添加优质本土乳酸菌菌液调制的青贮饲料其DM和CP含量更高,表明本研究筛选出的优质本土乳酸菌在营养物质的保存上发挥了较好的效果,具有良好的青贮潜能。
有氧稳定性在生产应用中是评估青贮质量的一个重要指标[29]。青贮饲料开罐后暴露于空气中,有害微生物利用乳酸及多余糖类、氨基酸和蛋白质,通过一系列的生理活动,不断释放热量,进而造成青贮饲料的有氧变质[30]。本研究显示,与CK相比,优质本土乳酸菌菌液的添加提高了青贮玉米的有氧稳定性,以单独添加异型发酵乳酸菌菌液或同型异型配合添加效果较好,与前人研究结论一致[31]。本研究还发现,与商用乳酸菌相比,优质本土乳酸菌对青贮饲料有氧稳定性的提升效果相对较差,分析原因为参试商用乳酸菌是植物乳杆菌和布氏乳杆菌按1∶9配比制成的复合菌剂,其布氏乳杆菌配比较高。布氏乳杆菌属异型发酵乳酸菌,其主要作用是产生乙酸,抑制有害菌滋生,提高青贮饲料的有氧稳定性[7,22]。本试验添加的复合菌液,是同型和异型乳酸菌按1∶1配比制成的复合菌液。与商用乳酸菌相比,异型发酵乳酸菌占比偏低,因此其对有氧稳定性的提升效果相对较差。本研究筛选出的优质本土菌液研发商用复合菌液时,后续研究应进一步提高异型发酵乳酸菌的占比。
4 结论
本研究从昆明地区全株玉米、紫花苜蓿、鸭茅3种青贮饲料中筛选出生长速度快,产酸能力强的3株优质乳酸菌,鉴定为短乳杆菌B10、植物乳杆菌B16及戊糖片球菌C23。添加优质本土乳酸菌单一菌液或复合菌液的添加可更好的保存青贮饲料的DM及CP含量,但优质本土乳酸菌对青贮饲料有氧稳定性的提升效果相对较差。综合得出,添加本土优质乳酸菌制剂能够改善全株玉米的青贮发酵品质、营养成分含量和有氧稳定性。
